登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
金免疫技术的特点是以胶体金作为标记物。这一技术在70年代初期由Faulk和Taylor始创,最初用于免疫电镜技术。迄今为止,金标记仍主要用于免疫组织化学中。在免疫测定中,金标记常与膜载体配合,形成特定的测定模式,典型的如斑点免疫渗滤试验和斑点免疫层析试验等,已是目前应用广泛的简便、快速检验方法。 第一节免疫胶体金的制备 一、胶体金的特性和制备 (一)胶体金的结构 胶体金(colloidalgold)也称金溶胶(goldsol),是由金盐被还原成原金后形成的金颗粒悬液。胶体金颗粒由一个基础金核(原子金Au)及包围在外的双离子层构成,紧连在金核表面的是内层负离子(AuC12-),外层离子层H+则分散在胶体间溶液中,以维持胶体金游离于溶胶间的悬液状态。 胶体金颗粒的基础金核并非是理想的圆球核,较小的胶体金颗粒基本是圆球形的,较大的胶体金颗粒(一般指大于30nm以上的)多呈椭圆形。在电子显微镜下可观察胶体金的颗粒形态。 (二)胶体金的特性 1.胶体性质胶体金颗粒大小多在1~100nm,微小金颗粒稳定地、均匀地、呈单一分散状态悬浮在液体中,成为胶体金溶液。胶体金因而具有胶体的多种特性,特别是对电解质的敏感性。电解质能破坏胶体金颗粒的外周永水化层,从而打破胶体的稳定状态,使分散的单一金颗粒凝聚成大颗粒,而从液体中沉淀下来。某些蛋白质等大分子物质有保护胶体金、加强其稳定性的作用。 2.呈色性微小颗粒胶体呈红色,但不同大小的胶体呈色有一定的差别。最小的胶体金(2~5nm)是橙黄色的,中等大小的胶体金(10~20nm)是酒红色的,较大颗粒的胶体金(30~80nm)则是紫红色的。根据这一特点,用肉眼观察胶体金的颜色可粗略估计金颗粒的大小。 3.光吸收性胶体金在可见光范围内有一单一光吸收峰,这个光吸收峰的波长(λmax)在510~550nm范围内,随胶体金颗粒大小而变化,大颗粒胶体金的λmax偏向长波长,反之,小颗粒胶体金的λmax则偏于短波长,表19-1所列为部分胶体金的λmax。 (三)胶体金的制备 1.制备方法胶体金的制备多采用还原法。氯金酸(HauC14)是主要还原材料,常用还原剂有柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等。根据还原剂类型以及还原作用的强弱,可以制备0.8nm~150nm不等的胶体金。最常用的制备方法为柠檬酸盐还原法。具体操作方法如下: (1)将HauC14先配制成0.01%水溶液,取100ml加热至沸。 (2)搅动下准确加入一定量的1%柠檬酸三钠(Na3C6H5O7·2H2O)水溶液。 (3)继续加热煮沸15min。此时可观察到淡黄色的氯金酸水溶液在柠檬酸钠加入后很快变灰色,续而转成黑色,随后逐渐稳定成红色。全过程约2~3min。 (4)冷却至室温后用蒸馏水恢复至原体积。 用此法可制备16~147nm粒径的胶体金。金颗粒的大小取决于制备时加入的柠檬酸三钠的量。表19-1列举制备4种不同粒径胶体金时柠檬酸三钠的用量。 表19-1 四种粒径胶体金的制备及特性 胶体金粒径(nm) | 1%柠檬酸三钠加入量(ml)* | 胶体金特性 | 呈色 | λmax | 16 | 2.00 | 橙色 | 518nm | 24.5 | 1.50 | 橙红 | 522nm | 41 | 1.00 | 红色 | 525nm | 71.5 | 0.70 | 紫色 | 535nm |
*还原100ml0.01%HauC14所需量 2.注意事项 (1)氯金酸易潮解,应干燥、避光保存。 (2)氯金酸对金属有强烈的腐蚀性,因此在配制氯金酸水溶液时,不应使用金属药匙称量氯金酸。 (3)用于制备胶体金的蒸馏水应是双蒸馏水或三蒸馏水,或者是高质量的去离子水。 (4)是以制备胶体金的玻璃容器必须是绝对清洁的,用前应先经酸洗并用蒸馏水冲净。最好是经硅化处理的,硅化方法可用5%二氯甲硅烷的氯仿溶液浸泡数分钟,用蒸馏水冲净后干燥备用。 (5)胶体金的鉴定和保存:胶体金的制备并不难,但要制好高质量的胶体金却也并非易事。因此对每次制好的胶体金应加以检定,主要检查指标有颗粒大小,粒径的均一程度及有无凝集颗粒等。 肉眼观察是最基本也是最简单和方便的检定方法,但需要一定的经验。良好的胶体金应该是清亮透明的,若制备的胶体金混浊或液体表面有漂浮物,提示此次制备的胶体金有较多的凝集颗粒。在日光下仔细观察比较胶体金的颜色,可以粗略估计制得的金颗粒的大小。当然也可用分光光度计扫描λmax来估计金颗粒的粒径。结制备的胶体金最好作电镜观察,并选一些代表性的作显微摄影,可以比较精确地测定胶体金的平均粒径。 胶体金在洁净的玻璃器皿中可较长时间保存,加入少许防腐剂(如0.02%NaN3)可有利于保存。保存不当时会有细菌生长或有凝集颗粒形成。少量凝集颗粒并不影响以后胶体金的标记,使用时为提高标记效率可先低速离心去除凝集颗粒。 二、免疫金的特性和制备 (一)免疫金的特性 胶体金可以和蛋白质等各种大分子物质结合,在免疫组织化学技术中,习惯上将胶体金结合蛋白质的复合物称为金探针。用于免疫测定时胶体金多与免疫活性物质(抗原或抗体)结合,这类胶体金结合物常称为免疫金复合物,或简称免疫金(immunogold)。 胶体金与蛋白质结合的机制尚有十分清楚,一般认为是物理吸附性的。胶体金颗粒带有一层表面阴性电荷,与蛋白质表面的阳性电荷通过静电感应相附。因此环境pH和离子强度是影响吸附的主要因素,其他如胶体金颗粒的大小、蛋白质的分子量及蛋白质浓度等也会影响蛋白质的吸附。 (二)免疫金的制备 1.用0.2mol/LK2CO3或0.1mol/LHC1调节胶体金溶液的pH至选定值。原则上可选择待标记蛋白质等电点,也可略为偏碱。但通常最适反应pH往往需经多次试验才能确定。 在调节胶体金的pH值时应注意,胶体金会阻塞pH计的电极,不可直接将电极插入胶体金溶液中,宜先用终浓度为0.15的聚乙二醇(PEG,20000)稳定胶体金后,再胶体金的pH值。 2.将1/10体积的合适浓度的蛋白质溶液加于胶体金溶液中,放置室温反应2~5min。 由于盐类成分能影响胶体金对蛋白质的吸附,并可使胶体金聚沉,因此待标记蛋白质溶液若含有较高的离子浓度,应在标记前先对低离子强度的蒸馏水透析去盐。 3.加入浓度为0.2%的PEG或BSA以饱和游离的胶体金。 4.离心分离,去除上清液中未结合的蛋白质。离心条件视胶体金颗粒的粒径而异:对5nm金颗粒可选用40000r/min离心1h;8nm金颗粒用25000r/min离心45min;14nm金颗粒用25000r/min离心30min,40nm金颗粒用15000r/min离心30min。 5.轻吸上清液。沉淀用含PEG或BSA的缓冲液悬浮,恢复原体积后再离心。如此洗涤2~4次。以彻底除去未结合的蛋白质。 6.免疫金复合物最终用稀释液配制成工作浓度保存。稀释液通常是加入稳定剂的缓冲液。缓冲溶液常用中性的PBS或Tris缓冲液。 多种蛋白质、葡聚糖、PEG2000、明胶等均为良好的高分子稳定剂,PEG和BSA是最常用的稳定剂。稳定剂有两大作用:一为保护胶体金的稳定性,使之便于长期保存;二为防止或减少免疫金复合物的非特异性吸附反应。稳定剂的合理选择是十分重要的,不适当的稳定剂有时也会导致非特异性反应。 第二节溶胶的基本概念 一、胶体金 即金的水溶液,它也具有一般溶胶的特性。分散体系的分类:体系就是一定空间范围内作为我们研究对象的物质,某一种或几种物质分散到另一种物质中所组成的体系叫做分散体系。被分散相质点的大小而改变,因此,按分散相质点的大小不同,可将分散体系分为三类。 (一)离子分散体系 指分数散相以小分子或离子状态分散着。这种溶液具有高度稳定性,无论放置多久,分散相颗粒都不会因重力而下沉,不会从溶液中分离出来。 (二)胶体分散体系 是指分散相颗粒在1~100nm之间的分散体系叫做胶体分散系。胶体溶液外观透明不浑浊,在普通显微镜下看不见它的分散相粒子,不易受重力影响与分散介质分离沉降,但其中的溶胶粒子有聚结变大的倾向,即具有聚结不稳定性。 (三)粗分散体系 分散相颗粒是由许多分子组成,因粒子较大,用肉眼或显微镜即可看见,不稳定,极易因重力而自动沉降,外观浑浊不透明。 二、胶体金的一般性状 (一)胶体金的颜色 溶胶的颜色决定于分散相物质的颜色、分散相物质的散度和入射光线和种类,是散射光还是透射光,粒子越小,分散度越高,则散射光的波长越短,对同一种物质的水溶胶来说,粒子大小不同,颜色亦不同,胶体金颗粒在5~20nm之间,吸收波长520nm,呈葡萄酒红色,20~40·nm之间吸收波长530nm,液体为深红色,60nm的金溶液主要吸收波长600nm,金溶液呈兰紫色,若离心去掉较大的金颗粒,溶胶呈红色。 (二)胶体金的稳定性 溶胶的稳定性介于小分子离子溶液和粗分散系之间,溶胶的颗粒作布朗运动,不易受重力影响下沉。然而溶胶又是不稳定体系,它的胶粒溶剂化作用很弱,总表面积较大,当胶粒相互碰撞时,有自动合并为较大、较重的颗粒倾向。胶体颗粒变大以致超出胶体范围而从介质中沉淀出来的现象叫聚沉。影响溶胶稳定性的主要原因有三点:①胶粒间的相互吸引力。当胶粒相距很近时,这种吸引力可能导致胶粒合并变大。②胶粒及其溶剂化层(溶剂是水就是水化层)的带电情况。一种溶胶的各个胶粒都带有相同的电荷。同性电荷相斥,双电层愈厚,胶粒带电量愈大,排斥力愈大,愈能阻止胶粒合并聚结,溶胶愈稳定。③胶体界面的溶剂膜,当二固体间夹有一厚层液体时,这层液体膜有一个反抗二固体接近的排斥力。两个胶粒要进一步接近,只有克服它们之间的溶剂化膜的斥力才有可能,因此溶剂膜的斥力是使溶胶稳定的原因之一。 (三)溶胶的聚沉现象 胶粒之间存在吸引力与排斥力这对矛盾,在溶胶颗粒带电及溶剂化的情况下,排斥力成为矛盾的主要方面,溶胶稳定而不聚沉。因为某种原因使溶胶颗粒带电量减到很小甚至中和;其所带电荷并能去溶剂化膜,胶粒之间可在更近的距离互相接近,引力成为主要矛盾,引力超过斥力时胶粒便聚结发生聚沉。引起溶胶聚沉的原因有: 1.少量电介质对溶胶的聚沉作用 少量电介质即可使溶胶聚沉,但各种电介质的聚沉能力可用聚沉值来表示,聚沉值愈小,聚沉能力愈大,聚沉值从实验中得出如下的离子价规则:①电介质负离子对带正电的溶胶起主要聚沉作用,正离子对带负电的溶胶起主要聚沉作用。②同价离子聚沉能力几乎相等,不同价离子的聚沉能力随离子价的增加而显著增加。电介质为什么能使溶胶聚沉呢?这是由于电介质与胶粒带相反电荷的离子的作用,中和了胶粒所带的一部分电荷,使胶粒电荷量减少,扩散层缩小,溶剂化层变薄,而当双电层厚度缩至很小的溶剂化层变得很薄时,两个胶粒间便可以更加接近即不产生斥力,两个胶粒间因引力加大而合并的趋势增强,甚至引力占绝对优势以致使胶粒聚结而发生聚沉。胶粒的双电层结构见图5-1。
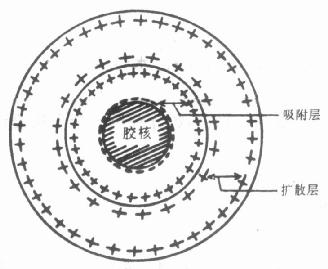
图5-1 胶粒的双电层结构示意图 2.温度对溶胶稳定性的影响 一般影响不大,当温度升高时,吸附能力减弱,溶剂化程度降低,溶剂化层变薄,胶粒聚结,不稳定性增加。 3.浓度对溶胶的稳定性的影响浓度增大时,粒子间距离缩小,引力增加,容易聚结而发生聚沉,所以制备比较稳定的溶胶,要有一定的合适浓度。 校对 第三节胶体金的制备方法 胶体金溶液的制备有许多种方法,其中最常用的是化学还原法,基本的原理是向一定浓度的金溶液内加入一定量的还原剂使金离子变成金原子。目前常用的还原剂有:白磷、乙醇、过氧化氢、硼氢化钠、抗坏血酸、枸橼酸钠、鞣酸等,下面分别介绍制备不同大小颗粒的胶体金溶液。 一、制备胶体金的准备 (一)玻璃器皿的清洁 制备胶体金的成功与失败除试剂因素以外玻璃器皿清洁是非常关键的一步。如果玻璃器皿内不干净或者有灰尘落入就会干扰胶体金颗粒的生成,形成的颗粒大小不一,颜色微红、无色或混浊不透明。我们的经验是制备胶体金的所有玻璃器皿先用自来水把玻璃器皿上的灰尘流水冲洗干净,加入清洁液(重铬酸钾1000g,加入浓硫酸2500ml,加蒸馏水至10000ml)浸泡24h,自来水洗净清洁液,然后每个玻璃器皿用洗洁剂洗3~4次,自来水冲洗掉洗洁剂,用蒸馏水洗3~4次,再用双蒸水把每个器皿洗3~4次,烤箱干燥后备用。通过此方法的处理玻璃器皿不需要硅化处理,而直接制备胶体金。也可用已经制备的胶体金溶液,用同等大不颗粒的金溶液去包被所用的玻璃器皿的表面,然后弃去,再用双蒸水洗净,即可使用,这样效果更好,因为减少了金颗粒的吸附作用。 (二)试剂的配制要求 (1)所有配制试剂的容器均按以上要求酸处理洗净,配制试剂用双蒸馏水或三蒸馏水。 (2)氯化金(HauCl4水溶液的配制:将lg的氯化金一次溶解于双蒸水中配成1%的水溶液。放在4”c冰箱内保存长达几个月至1年左右,仍保持稳定。 (3)白磷或黄磷乙醚溶液的配制:白磷在空气中易燃烧,要格外小心操作。把白磷在双蒸水中切成小块,放在滤纸上吸于水份后,迅速放入已准备好的乙醚中去,轻轻摇动,等完全溶解后即得饱和溶液。储藏于棕色密闭瓶内,放在阴凉处保存。 二、制备胶体金的方法和步骤 (一)白磷还原法 1.白磷还原法(Z Sigmondy 1905年) (1)取1%的HAuCl4水溶液1ml,加双蒸水99ml配成0.01%的HAuCl4水溶液。 (2)用0.2mol/L K2CO3调pH至7.2。 (3)加热煮沸腾,迅速加入0.5ml 20%白磷的饱和乙醚溶液,振荡数分钟至溶液呈现橙红色时即成。胶体金的颗粒直径为3nm左右,大小较均匀。 2.白磷还原法(Z Sigmondy 1905及Z Sigmondy Thiessen 1925) (1)取0.6%的HAuCl4水溶液2.5ml,加双蒸水120ml 。 (2)用0.2mol/L K2CO3,调pH至中性。 (3)加入1/5饱和度的白磷乙醚溶液1ml(1份白磷4份乙醚),在室温振荡约15min ,溶液呈红褐色,再加热至典型的葡萄酒红色,加热可使乙醚蒸发,胶体金液体内过量的白磷通入空气后被氧化,此方法获得胶体金颗粒的直径在5~12nm之间。 3.白磷还原法的改良法(Henegouwen 1986) (1)取20%饱和度白磷乙醚溶液0.5ml,加双蒸水60ml 。 (2)用1%的HAuCl4水溶液0.75ml, 加0.1mol/L K2CO30.6ml, 振荡变成棕红色。 (3)加热煮沸,至溶液变成透明红色。 使用上述方法增加还原次数使金颗粒直径不断增大,二者之间的关系见表5-1。 表5-1 胶体金颗粒大小与还原次数之间的关系 还原次数 | 颗粒直径(nm) | 正负误差 | 1 | 5.6 | 0.9 | 2 | 6.7 | 0.9 | 3 | 7.9 | 0.9 | 4 | 9.8 | 1.3 | 5 | 12 | 1.0 |
此方法主要优点是简化了制备不同大小的颗粒胶体金的手续和其它试剂的配制,经济、操作简单。另外,在多次还原过程中氯化金不再形成新的金颗粒,只是在原先金粒子基础上使它的直径变大。第一次金颗粒起着“晶核”的作用。由于这一特点,制备的金颗粒相对均匀一致。 (二)抗体血酸还原法(Stathis and Fabrikanos 1958) (1)将在4℃预冷的1%HAuCl4水溶液1ml,0.2mol/L K2CO31.5ml、双蒸水25ml混匀。 (2)在搅拌下加入1ml 0.7%抗坏血酸水溶液,立即呈现紫红色。 (3)加双蒸水至100ml,加热至溶液变为透明红色为止。胶体金颗粒直径为8~13nm。 (三)柠檬酸三钠还原法(Frens 1973) 此方法是由Frens在1973年创立的,制备程序很简单,胶体金的颗粒大小较一致,广为采用。该法一般先将0.01%的HAuCl4溶液加热至沸腾,迅速加入一定量1%柠檬酸三钠水溶液,开始有些蓝色,然后浅蓝、蓝色,再加热出现红色,煮沸7~10min出现透明的橙红色。各种颗粒的胶体金制备详见表5-2。 表5-2 柠檬酸三钠用量与胶体金颗粒直径的关系 0.01%的HAuCl4(ml) | 1%柠檬酸三钠(ml) | 直径(ml) | 100 | 5.0 | 10.0 | 100 | 4.0 | 15.0 | 100 | 1.5 | 25.0 | 100 | 1.0 | 50.0 | 100 | 0.75 | 60.0 | 100 | 0.60 | 70.0 | 100 | 0.42 | 98.0 | 100 | 0.32 | 147.0 | 100 | 0.25 | 160 |
按照Frens法还可以制备出其它不同颗粒大小的胶体金出来。许多研究证明用该法制备胶体金时金颗粒的大小是柠檬酸三钠用量的函数,基本的规律是柠檬酸三钠用量多,胶体金颗粒直径小,柠檬酸三钠用量越少,腔体金颗粒直径越大。 (四)鞣酸—柠檬酸三钠还原法(Slot与Gueeze1985年) 该法是以1982年Muhlpfordt法为基础,1985年Slot与Geuze对该法进行了改良,特点是通过改变鞣酸的用量制备出多种颗粒直径的胶体金,而且颗粒的直径均匀一致,很适合于双标及多标研究。制备3nm、5nm、10nm、15nm的胶体金颗粒见表5-3。 表5-3 鞣酸—柠檬酸三钠还原法 A 液 | B 液 | 直径(nm) | 1%柠檬酸钠(ml) | 0.1mol/L K2CO3ml | 1%鞣酸(ml) | H2O(ml) | 1%HAuCl4(ml) | H2O(ml) | 3.3 | 4 | 0.2 | 4 | 11.8 | 1 | 79 | 5 | 4 | 0.2 | 0.7 | 15.1 | 1 | 79 | 10 | 4 | 0.025 | 0.1 | 15.875 | 1 | 79 | 15 | 4 | 0.0025 | 0.01 | 15.987 | 1 | 79 |
操作步骤: (1)根据所需要的胶体金颗粒分别配制A液和B液。 (2)将配制好的A、B两液在水浴内加热到60℃,并通过控温装置使温度保持稳定。 (3)在电磁搅拌器上搅拌A液迅速加入B液,继续加热直至胶体金变成葡萄酒色,时间大约7~10min。在A、B两液混合后可见溶液立即变成蓝色,大约1~3 min就变成红色。 用鞣酸—柠檬酸三钠还原法,柠檬酸三钠主要为还原剂,而鞣酸则有双重作用,一是还原作用,二是保护作用,控制“晶核”的形成过程,也就是说鞣酸的用量多少决定胶体金颗粒的大小形成,因此改变鞣酸的用量就可以改变胶体金的颗粒大小,达到制备不同直径颗粒的胶体金之目的。 (五)乙醇超声波还原法(Baigent and Muller 1980) (1)1%HAuCl4水溶浓0.2ml加入100ml双蒸水。 (2)用0.2molK2CO3调pH至中性,再加入1ml乙醇。 (3)用20KC、125w超声波探头浸入溶液内进行超声振荡,由此法制得的胶体金颗粒为6~10nm。 (六)硼氢化钠还原法(Tschopp et al 1982) (1)将预冷在4℃的40ml双蒸水中加入0.6ml 1%的HAuCl4。 (2)再加入0.2molK2CO3,0.2ml。 (3)在搅拌下,迅速加入新鲜配制的硼氢化钠水溶液(0.5mg/ml)0.4ml,一般重复加入3~5次,直至溶液的兰紫色变为橙红色为至。然后再搅拌5min,获得的金颗粒直径在2~5nm之间。 (七)放射性胶体金的制备方法(Kent and Allen 1981) (1)取0.01% HAuCl4 上水溶液100ml,加热至沸腾。 (2)加入40μl195Au。 (3)迅速加入4ml1% 柠檬酸三钠水溶液,5~7min出现透明的橙红色。 (4)其含量为I×106脉冲数/min。 (八)微波制备液体金方法。 第四节胶体金的质量鉴定 胶体金制备完毕后须经电镜下质量鉴定才能应用。 一、胶体金颗粒直径测定 用预先处理好的覆有Formvar膜的镍网浸入胶体金溶液内,取现放在空气中干燥或37℃烤箱烤干。然后在透射电镜下观察,主要观察金颗粒的大小,符合不符合所需要的颗粒直径,金颗粒是否均匀一致,有无椭圆形及多角形金颗粒存在。理想的金颗粒是大小基本相等,均匀一致,无椭圆形及多角形的金颗粒存在,还可以拍片放大后测量金颗粒直径的大小。 二、胶体金金颗粒均匀度测定 一般需测量100个以上的胶体金颗粒,然后用统计学处理,计算胶体金颗粒的平均直径及标准差,前者反映颗粒的大小,后者说明颗粒是否均匀一致。 三、影响胶体金颗粒大小的因素 如果有较多的大小不等的金颗粒及有椭圆形,三角形金颗粒存在应重新制备。一般造成这种情况的主要原因是在加还原剂的时候不是迅速一次加入,而是多次加入。再者搅拌不均匀,速度太慢没有搅拌起来,造成了颗粒大小不等。制备量的多少,容器的大小,加热的时间等也影响胶体金颗粒的大小。制备了合格的胶体金以后,放在室温或4℃保存。避免低温冻存,因为冻存可导致胶体金凝集,破坏了胶体状态。胶体金在室温避光无灰尘的环境中可放置3个月左右。冰箱内半年左右。根据胶体金的性质,有不稳定和聚沉的可能性,因此,制备完毕后最好在20天以内进行标记。 第五节胶体金标记物的制备 胶体金标记蛋白质的原理,一般认为是由于pH值等于或稍偏碱于蛋白质等电点时,蛋白质呈电中性,此时蛋白质分子与胶体金颗粒相互间的静电作用较小,但蛋白质分子的表面张力却最大,处于一种微弱的水化状态,较易吸附于金颗粒的表面,由于蛋白质分子牢固地结合在金颗粒的表面,形成一个蛋白层,阻止了胶体金颗粒的相互接触,而使胶体金处于稳定状态,如果=低于蛋白质的等电点时,蛋白质带正电荷,胶体金带负电荷,二者极易静电结合形成大的聚合物。如果pH高于蛋白质等电点时,蛋白质带负电荷,与金颗粒的负电荷相互排斥而不能互相结合。为防止蛋白质与胶体金的聚合与沉淀,常用牛血清白蛋白,卵白蛋白,聚乙二醇或明胶作稳定剂。用Sephacryb S—400(丙烯葡聚糖S—400 )层析分离纯化胶体金蛋白标记物只适用于以BSA作稳定剂者。 一、待标记蛋白质的准备 (1)透析除盐:蛋白质溶液内应除去多余的电解质,不然过高的盐类物质会降低胶体金颗粒的Zeta电位,影响蛋白质的吸附,因此,标记之前必须彻底除盐。一般将蛋白质置入透析袋中然后直接放入双蒸水或极低浓度的盐水(0.005mol/L NaCl , pH7.0)透析。 (2)去除蛋白质中的沉淀:长期低温保存的蛋白质或4℃较长时间保存的抗体,特别是在浓度高于2mg/ml的情况下,很容易形成聚合物,聚合物对标记过程及免疫金探针的稳定性有一定影响,因此,标记之前须离心以除去这些聚合物。一般以100000r/min 4℃离心60min取上清液,调整蛋白质浓度至1mg./ml即可用于标记。 二、胶体金pH值的调整 胶体金与蛋白质的结合成功与否,取决于pH值,一般只有在蛋白质等电点(PI)略偏碱的条件下二者才能牢固地结合,因此,标记之前须将胶体金溶液的pH值调至待标记蛋白质的等电点略偏碱。需要提高胶体金的pH值时可用0.1molK2CO3,需要降低胶体金的pH值时可用0.1N HCl。测定金溶液的pH可能损害pH测定计的探头,因此,一般用精密的pH试纸测定其pH即可。 几种常用的蛋白质标记时胶体金所用的pH值见表5-4。 表5-4 常用几种蛋白质标记时胶体金所用的pH值如下 蛋白质 | pH | 抗体(γ球蛋白) | 9.0 | 亲合层析的IgG | 7.6 | 单克隆抗体 | 8.2 | F(ab')2 | 7.2 | SPA(葡萄球菌蛋白) | 6.0 | 蓖麻子植物凝血素Ⅰ | 8.0 | 蓖麻子植物凝血素Ⅱ | 8.0 | 花生凝集素 | 6.3 | Helix pomatia lectin | 7.4 | 大豆凝集素 | 6.1 | Lens Culinaris lectin | 6.9 | Lotus Tetragonolobus lectin | 6.3 | 荆豆凝集素 | 6.3 | Bandeirae simplicifolia lectin | 6.2 | 过氧化物酶 | 8.0 | 类卵粘蛋白 | 4.8 | 血浆铜兰蛋白 | 7.0 | α-胎球蛋白 | 6.5 | 小牛血清白蛋白 | 6.5 | 牛血清白蛋白 | 5.5 | 牛血球白蛋白结合肽 | 4.5 | 牛血清白蛋白结合胰岛素 | 5.3 | 霍乱毒素 | 6.9 | 破伤风毒素 | 6.9 | DNAase | 6.0 | RNAase | 9.0 | 低密度脂蛋白 | 5.5 | α2-巨球蛋白 | 6.0 | 抗生物素蛋白(亲合素) | 10.0 | 链霉抗生物素蛋白 | 6.6 | 麦胚凝集素 | 9.9 |
三、待标记蛋白质最适稳定量的测定 (1)光电比色法:制备一系列不同浓度的等体积蛋白质溶液(1ml),分别加入5ml胶体金中,迅速混匀,然后,各加入1ml 10% NaCl溶液,摇匀,静置5min后测各管。根据胶体金颗粒的大小,OD在520~580nm之间测定,以OD值为纵坐标,蛋白质用量为横坐标作一曲线,取曲线最先与横轴相接近的那一点处的蛋白质用量为最适稳定量。图5.2中10nm的胶体金溶液中蛋白质的最适稳定量为45μg/ml。
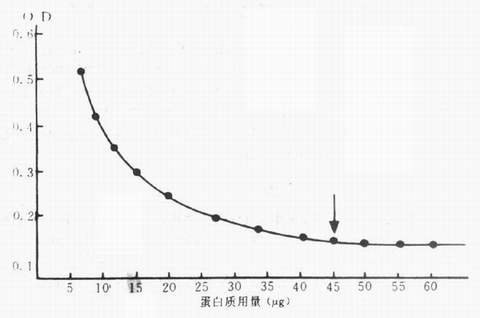
图5-2 蛋白最适稳定量示意图 (2)目测法:以目测法确定胶体金与待标记蛋白质用量比例,将标记的蛋白质逐级稀释后(由5μg~45μg另设对照管),各取等体积顺序加入一系列装有1ml胶体金的试管中,5min后,在上述各管内分别加入0.1ml 10%氯化钠,依表5-5顺序进行。 表5-5 具体的做法是按表内进行 管数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 胶体金(ml) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 蛋白质(μg) | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 0 | 10%NaCl(ml) | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
①当分别加入0.1ml 10%氯化钠后、混匀静置2h以上观察结果。 ②没有加入蛋白质的管为对照管。 ③小于5nm颗粒的胶体金溶液,每个管内应加入5μl33%的双氧水,否则有不变蓝色及聚沉现象。未加蛋白及加入蛋白量不足以稳定胶体金的试管,即呈现由红变蓝的聚沉现象,而加入蛋白量达到或超过最低稳定量的试管则胶体金的红颜色不变。其中含蛋白量最低的试管即含稳定1ml胶体金的必须蛋白量。在此基础上再加上20%即为稳定所需蛋白质的实际用量。 四、蛋白质的胶体金标记 当蛋白质的最适稳定量及标记的最佳pH值被确定以后便可进行标记。具体步骤如下: (1)根据用以标记的胶体金的总量计算出所需要的待标记蛋白质的总量。 (2)在电磁搅拌下,将蛋白质溶液加入胶体金溶液中(pH已调至PI超过0.5pH),加入蛋白质时应逐滴加入,1mg的蛋白质大约5min加完。 (3)在磁性搅拌下加入5%的牛血清白蛋白(BSA)使其终浓度为1%,或加入3%聚乙二醇(PEG MW20000)使其终浓度为0.05%, 我们对比了BSA和PEG稳定胶体金的效果,BSA稳定的标记胶体金,放在4℃达2年半仍然保持良好性能,而用PEG稳定的标记胶体金放在4℃1年左右就有分层现象,而且染色效果显著下降。因此,我们认为最好还是用BSA作稳定剂。 (4)将标记好的胶体金装入透析袋中,两头扎紧,放入蔗糖或硅胶中浓缩,浓缩到原体积的1/10量,浓缩完毕后纯化。离心法纯化时,不要浓缩。 五、胶体金标记蛋白质的纯化 标记好的免疫金探针必须经过纯化处理以后才能用于免疫细胞化学染色。纯化的目的是除去其中未标记的蛋白质,未充分标记的胶体金以及在标记过程中可能形成的各种聚合物。 (一)调整与超速离心法 (1)将标记的大于10nm的胶体金溶液选用15000r/min 4℃离心15min,吸出上清,弃去沉淀,以去除大的聚合物。 (2)一般在10nm以上所标记的胶体金均可在调整离心机上离心,小于10nm颗粒的胶体金用超速离心机离心,在4℃离心1h左右,弃上清,将沉淀以原体积的0.02mol./L TBSpH8.2(内含1%BSA,0.05%叠氮钠)溶解,重复离心2~3次,沉淀溶于原体积的1/10TBS中。4℃保存备用。为了得到颗粒均匀一致的免疫金试剂,上述粗提制剂可用10%~30%蔗糖或甘油溶液作密度梯度离心,分带收集不同大小颗粒的胶体金标记蛋白制剂。 几种免疫金探针离心所用转速(见表5-6),离心纯化时所用转速见表5-7,胶体金的OD值见表5-8。 表5-6 几种免疫金探针离心时所用转速参考表 胶体金颗粒直径(nm) | 蛋白质 | 时间(min) | 转速(r) | 3.0 | GAR IgG | 60 | 30000 | 5.0 | GAR IgG | 50 | 25000 | 10.0 | RAM IgG | 50 | 19000 | 15.0 | SPA | 40 | 17000 | 15.0 | ALcc IgG | 40 | 17000 | 20.0 | SPA | 40 | 13000 | 25.0 | SPA | 35 | 12000 |
说明:GAR IgG=羊抗兔IgG;RAM IgG=兔抗鼠IgG;ALcc IgG=抗肝细胞癌IgG; SPA=葡萄球菌A蛋白 表5-7 几种免疫金探针离心纯化时所用转速 胶体金颗粒(nm) | pH | 蛋白质 | 转速(xg) | 时间(min) | 5 | 9.0 | 羊抗人IgG | 45000 | 45 | 10 | 8.2 | 抗胃癌单克隆抗体 | 45000 <, /TD> | 30 | 15 | 6.5 | 链霉亲和素 | 12000 | 45 | 20 | 6.0 | SPA | 12000 | 30 |
将纯化好的胶体金用0.02mol/L TBS缓冲液作1:20稀释,用520nm测OD值。 表5-8 不同大小胶体金的OD值 胶体金颗粒大小(nm) | OD(520)nm | 5 | 2.5 | 10 | 2.5 | 15 | 3.5 | 20 | 5.0 |
(二)凝胶过滤法 为纯化免疫金探针的最好方法,其特点是简便,过滤的胶体金颗粒比较均匀,不容易凝集,而离心方法转速高,时间长,胶体金颗粒沉淀容易凝集,用凝胶过滤克服了这一弱点。选用本方法时胶体金溶液必须用牛血清白蛋白作稳定剂。具体操作过程如下: (1)将浓缩好的胶体金以1500r/min离心去掉大的聚合物。吸出上清待过柱。 (2)柱高34cm,直径1cm,加样体积为柱床体积的1/10。 (3)丙烯葡聚糖S-400(Sephacryls—400 , Pharmacia, Sweden)装柱后用0.02mol/L pH8.2 TBS平衡层析柱(pH7.4者用于标记的SPA),平衡好后,吸取上清胶体金液体加入层析柱内,加样时请注意不要破坏S—400的界面。 (4)用0.02mol/L pH8.2 TBS洗脱,先行滤出的液体有少量微黄不透亮的液体,紧接着是浓度高红色而透亮的胶体金,注意颜色的变化,如红色变淡,变黄立刻停止收集。如Sephacryls—400没有,也可以用Sepharose –4B或6B代替(Pharmacia, Sweden)也能收到较好的效果。 六、免疫金探针的鉴定 (1)用有Formvar 膜的镍网沾取金标蛋白溶液,空气中干燥后醋酸铀复染,在TEM下观察,可见金颗粒周围有一明显的空晕,表示颗粒表面吸附有蛋白质分子。 (2)纯化后免疫金探针是否保持很好的生物学活性是判断其质量好坏的主要指标,因此,在使用之前必须对它的特异性,敏感性进行鉴定。鉴定举例,用阳性抗原片,脱蜡至水,胰蛋白酶消化,加第一抗体(多克隆或单克隆),一般过夜再加标记抗同一抗特异性抗体结合的胶体金溶液(多克隆或单克隆抗体标记的胶体金)详细方法步骤见后IgGS法,一般做1:2,1:4,1:8,1:16,稀释SPA-金,做1:10,1:20,1:40,1:80稀释,37℃ 45min,冲洗,显色,观察结果,染色效价以阳性结果明确,背景浅的稀释度为标准。免疫细胞化学染色试验可以较全面地反应免疫金探针的质量。 第二节 溶胶 溶胶的分散相粒子即胶体粒子,是由许多分子或原子聚集而成的,因此分散相与分散介质之间存在着相界面,形成多相体系,于是出现了大量界面现象。 一、界面现象 物体的表面是指它与空气或与本身的蒸气接触的面,而物体的表面与另一相接触的面则称为界面。凡是界面上发生的一切物理化学现象统称为界面现象。 (一)界面张力和界面能 由于物质分子与分子间存在相互吸引力的作用,位于表面层的分子和它的内部分子所处的情况是不同的。以液体为例来说明。图9-1中A为处于液体内部的分子,它从各方向所受到相邻分子的引力是均衡的,即作用于该分子上的吸引力的合力等于零。B处于液体表面层的分子,它所受到相邻分子吸引力的合力等于零,而且其合力是指向液体内部并与液面相垂直的。液体表面层的其它分子也都受到同样力的作用,其结果是这种合力企图把表面层的分子拉入液体内部,因面液体表面有自动缩小的倾向。如果想使表面增大,就必须使分子从液体内部反抗引力将其拉到表面,这一过程需要消耗一定量的功,这种功成为表面层分子多余的能量贮藏在表面上。这种液体表面层的分子比内部分子所多余的能量叫界面能(液体——空气),单位是J·m-2。
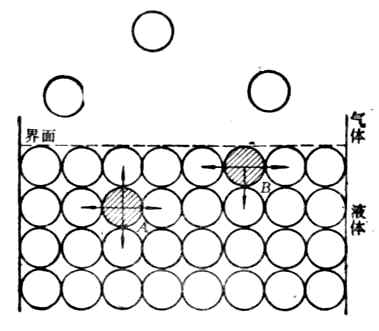
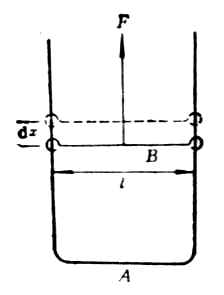
图9-1 表面张力来源 图9-2 表面张力的测量 在图9-2中,线圈A上面有一个无磨擦的滑动线B,将它们浸在(具有一定界面张力的)液体中,在线圈A和滑动线B围绕的平面上形成一层薄膜。因为液体表面有缩小的趋势,滑动线B将自动地向下移动。现在,我们从相反方向施以外拉力F以阻止其移动。这个力F将作用于薄膜的整个边缘l,力的大小随着长度l而改变。从实验中可以看到,作用于这个薄膜整个边缘的是每单位长度的力,这个力称界面张力,单位是N·m-1。也可用单位面积的能表示,称比表面能,单位是J·m-2。故界面张力又称比表面能。 (∵1J=1N·m ∴1J·m-2=1N·m·m-2=1N·m-1) 界面能等于界面张力(σ)与界面积(S)的乘积: E=σ·S 物体的界面能有自动降低的趋势。界面能愈大,降低的趋势也愈大。液体界面能的减小可以通过一种自动过程来实现,即自动减小S或自动减小σ,或者S和σ两者同时减小。 恒温下,液体的σ是一个常数,因此界面能的减小只能通过减小S的办法进行。如水滴常呈球形——界面能最小。在溶液中界面积不变的情况下,界面能的减小只能用减小σ的办法进行,即液体界面从周围介质中自动吸引其它物质分子、原子或离子填入表面层来降低它的σ,即吸附作用。 (二)吸附 溶胶属多相分散系,分散相和分散介质之间有界面存在,对于一定体积的物质,分散粒子愈小,个数愈多,其总面积就愈大,比表面积(即单位体积物质的表面积)也就愈大。例如,当1 cm3的物质分割到每边长10-5-10-7cm大小的立方体时,其比表面积达到60-600m2,因此大大改变了界面性质。 1.固体界面上的吸附 固体的表面不能自动缩小,它只能依赖于吸附其它物质以降低界面能。具有吸附作用的物质叫吸附剂,被吸附的物质叫吸附质。疏松多孔的固体,如活性炭、硅胶、活性氧化铝、铂黑等都是良好的吸附剂。1g良好活性炭的微孔界面积可达1000m2,常用于防毒面具中,也可用作蔗糖脱色。硅胶和活性氧化铝都可用作色层分析中的层析中的层析柱或薄层的吸附剂。铂黑用于氢电极以吸附氢。 2.固体-气体界面上的吸附 气体在固体界面上的吸附作用是可逆的。气体分子可被吸附到吸附剂的界面上,但由于分子的热运动,气体又可能挣脱界面进入气相,这种过程叫解吸。当吸附与解吸达到平衡时,单位质量吸附剂所能吸附气体的量叫做吸附量。吸附是放热过程,解吸是吸热过程。 当温度不变时,增加气体压力,吸附量增加。当气体的压力增加到一定程度时,吸附量达到一极限值,这时吸附剂界面的吸附已达到饱和,这种在给定温度下,以吸附量为纵坐标,以气体压力为横坐标作图所得的曲线,叫等温吸附线(图9-3)。
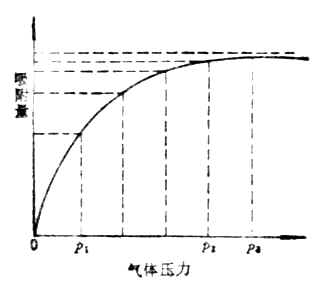
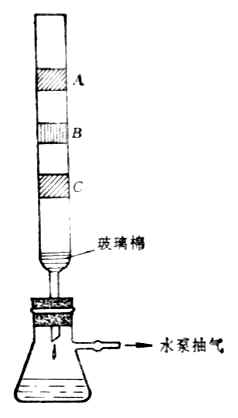
图9-3 吸附等温曲线 图9-4 柱层析法简单装置图 3.固体-液体界面上的吸附 固体-液体界面上的吸附,可能是溶质吸附,也可能是溶剂吸附,通常两者兼有只是程度不同。例如,活性炭从色素水溶液中吸附的色素就远比吸附的水多,因此可以用活性炭使溶液脱色。但是如果把活性炭放入色素的酒精溶液中,由于活性炭对酒精的吸附大于对色素的吸附,故不能用于在酒精溶液中对色素的脱色。 在固体-液体界面上的吸附中,吸附的溶质可以是电解质,也可以是非电解质。 分子吸附指吸附物质的整个分子被吸附在固-液界面上。被吸附物质是非电解质或弱电解质的分子型物质。利用各物质吸附能力的不同,选用适当的吸附剂,可将溶液中的各种溶质的混合物加以分离。利用各种溶质与吸附剂之间吸附能力的不同,使溶质得到分离的方法叫色谱法或层析法。如在一玻璃管(柱型)中,装入某种吸附剂(如氧化铝或硅胶)作为吸附柱。当把含各种溶质的溶液流经管中的吸附柱时,由于不同物质在吸附柱上的吸附能力不同,因而被吸附在柱的不同高度的位置上,最容易吸附的物质在柱的上部,其余依次向下。随后取出吸附柱,分层切开,再用溶剂分别提取,即被分离。或者用溶剂把被吸附物质由吸附柱上洗脱下来。在洗脱过程中,吸附力弱的先被洗出,吸附力强的后被洗出,将洗出液分段收集,同样达到分离的目的。。 例如,用石油醚提取绿叶中的成分:将石油醚加到绿叶中,使其作用后,把渣子滤去,将溶液倒入吸附柱,在柱上依次显出叶绿素、叶红素、胡萝卜素等色层(图9-4中的A,B,C)。然后分别提取即可得各种成分。 二、溶胶的性质 当光波投射到粒子上时,如果粒子大于波长,则光波以一定的角度从粒子表面反射出来。如果粒子远小于光波的波长,则光波绕过粒子前进不受阻碍。当粒子的大小和光波波长接近或稍小时,光波产生散射。溶胶粒子的大小在1-100nm之间,与普通光波波长接近,因此有一定强度的散射现象,称为丁铎尔(Tyndall)现象。即当一束强光投射到溶胶上,在暗室或黑暗背景下,从光束的垂直方向观察,可以清楚地观察到一条光带(图9-5),这是胶体溶液的特点。 溶胶中胶体粒子和溶液中溶质的粒子相似,也处于不停的运动状态,这种不停的无规则的运动称为布朗(Brown)运动(图9-6)。由此表现出与胶体粒子运动有关的性质,称为胶体的分子动力学性质,如扩散、渗透、沉降等。它们和胶体粒子的大小和形状有密切的关系。所以从分子动力学性质出发,可以研究胶体粒子的大小和形状。其次,溶胶由于分子动力学性质,可以保持胶体粒子不因重力作用而沉集在容器底部。这种保持分散相不从分散介质中分离出来的性质,称为动力学稳定性。
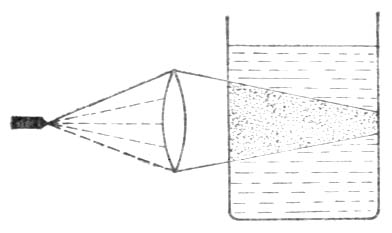
图9-6 丁铎尔现象

图9-6 布朗运动 (一)电泳 1.电泳 在一U形管中,加入棕色的氢氧化铁溶胶(图9-7左),然后插上电极并通直流电,阴极附近颜色逐渐变深,表示氢氧化铁胶体粒子向阴极移动(图9-7右)。如果在U形管中换上硫化砷溶胶并通电,胶体粒子向阳极移动。这种胶体粒子在电场作用下向阳极或阴极移动的现象叫电泳。 2.胶粒带电的原因 (1)选择吸附 由于溶胶胶核常常选择性地吸附作为稳定剂的某种离子,而使其表面带有电荷。溶胶胶核总是选择吸附与其组成相类似的离子。例如Fe(OH)3溶胶,其胶核吸附稳定剂FeO+CL-中的FeO+而带正电荷。
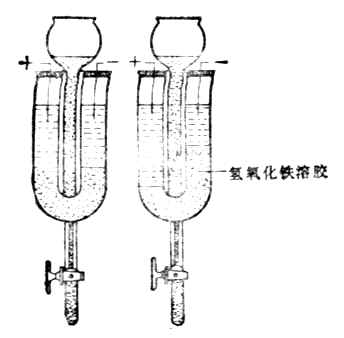
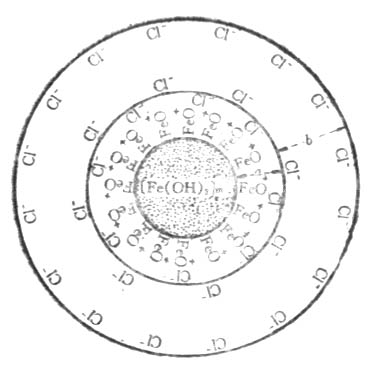
图9-7 氢氧化铁溶胶电泳向负极 图9-8 氢氧化铁胶团结构示意 图α-吸附层,b-扩散层
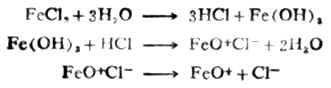
cl-则留在介质中。 在硫化砷溶胶中,其溶胶胶核吸附HS-而带负电荷。 As2O3+3H2S →As2S3+3H2O
H2S
 H++HS-
H++HS- H+留在介质中。 (2)表面分子离解 胶体粒子与分散介质接触后,表面上的分子与介质作用而离解,某种离子将扩散到介质中去,因此胶体粒子带有和扩散离子符号相反的电荷。例如,硅胶的胶粒是由很多SiO2分子组成的。粒子表面上的SiO2分子和水接触形成硅酸H2SiO3,随后离解生成了SiO32-和H+,H+扩散到介质中成为反离子,胶体粒子则因保留有SiO32-而带负电荷。 3.胶团结构 现以Fe(OH)3溶胶为例来说明胶团的结构(图9-8)。 氢氧化铁溶胶是由许多Fe(OH)3分子构成的,其中心部分叫胶核。胶核的外边是由FeO+和一部分CL-所形成的吸附层,胶核和吸附层统称为胶粒。另一部分CL-借扩散作用而分布于离胶核较远处,形成扩散层。带有相反电荷的吸附层和扩散层电荷符号相反,电量相等,所以胶团是电中性的。胶团的结构可用下式表示。
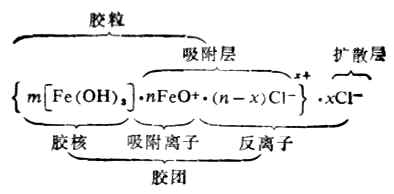
Fe(OH)3胶粒包括胶核(设为m个Fe(OH)3分子组成)和吸附层。胶粒和扩散层合称为胶团,胶团分散在介质中乃是胶体体系。 (二)溶胶的稳定性和聚沉 由于溶胶是高度分散的多相体系,胶粒有自动聚结的趋势,是一个聚结不稳定体系。但在某种条件下,它又具有聚结的稳定性,胶粒并不合并变大。决定聚结稳定性的主要因素是溶胶胶粒表面的双电层结构,它使胶粒在碰撞时不致相互接触,同时双电层有水化离子,好像胶粒外面包上一层水化膜或溶剂化膜,这层膜就起到阻碍胶粒合并的作用。 凡是使溶胶的分散度降低,分散相颗粒变大,最后从介质中沉淀析出的现象叫聚沉。促使溶胶聚沉的因素有电解质,反电荷的胶体,温度等。溶胶对电解质的影响非常敏感,这是由于电解质中反离子的加入促使胶粒周围的扩散层被“压缩”,扩散层厚度迅速变薄,当电解质的量达到一定程度后,扩散层消失,胶粒变成电中性,同时水化膜也随之消失,这样胶粒就能迅速凝集而聚沉。例如,在氢氧化铁中加入少量K2SO4溶液,溶胶内立即发生聚沉作用,析出氢氧化铁沉淀。 不同的电解质,对溶胶的聚沉能力是不同的,通常用聚沉值来衡量电解质对溶胶聚沉能力的大小。聚沉值是指一定溶胶,在一定时间内完全聚沉所需电解质的最低浓度(mmol·L-1)。聚沉值越小,表示聚沉能力越大。 可以使溶胶聚沉的电解质的有效部分是与胶粒带有相反电荷的离子,这些离子称为反离子。根据叔尔采-哈迪(Schulze-Hardy)规则,反离子的价数越高,聚沉能力也越大。一般说来,一价反离子的聚沉值在25-150之间,二价的约在0.5-2之间,三价的约在0.01-0.1之间。 对于给定的溶胶,反离子为1,2,3价的电解质,其聚沉值的比约为(1/1)6:(1/2)6:(1/3)6。 带有相反电荷的不同溶胶,可以相互聚沉。例如,将带有正电荷的氢氧化铁溶胶和带负电荷的As2S3溶胶混合,可以相互聚沉。 明矾的净水作用,是利用明矾的水解生成AL(OH)3正溶胶,而与带负电荷的胶体污物发生相互聚沉。 温度对溶胶的稳定性影响不大。温度升高时,由于溶胶的布朗运动增强,溶胶粒子之间的碰撞加剧,使溶胶的稳定性下降。 |  /3
/3 