金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
2024年6月2日,厦门大学附属第一医院核医学科陈皓鋆教授和肿瘤放疗科林勤教授团队在自然出版集团 (Nature Publishing Group, NPG) 旗下国际权威学术期刊《信号转导与靶向治疗》 (Signal Transduction and Targeted Therapy, Q1区,IF=39.3)正式发表了最新的研究工作“Antitumor efficacy and potential mechanism of FAP-targeted radioligand therapy combined with immune checkpoint blockade”。该项研究将靶向成纤维活化蛋白FAP 的放射配体治疗177Lu-LNC1004 与PD-L1免疫疗法联合使用,进而增强抗肿瘤功效,首次采用单细胞RNA测序(scRNA-seq)和T细胞受体β链(TCR-β)测序分析技术阐明潜在机制。厦门大学博士研究生赵亮、逄一臻、周扬帆、陈健豪为该论文的共同第一作者;厦门大学附属第一医院核医学科&闽南PET中心的陈皓鋆教授,新加坡国立大学的陈小元教授,厦门大学附属第一医院肿瘤放疗科的林勤教授为该论文的通讯作者。

原文链接:https://doi.org/10.1038/s41392-024-01853-w
Zhao, L., Pang, Y., Zhou, Y., Chen, J., Fu, H., Guo, W., Xu, W., Xue, X., Su, G., Sun, L., Wu, H., Zhang, J., Wang, Z., Lin, Q. *, Chen, X.*, & Chen, H. * (2024). Antitumor efficacy and potential mechanism of FAP-targeted radioligand therapy combined with immune checkpoint blockade. Signal transduction and targeted therapy, 9(1), 142.
研究背景
近年来,免疫治疗的迅速发展更新了现代肿瘤学。靶向程序性死亡蛋白1 (PD-1)及其配体(PD-L1)的治疗越来越被认为是癌症治疗的重要基石之一。然而,PD-1/ PD-L1免疫治疗的客观反应率差异很大,不同肿瘤类型的反应率从15%到40%不等。因此,探索增强免疫治疗效果的联合疗法已成为一个重要研究方向。
放射配体治疗提供了一种有前景的方案,作为放射治疗的一个分支,其将放射性核素与特异性靶向病变细胞或组织的分子结合在一起,可以实现对肿瘤的精准辐射。这种治疗通过静脉途径给药,尤其适用于广泛转移的恶性肿瘤患者。成纤维细胞激活蛋白(FAP)是恶性肿瘤中一个充满前景的靶点,它在多种类型肿瘤的肿瘤相关成纤维细胞(CAF)中广泛表达,而在正常组织中表达水平较低。因此,以FAP抑制剂(FAPI)为代表的靶向FAP的放射性药物进行肿瘤显像和肿瘤治疗是目前肿瘤核医学的研究热点。作为一种泛癌靶向分子,FAPI-04/46和OncoFAP等探针在肿瘤PET 显像方面显示出良好前景。然而,由于大多数靶向FAP的分子探针在肿瘤组织中的滞留时间较短,其治疗应用受到限制。本团队前期研究中使用了白蛋白结合剂的伊文思蓝(EB)修饰FAPI(LNC1004)优化探针的药代动力学,其标记治疗性放射性核素177Lu后良好的抗肿瘤功效已在临床前和临床研究中得到证实。
传统放射治疗联合免疫治疗已证明能提高抗肿瘤疗效,针对泛癌靶标的放射配体治疗与免疫疗法相结合可能是某些广泛转移晚期肿瘤有前景的治疗策略。此外,单细胞RNA测序(scRNA-seq)技术用前所未有的分辨率提供了细胞和分子相互作用的全景。然而,迄今为止还没有研究报道scRNA-seq在放射配体治疗单药治疗或联合免疫治疗中的应用。因此,我们在临床前研究中探索了177Lu-LNC1004与PD-L1免疫疗法联合的治疗效果。我们率先使用scRNA-seq来分析肿瘤微环境的变化,并阐明了这种联合治疗的潜在作用机制。此外,我们还在小样本患有不同类型癌症的晚期患者中评估了177Lu-LNC1004的安全性和有效性,并分析了治疗前后患者外周血单核细胞(PBMC)中免疫细胞类型的丰度变化。
研究结果
临床前研究中,68Ga/177Lu-LNC1004在FAP表达阳性的MC38/NIH3T3-FAP和CT26/NIH3T3-FAP荷瘤小鼠肿瘤模型的肿瘤组织中表现出强烈的放射性示踪剂摄取和持久的肿瘤滞留(图 1)。随后的体外和体内实验中,177Lu-LNC1004刺激均可上调肿瘤的PD-L1表达。在抗肿瘤治疗中,我们对MC38/NIH3T3-FAP和CT26/NIH3T3-FAP荷瘤小鼠(n=8/组)进行对照、单一疗法和联合疗法的比较。177Lu-LNC1004联合PD-L1免疫疗法的联合治疗方案使100%的MC38/NIH3T3-FAP荷瘤小鼠的肿瘤病灶完全根除,小鼠在治愈3月后再次接种肿瘤细胞时,表现出100%的肿瘤排斥(图 2)。CT26/NIH3T3-FAP荷瘤小鼠中也观察到类似的疗效趋势。使用免疫组织化学(IHC)染色、scRNA-seq和T细胞受体β链(TCR-β)测序分析MC38/NIH3T3-FAP荷瘤小鼠肿瘤微环境变化。结果表明:177Lu-LNC1004 -免疫联合疗法重塑了小鼠的肿瘤微环境,通过提高细胞间抗肿瘤通讯(图 3a-f)、抑制肿瘤的恶性进化(图 3g-i)、诱导细胞毒性T细胞激活和扩增、Treg减少和TCR多样性增加、增加M1巨噬细胞数量(4a-e)、激活成熟中性粒细胞亚群的抗肿瘤活性(图 4f-k),进而增强抗肿瘤疗效。随后,我们进行了初步临床试验(NCT05963386),以评估177Lu-LNC1004在晚期和难治性癌症患者中的安全性和有效性。初步临床研究表明,177Lu-LNC1004对难治性癌症患者具有良好的耐受性和有效性(图 5a)。在治疗前和治疗后对患者的PBMC进行scRNA-seq,结果表明177Lu-LNC1004治疗导致抗原加工和呈递增加,然而同时导致T细胞失活(图 5b-i)。这种抗原加工和呈递的增强与T细胞活性被抑制共存的混合情况,强调了进一步克服免疫逃逸的重要性,即此时联合免疫治疗可能解除免疫抑制,从而增强抗肿瘤效果。
研究结论
临床前联合治疗数据显示,177Lu-LNC1004可以增强PD-L1免疫检查点治疗的抗肿瘤疗效。此外,初步临床数据表明,基于177Lu-LNC1004的放射配体治疗是一种安全且耐受性良好的治疗方案,为癌症患者(特别是晚期全身广泛转移癌症患者)提供了新的治疗策略和手段。将来有待进一步探索177Lu-LNC1004与免疫治疗在晚期癌症患者中(特别是FAP阳性肿瘤患者)的协同作用。
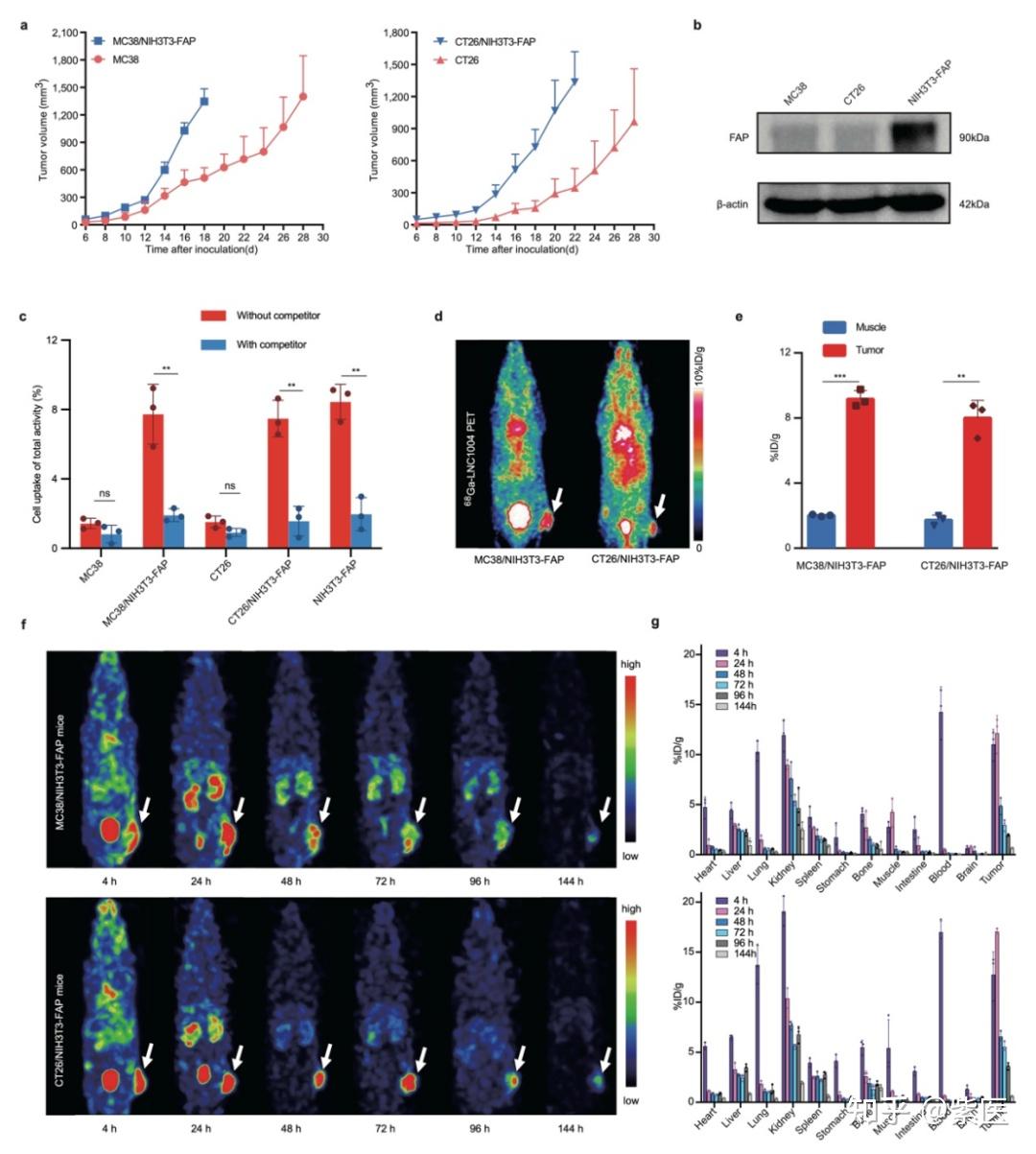
图1:68Ga/177Lu标记LNC1004后的体外和体内评价。(a)与同时混合肿瘤细胞和NIH3T3-FAP细胞后接种的小鼠相比,单独接种MC38或CT26细胞后小鼠体内肿瘤的生长曲线(n=5/组)。(b)使用Western blotting测定MC38、CT26和NIH3T3-FAP细胞中的FAP表达。(c)68Ga-LNC1004对MC38、CT26、NIH3T3-FAP、MC38/NIH3T3-FAP和CT26/NIH3T3-FAP等细胞的摄取测定。该测定辅以阻断实验以验证结合特异性(n=3/组)。(d-e)MC38/NIH3T3-FAP和CT26/NIH3T3-FAP荷瘤小鼠在注射68Ga-LNC1004 4小时后的代表性静态PET图像及PET定量数据(n=3/组)。(f-g)MC38/NIH3T3-FAP和CT26/NIH3T3-FAP肿瘤模型小鼠注射177Lu-LNC1004后4-144小时的SPECT全身最大强度投影(MIP)图像和生物分布数据(n=3/组)。
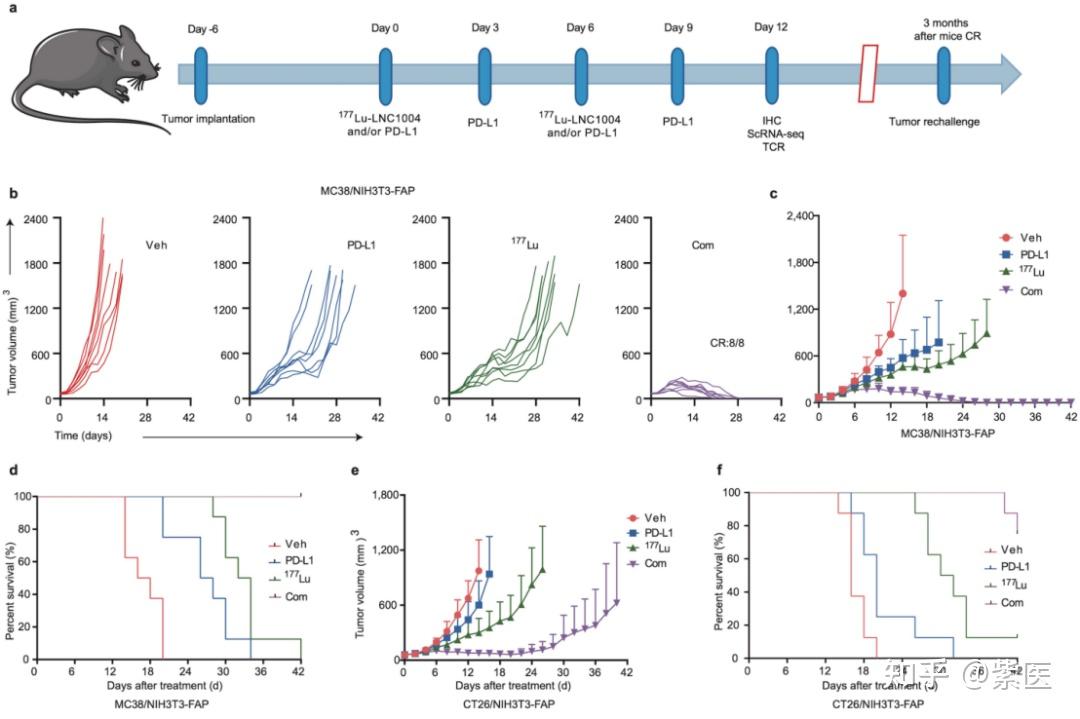
图2. 177Lu-LNC1004 放射配体治疗联合抗PD-L1免疫治疗增强抗肿瘤疗效。(a)MC38/NIH3T3-FAP和CT26/NIH3T3-FAP荷瘤小鼠模型的治疗方案和治疗时间表(n=8/组)。(b)来自Veh(载体组)、PD-L1(αPD-L1治疗组)、177Lu(177Lu-LNC1004治疗组)和Com(αPD-L1+177Lu-LNC1004联合治疗组)不同治疗组中MC38/NIH3T3-FAP荷瘤小鼠的个体肿瘤生长曲线。(c-d)MC38/NIH3T3-FAP荷瘤小鼠四个不同治疗组中的肿瘤生长曲线和存活率图。(e-f)CT26/NIH3T3-FAP荷瘤小鼠四个不同治疗组中的肿瘤生长曲线和存活率图。
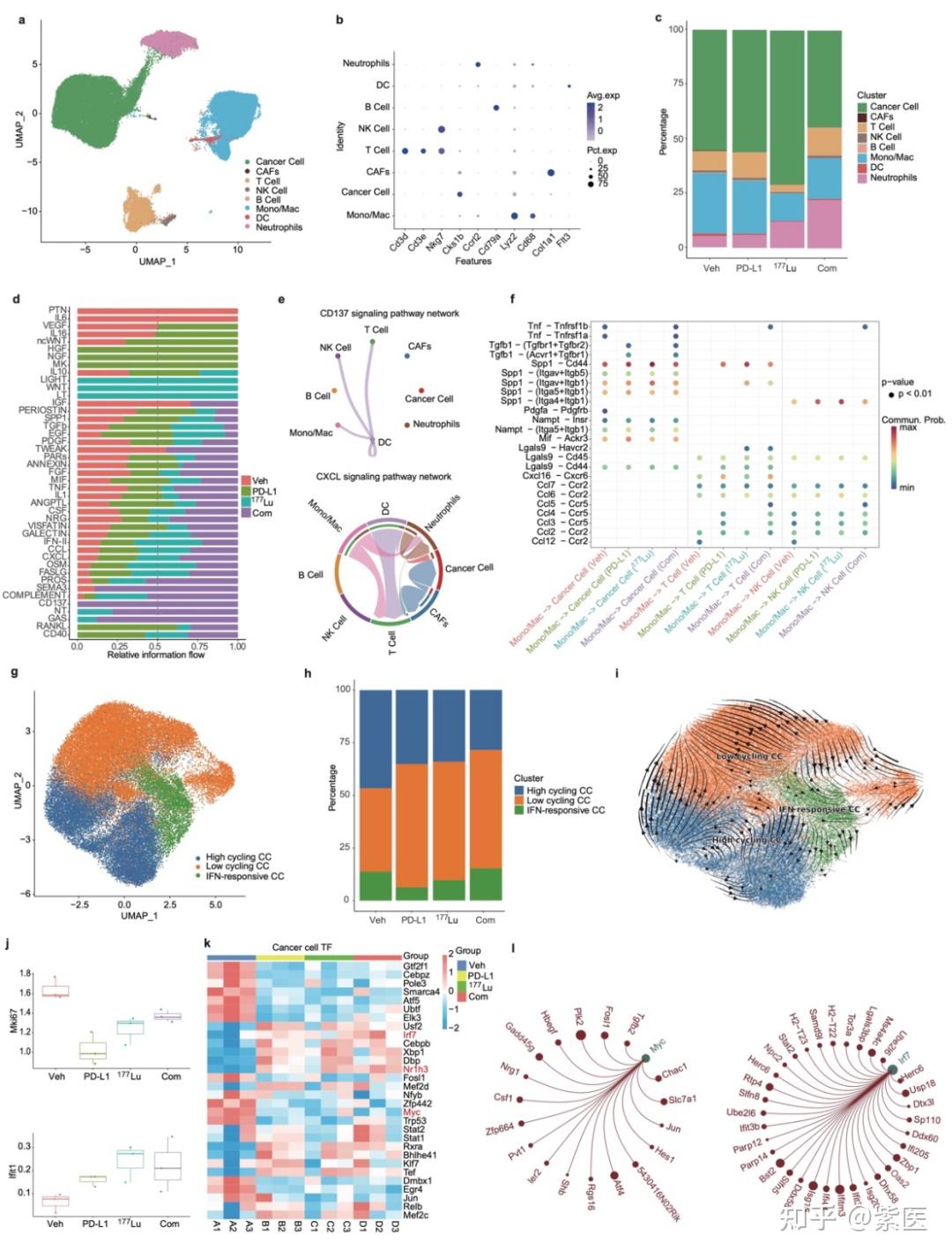
图3. MC38/NIH3T3-FAP 肿瘤模型中的细胞亚群识别和肿瘤细胞表征。(a)所有细胞的统一流形逼近与投影(UMAP)图。(b)点图揭示了不同细胞部分的特征标记基因。(c)条形图比较不同处理的主要细胞谱系。(d)条形图描绘了细胞通讯途径的不同占比。(e)相互作用网络强调联合治疗组中通过CD137(上)和CXCL(下)信号通路的特定细胞间相互作用。(f)突出显示了Mono/Mac与肿瘤细胞、T细胞和NK细胞的配体-受体相互作用。(g)肿瘤细胞的UMAP图。(h)条形图显示肿瘤细胞亚群的分布。(i)RNA轨迹分析反映了肿瘤细胞的进化进程。(j)箱线图代表癌细胞中Mki67和Ifit1的平均表达。(k)SCENIC分析描绘转录因子的AUC值差异,TF:转录因子。(l)以转录因子Myc和Irf7为中心的调控网络图。
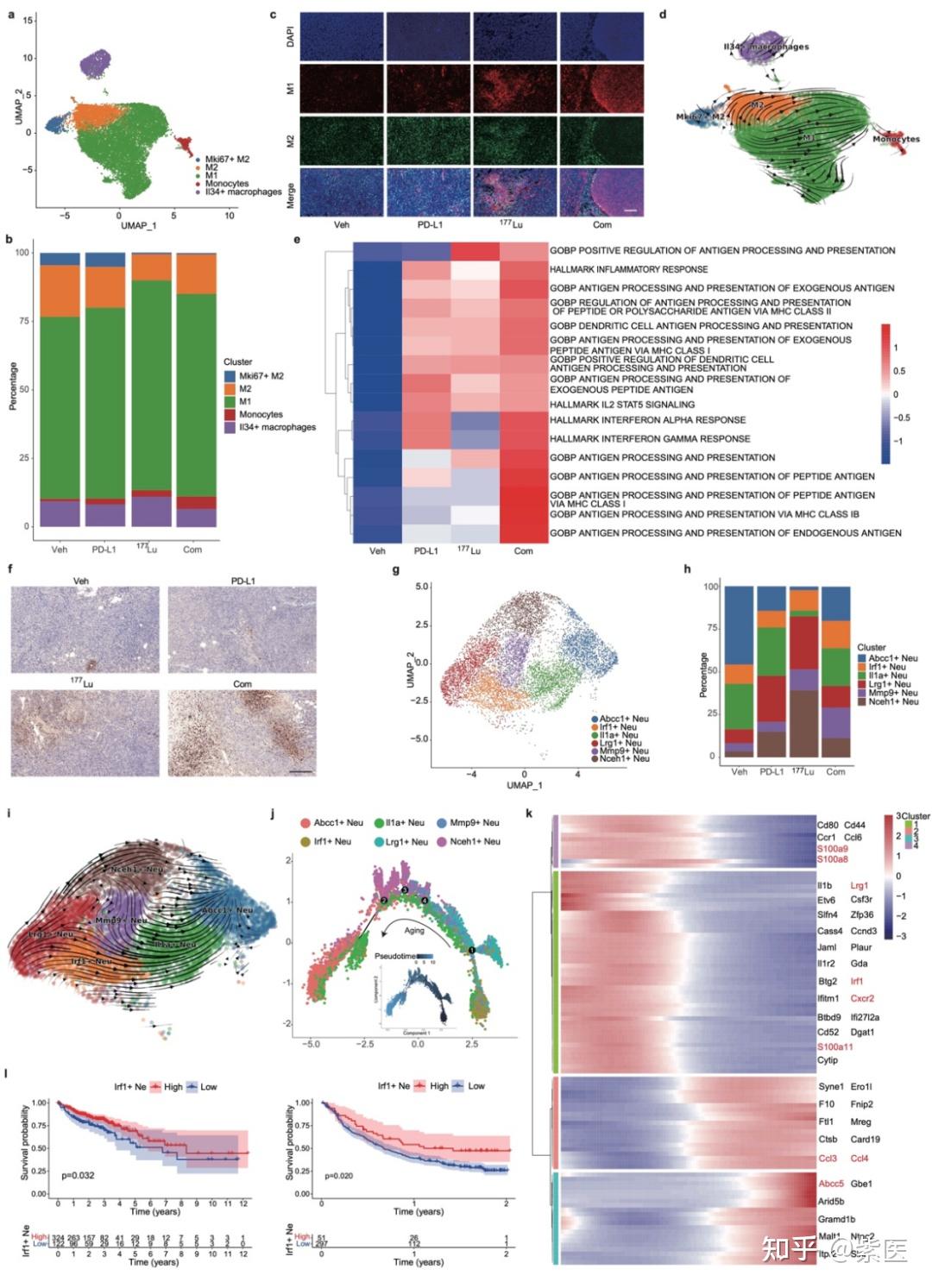
图4. 对四个治疗组的 Mono/Mac 和中性粒细胞特征进行比较分析。(a)Mono/Mac亚群的UMAP图。(b)不同治疗组中Mono/Mac亚群分布的条形图。(c)各组中肿瘤组织中M1和M2巨噬细胞的免疫荧光染色。(d)RNA轨迹分析反映了Mono/Mac亚群的进化进程。(e)热图展示了与Mono/Mac相关的富含基因组变异分析的通路的差异活性。(f)肿瘤样本中Ly6G的IHC染色。(g)中性粒细胞亚群的UMAP图。(h)条形图表明中性粒细胞亚群的分布。(i)RNA轨迹分析反映了中性粒细胞亚群的进化进程。(j)Monocle2拟时序分析揭示了中性粒细胞亚群内的进化趋势。(k)整个拟时序内中性粒细胞中差异表达最显著的基因热图。(l)使用对数秩检验对IRF1+中性粒细胞评分后的生存分析:结肠癌(TCGA数据,左)和膀胱癌(IMgivo210数据,右)患者的Kaplan-Meier生存分析图。
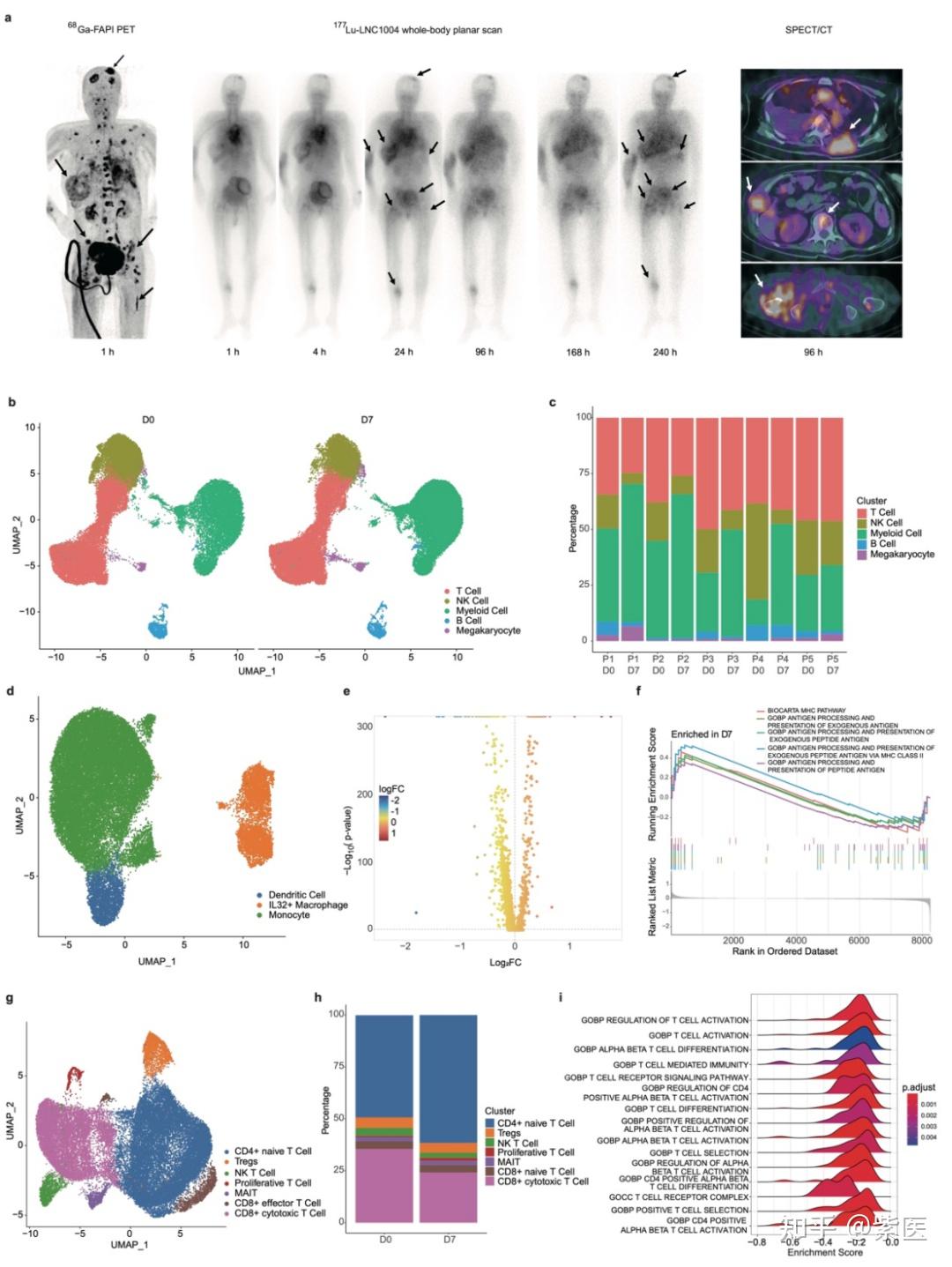
图5. 治疗前后外周血单核细胞(PBMC)的scRNA-seq。(a)接受177Lu-LNC1004治疗的患者(转移性乳腺癌)的代表性图像。(b)所有细胞的UMAP图。(c)条形图显示个体患者治疗前后主要细胞谱系的分布。(d)UMAP图显示治疗前后的骨髓细胞亚群。(e)治疗前后骨髓细胞内差异表达基因的火山图。(f)治疗前后差异表达基因的基因集富集分析。(g)UMAP图显示治疗前后的T细胞亚群。(h)条形图显示患者治疗前和治疗后T细胞亚型比例的变化。(i)治疗前后T细胞内差异表达基因的富集分析。 |
|
 /3
/3 