金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
对于一个初次做WB实验的人来说,复杂的流程和诸多的细节可能会很让你头疼,这是人之常情。不过作为一个在1979年已经被发明的方法,WB实验确实也是一个已经很成熟并且流程详细的实验,我们还是有据可循,有章可依的,需要的就是静下心来,理好流程,熟悉好细节,然后去实践。没有一定的经验是做不好这个实验的,当然你也可能一次成功,但是丰富的经验会让你对实验体验更深,尤其是在遇到问题时会更加游刃有余。话不多说,我们开始正题。
WB实验是利用抗体和抗原相结合的原理研究特定蛋白在组织中是否有表达或者在不同组织细胞中表达量相对差异的一个基础性实验,起到的是蛋白定性或者相对定量的一个作用。再具体一些,我们有一些组织或细胞,裂解后得到一堆蛋白的混合物,但是我们感兴趣的只是其中的一个或者几个蛋白,想要看这些蛋白是否有表达或者经过了你的实验处理后表达量是否有变化。这时候特异性的抗体就发挥功能,抗体和相应的蛋白结合,然后我们再用方法将这一现象显影,就得到了WB的结果。WB实验一般分为以下几个大步骤,样本制备-凝胶电泳-转膜-封闭-抗体孵育-条带显影成像-结果分析。
1. 样本制备
样本制备可以说是WB实验成功的一个大前提,是第一个关键因素。样本制备中的两个关键点是样本保存和裂解液的选择。保存包括有原始样本的保存和提取后的蛋白保存。原始样本的新鲜度是影响蛋白品质的一个方面,这个需要大家根据各个对象的特点去施行。一般来说,原始样本保存在-80摄氏度或者干冰中能维持更长的时间。如果是放在-20摄氏度中最好尽快使用。提取后的蛋白一般放在loading buffer里煮沸后分装冻存,这个最佳使用期是4周左右,解冻后需要重新煮沸上样,但是很多人也在较长的时间内使用,比如几个月甚至一年,如果出问题需要考虑这个因素。不同蛋白的丰度不同,降解的速度不同,样品储存时间过长之后,可能你的内参可以显影,但是目的蛋白不一定可以显影出来。
样品中的核酸、多糖、脂质等都会影响样品的质量并最终影响条带的可视性和美观度。强的RIPA裂解液是常规WB实验的首选,这个裂解液主要针对于动物的组织和细胞。当然蛋白裂解液的种类是比较多的,可以根据自己的样本进行选择,比如植物样本和真菌样本会有一些特定的裂解液。需要注意的操作点是全程保持低温,冰上操作。超声作为一种破碎样品中染色质的方法被广泛使用,可以得到较为理想的裂解效果。不同的蛋白裂解液对蛋白的溶解程度不同, 主要在于里面去垢剂的成分不同,不同的的去垢剂对蛋白的裂解程度和结构影响不同,针对动物组织及细胞的WB实验常用的去垢剂有SDS, 脱氧胆酸钠,NP-40, Triton X-100, 离子型去垢剂SDS和脱氧胆酸钠一般是强RIPA裂解液的必备组分,这两种去垢剂可以有效打破蛋白与蛋白的相互作用,然后将蛋白变性,强RIPA裂解液中通常也会包含NP-40或Triton X-100。市面上的RIPA还会有另外的中弱两种,其去垢剂和助剂的成分发生改变,对蛋白质的裂解程度会变得相应温和。 NP-40裂解液也是较为常用的裂解液,作用较为温和。对于一些特殊的实验,比如天然的蛋白印记实验,研究多聚体的蛋白印记实验或者Co-IP实验,裂解液是需要选择温和型的。 某些研究可能需要将细胞膜、细胞质和细胞核的蛋白进行各自分离,这时候我们就可以选择相应的商品化的试剂盒,这些试剂盒依据的原理一般是细胞膜和核膜在裂解难度上的差异及沉降差异。 在这里我就不赘述具体的操作步骤了,遵照不同产品的说明书或者参考文献中的步骤是更为合理的做法。
在选择裂解液之前需要对所研究的蛋白性质有所了解。包括基本性质,亚细胞定位,分子量,异构体等情况,我们可以在所购抗体的产品页面找到数据库连接,抗体的官网产品页面通常会附带这个蛋白的uniprot数据库链接。另外一个非常重要的参考数据是目标蛋白在您所用样本中的预测表达量,可以从文献中找寻相关数据,或者从数据库中查看,比如,biogaps, the human protein altas。如果没有一个合适的参考数据,可以想办法从供应商处购买阳性对照蛋白或者自己制备阳性表达的样本来确保自己的实验数据结果的客观性,即正确的阳性或者阴性结果。
用于WB实验的裂解液在使用前一般需加入蛋白酶抑制剂,如果是研究磷酸化的蛋白,还需加入磷酸酶抑制剂,这些抑制剂建议买商品化的cocktail按照比例加入,不建议单一成分比如PMSF, 抑制效果往往不佳。抑制剂的使用在很大程度上降低了蛋白提取及保存过程中的降解,对于信号的获取至关重要。
将蛋白样品上样之前,需要进行定量,定量的目的是为了计算上样量,保证不同泳道承载的蛋白总量基本一致,在这种情况下,内参分子的条带亮度应该是接近一致的。如表1所示,比较了不同蛋白定量方法的应用场景。定量后将蛋白和loading buffer混匀(如果使用含loading 的buffer提取,则忽略此步骤),loading buffer的最终浓度为1x, 然后在沸水中或者100度金属浴中保持5mins使得蛋白变性成直链,loading buffer中的DTT或者beta-巯基乙醇将氨基酸之间的二硫键打断,这样子能充分暴露抗原位点,加热过程中要避免管盖的崩开,这会有水分蒸发,进而影响蛋白的浓度。变性结束后短暂离心将样品置于冰上冷却,然后就可以开始上样进行蛋白凝胶电泳,混合物中的蛋白质按照分子量的大小在凝胶中被分离开来,以便我们锁定目标蛋白。蛋白电泳结束后,可以用考马斯亮蓝G250进行快染来确认蛋白的分离情况,考马斯亮蓝残留背景高,可逆条件高, 此步骤之后可能会影响转膜或者显色,所以一般不建议进行后续实验。一般情况下,我们也可以再完成转膜后用丽春红检验转膜的效率,在此处也可以看到条带分布。丽春红的染色很容易可逆去除,不影响后续实验。
表1. 不同蛋白定量方法的比较
| BCA法 | Bardford法 | Lowry法 | | 灵敏度(ug/ml) | 0.5-20 | 1-5 | 20-250 | | 线性范围(ug/ml) | 20-2000 | 50-1000 | 5-100 | | 最大吸收峰(nm) | 562 | 595 | 745-750 | | 优点 | 不易受去垢剂影响 | 方便,操作时间短 | 偏差小,应用广泛 | | 缺点 | 受螯合剂,高浓度还原剂影响。需确保EDTA低于10 mM,无EGTA,二硫苏糖醇低于1 mM,β-巯基乙醇低于0.01% | 易受去垢剂影响,标曲线型稍差,偏差大 | 专一性差,易受干扰,标曲线型稍差 | | 最佳检测时间 | 反应结束后10min之内检测 | 5-20min之内颜色稳定性最佳 | 反应完立即比色 |
一些普遍性的建议有一定的参考性,但是建议研究者具体问题具体对待,尤其是要提前去调研并掌握蛋白的一些特点。在此以一篇特殊的文献来阐述样本制备的细节如何影响实验结果[1]。文章名称见文末,这片文章研究了跨膜离子转运蛋白SLC11A2 (divalent metal transporter 1, DMT1),SLC40A1 (ferroportin 1, Fpn1) 和 transferrin receptor-1 (TfR1),还有胞质离子荷载蛋白 ferritin H。 使用12个人类细胞系裂解物的结果表明,只有在不加热样本的情况下,才能得到DMT1的条带,加热会使得DMT1沉降聚集,另外,不加热的样本可以获得更高分辨率的Fpn1 and TfR1 蛋白印记结果图。但是,加热才能得到 ferritin H的高分辨率结果图。其他的方法,比如更换抗体,更换样本,更换裂解液,超声都不能解决条带出现的问题。这篇文献尤其显示了蛋白特性与WB结果之间的重要联系。当然,问题的症结很多,我们需要在每一个特定的问题上进行特定的分析。
2. 蛋白凝胶电泳
对于如何去进行电泳操作,最好的方法是在实验室跟着前辈或者实验员操作或者根据产品的型号找寻相关的视频进行学习然后并练习。在这里我们主要讲述一些原理性和基础性的知识以便于您更加透彻的理解实验。
蛋白电泳一般使用的是聚丙烯酰胺凝胶。这种胶由两种化合物聚合而成,单体丙烯酰胺(简称Acr)和交联剂N,N’-甲叉双丙烯酰胺 (简称Bis)。聚合是通过添加催化剂过硫酸铵 (APS) 和促凝剂DMAP或TEMED来启动的。这种凝胶是中性、亲水、由亚甲基交联的长链碳氢化合而成的三维网状结构。凝胶中丙烯酰胺和N,N’-甲叉双丙烯酰胺的比例为29:1,即就是常说的30%的A:B液。丙烯酰胺溶液的百分比决定了凝胶孔径的大小,从而形成不同的分子筛作用,浓度越高,孔径越小。对于不同大小的蛋白有不同的分离效果。如表2所示。
表2. 凝胶浓度和蛋白最佳分离范围对应表,仅供参考
| 蛋白最佳分离范围 | 丙烯酰胺的百分比 | 蛋白分离范围 | | 10-20 kda | 15% | 8-40 kda | | 15-40 kda | 12% | 15-60 kda | | 30–90 kda | 10% | 20-100 kda | | 80–200 kDa | 8% | 50-250 kda | | 120–250 kDa | 6% | 70-300 kda |
蛋白电泳的缓冲体系介绍
实验室最常用的蛋白电泳缓冲体系是Tris-甘氨酸体系,近年来bis-tris体系逐渐在预制胶领域兴起,主要是其保质期要优于Tris-甘氨酸体系,并且条带更加锐利清晰。bis-tris体系适用有两种电泳缓冲液,MES 具有更低的 pKa,使得 MES SDS 电泳缓冲液的速度比 MOPS SDS 电泳缓冲液更快。不同缓冲液的离子迁移效应的差异会影响蛋白堆叠,进而导致蛋白分离范围的差异。使用 MOPS 缓冲液时,蛋白迁移速度较使用 MES 缓冲液时更慢。预制胶使用方便,有不同的浓度,还经常以梯度胶的形式呈现,但是使用成本高于配胶试剂盒。Tris-乙酸体系更适合极高分子量蛋白的分离,Tris-Tricine体系更适合极低分子量蛋白的分离。表3列出了不同体系的区别,信息来源于赛默飞官网。当然,不同的缓冲体系建议使用配套的上样缓冲液,在这里提个醒,就不进行过多赘述。
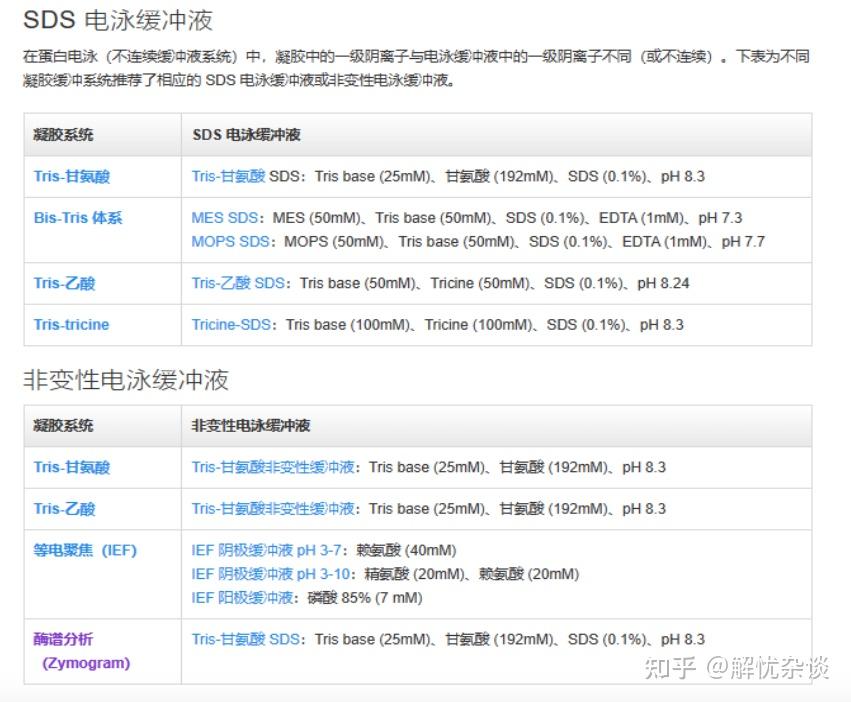
表3. 不同的蛋白缓冲体系展示,信息来源于赛默飞世尔科技官网
Native-PAGE 和 SDS-PAGE
非变性聚丙烯酰胺凝胶电泳(native-PAGE),能够使得蛋白质保持天然状态,根据蛋白质的分子量大小、形状及其所带的电荷量而逐渐呈现梯度分离。native-PAGE常用于酶的鉴定、同工酶分析和提纯。SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE),则仅根据蛋白质的分子量大小分离蛋白质。SDS是一种阴离子去垢剂,作为变性剂和助溶试剂,它能打断分子内和分子间的氢键,使得蛋白质分子去折叠,失去二、三级结构,而强还原剂如DTT和beta-巯基乙醇能使的半胱氨酸残基间的二硫键断裂。这两种物质是的蛋白质分子解聚成直线的多肽链,然后与SDS结合,统一带上负电荷,如此就消除了不同蛋白之间的电荷差异和结构差异,蛋白质的迁移率就仅仅取决于其分子质量的大小。SDS-PAGE是WB实验中常用的方法。
连续电泳和不连续电泳
连续电泳是指使用相同孔径的凝胶和缓冲体系的电泳,这种系统分子筛效应不明显,没有浓缩样品的效果,因而用于分离简单的样品,对于pH有恒定要求的样品也是较为适用的。不连续电泳是指在一次电泳中使用不同的凝胶浓度和不同缓冲体系的电泳,实验室常用的分离胶浓缩胶体系即是这种不连续电泳,商品化的梯度胶也是如此。具有较好的分辨率,因而最为常用。
浓缩胶和分离胶体系
以sds-Tris-甘氨酸体系为例,浓缩胶又称堆积胶,凝胶浓度相对较小,孔径较大,pH为6.8,浓缩胶中的HCL几乎全部解离为CL-,只有极少部分甘氨酸解离为H2NCH2COO-。蛋白质在此条件下其解离程度位于HCL和甘氨酸之间。电泳开始后,CL-泳动效率最高,为先导离子,然后是蛋白质,最后是H2NCH2COO-,为尾随离子。先导离子和尾随离子之间形成一个稳定的不断向正极移动的界面,然后蛋白质被浓缩成整齐的一条线。当到达分离胶时,凝胶的pH为8.8,尾随离子H2NCH2COO-大量解离,泳动加快,超过蛋白质,电压梯度消失,同时,凝胶孔径变小,蛋白质迁移速率变小,在均一的电压梯度和pH泳动,这时候会根据其分子大小进行分离。
经典配胶法和快速配胶法
蛋白凝胶的配制已经是一个非常成熟的技术,市面上有成品化的试剂盒。 常见的有经典配胶法(Tris-甘氨酸体系),相信大家都在实验室见过那些瓶瓶罐罐和配胶用量表,新兴起的快速配胶法的配方不得而知,但是在制胶流程、凝胶速度和电泳速度方面有很大的提升,快胶组分中没有SDS, 可用于非变性电泳。如表4所示进行了两种方法的比较,很多老师还是习惯用稳定的经典配胶法,认为经典胶的效果好于快胶,这个就看个人的习惯和使用效果了。
表4. 经典配胶法和快速配胶法比较
| 分离范围 | 组分 | 凝胶时间 | 特点 | | 经典配胶法 | 可调控浓度,分离范围可变 | 单组分形式,包括,30%A:B溶液,分离胶缓冲液,浓缩胶缓冲液,SDS, APS ,TEMED。 | 40-80mins | 制胶相对复杂,费时,价格便宜,稳定,可调控浓度。 | | 快速配胶法 | 固定浓度,分离范围参照所购产品说明书 | 预混液形式:分离胶A液和B液,浓缩胶A液和B液,APS | 10-15mins | 制胶方便,无须液封,凝胶快,电泳快。价格相对高,分离范围有限 |
蛋白marker
蛋白变性凝胶电泳中需要用到蛋白marker来指示蛋白分子量的大小。一般用到的是彩色预染蛋白marker,常用的指示范围是10-180kda。对于极高分子量蛋白,有高分子量范围的蛋白marker,对于极低分子量蛋白,有低分子量范围的蛋白marker。 一般的预染蛋白marker不能在最终的条带图上显影,可以用明场叠加的方式对齐,但是偶然情况下,抗体会和marker反应,导致预染蛋白marker显影在图像上,这是偶然现象,不能习以为常。有专门可用于WB显影的蛋白marker,其显影原理有三种,一是含有IgG结合位点,二是有荧光条带,可通过荧光观察,三是通过生物素化的蛋白条带和抗生物素二抗进行显影。值得注意的是,预染蛋白marker由于偶联有染料,所以指示的蛋白大小会有一定偏差,在不同的凝胶体系中会呈现出不同的条带指示效果,需要注意。
3. 转膜
顾名思义就是将胶上的蛋白转移到印记膜上,一般用的膜有两种,PVDF膜和NC膜。转膜分为湿转移,半干转和干转三种。最常用的是湿转移,费时,但是效果最为稳定,将胶和膜组装在转膜装置中然后在装满转膜缓冲液的电泳槽里进行电转。如果实验室只有其他转膜方式,那么就遵照相应的流程就可以。转膜后可以通过丽春红确认蛋白的转膜效率。转膜是WB实验中操作最为精细的一个步骤,需要我们将胶和膜在转印夹中做成一个三明治的结构,这个步骤建议跟他人学习并且实际练习操作过程。转膜完成后可以看到彩色预染蛋白marker的条带,可以预判转膜的好坏。
转膜用的海绵垫和滤纸等试剂耗材务必保证清洁,转膜的时候需要给膜上做好标记以区分样品和辨别样品的上样顺序;当然,商品化的彩胶和多色marker对于区分样品来说也是非常方便的,有条件的同学可以尝试。湿转移需要在冰浴中进行以避免温度过高,蛋白降解。
4. 封闭
封闭的目的是为了减少膜与后续使用的抗体试剂之间的非特异性结合,对于获得干净清晰的条带至关重要。封闭最佳的选择是使用和二抗同物种的血清,但是WB实验最常用的封闭试剂是脱脂奶粉和BSA, 这两种物质便宜、简单、易得,效果稳定,但是均建议使用实验级别的试剂,不要购买不合格的产品以免因小失大。封闭前将膜在1*TBST中清洗几秒,室温封闭1小时后,在1*TBST中清洗3次,每次5mins, 以免过度封闭,遮盖抗原。市面上也有一些无蛋白成分的快速封闭液,由于其成分未知,建议根据实际情况谨慎选择。 脱脂奶粉可能会对磷酸化蛋白的检测有影响,但是这是一个有争议的话题。对于生物素化的检测方式,不建议使用脱脂奶粉。TBST的缓冲能力比PBST的缓冲能力强,能获得更好的信噪比,一般建议使用TBST缓冲液,另外,PBST对于磷酸化蛋白的检测也有影响。
5. 抗体孵育
抗体是WB实验的关键试剂,一抗孵育建议4摄氏度过夜孵育,不建议室温1小时替代方案。4度过夜可以得到更为稳定清晰的条带,并且有益于抗体的后续保存、二次使用。使用1*TBST配制的5%脱脂奶粉或者5%BSA稀释抗体是不错的选择,其成分清晰,效果稳定。有的实验室可能会多次重复使用抗体,所以会选择商品化的稀释液,还是建议根据情况谨慎选择,因为成分未知,所以不清楚会对抗原抗体的结合造成何种影响,并且抗体一般不建议多次重复使用。二抗孵育建议使用1*TBST配制的5%脱脂奶粉,对于信噪比的提升有帮助。一抗二抗孵育完之后均需在1*TBST中摇晃洗涤3次,一次5mins。
6. 条带显影成像
一般我们使用的显影方式是化学发光显影法,利用二抗上偶联的HRP和鲁米诺试剂进行反应,然后在成像仪上显影拍照,暗室胶片曝光的方法已经逐渐淡出视线。荧光显影方式也越来越流行,使用荧光二抗进行WB条带显影需要注意的是封闭液中不要加入Tween-20, loading buffer尽量不选含有溴酚蓝的,这些物质都会对荧光显像有干扰。荧光显影之前膜要晾干,相反的,普通的HRP显影要保证膜的润湿状态。
7. 结果分析
除了直观的观察之外,通过软件获取条带的灰度值,然后进行比较,就可以获得蛋白在不同样本中的相对表达量。裁膜是常规的操作,可以获取不同蛋白的结果。但是对于一些严格的期刊,常常需要提供全膜的结果,我们可以用膜再生液获取多个结果,膜再生结果不佳也可以多做几次实验。需要根据实际效果提前规划好实验。
至此,我们再简单将常规WB实验的步骤捋一遍,取样-蛋白制备-蛋白定量-蛋白变性-蛋白电泳-转膜-膜封闭-抗体孵育-条带显影-结果获取与整理。虽然步骤不多,但是需要注意的细节是非常多的,本文介绍的细节也是有限,希望能激发大家的探索欲,对于未提及细节进行更多的探索。另外,不同厂家的抗体和试剂,使用的细节略有不同,在学会流程后需要仔细阅读产品说明书并根据实验室的实际情况进行适当地调整,养成良好的实验习惯是非常重要的,预祝大家实验顺利!
参考文献:
[1] Tsuji Y (2020) , Transmembrane protein western blotting: Impact of sample preparation on detection of SLC11A2 (DMT1) and SLC40A1 (ferroportin). PLoS ONE 15(7): e0235563.
声明:原创作品,仅供参考!
原文地址:https://zhuanlan.zhihu.com/p/666515070 |
|
 /3
/3 