金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×

检验项目
1菌落总数
2大肠菌群
菌落总数
检验标准:
GB 4789.2-2022食品安全国家标准食品微生物学检验菌落总数测定
菌落总数:
食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g检样中形成的微生物菌落总数。
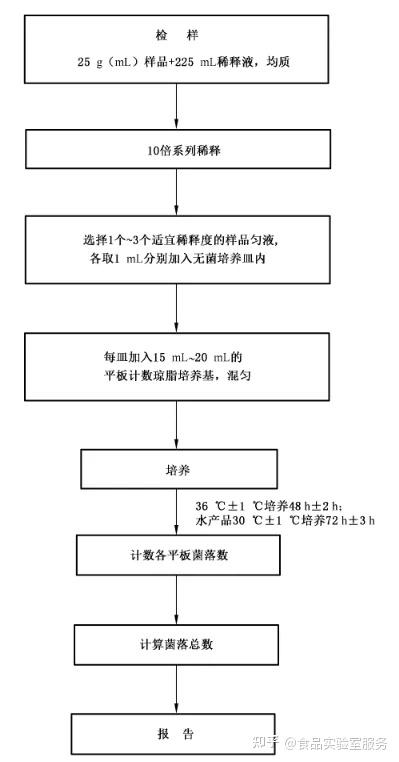
01 样品稀释
制备1:10样品匀液
称取25g样品置盛有225mL磷酸盐缓冲液或生理盐水水的无菌均质杯内8000 rimin- 10000r/min均质1 min-2 min.或放入盛有225 mL稀释液的无菌均质袋中。用拍击式均质器拍打1min~2 min。制成1:10的样品匀液。
制备1:100样品匀液
用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL沿管壁慢慢注入盛有9mL稀释液的无菌试管中(注意吸管或吸头不要触及稀释液面) ,振摇试管或换用支无菌吸管反复吹打使其混合均匀。制成1:100的样品匀液。
制备10倍品匀液
按上一步操作程序。制务10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或吸头。
取样并制备平板
选择1个~3个适宜稀释度的样品匀液(液体样品可包括原液) ,在进行10倍递增稀释时,吸取1mL样品匀液于无菌平皿内,每个释释度做两个平皿。同时,分别吸取1mL空白稀释液加入两个无菌平皿内空白对照。
及时将15mL`20mL冷却至48℃的平板计数琼脂培养基(可放置于48℃士2℃恒温水浴锅中保温)倾注平皿,并转动平皿使其混合均匀。
02 培养
2.1 待琼脂凝固后,将平板翻转,36℃士1℃培养48 h+2h。
2.2 如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖薄层琼脂培养基(约4mL),凝固后翻转平板,按2.1条件进行培养。
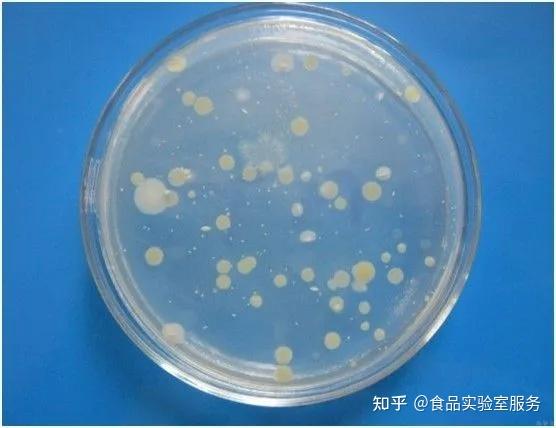
03 菌落计数
3.1 应对平皿上所有肉眼可见的菌落进行计数
3.2 平板上菌落计数可使用自动化菌落计数仪,也可用肉眼观察(必要时可用放大镜观察)记录培养基上菌落数量和相应的稀释倍数。
3.3 选取菌落数在30-300CFU之间、无蔓延菌落生长的平板计数菌落总数。
3.4 如果在一个稀释度的两个平板中,一个平板的菌落数在30-300之间,另一个大于300或小于30时,则以30-30之间平板菌落数作为本稀释度结果记录。
3.5 如所有平板的菌落数均在30CFU以下,则记录平板中具体的菌落数;如果没有菌落生长,则记录为小于1CFU。
3.6 如平板上菌落数大于300CFU,则记录为多不可计;但如果所有稀释度的平板上落数均大于300CFU,则对稀释度最高的平板进行计数、其他稀释度平板记录为多不可计。
3.7 同一稀释度的两个平行平板中,一个平板有较大片状落生长时、应不进行计数,而应以无片状菌落生长的平板作为该稀释度的菌落数。
3.8 如果同一稀释度的两个平行平板均有片状菌落生长,选取片状菌落不到平板一半,而剩余一半落分布均匀的平板,计数一半平板落数并乘以2代表全皿菌落数。
3.9 当平板上出现菌落同无明显界线的状生长时,则将每条单链作为一个菌落计数。
04 结果计数
4.1 若只有一个稀释度平板上的菌落数在30-300CFU之间,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果。
4.2 若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
4.3 若所有稀释度的平板菌落数均大于300CFU,则应按稀释度最高的平均菌落数乘以稀释倍数计算。
4.4 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
4.5 若所有稀释度的平板菌落数均不在30-30CFU之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
4.6 若有两个连续稀释度的平板菌落数在适宜计数范围内时,除30-300FU范围之外的平板,按如下公式计算:

05 结果报告
5.1 菌落计数以落形成单位(colony-forming units,CFU)表示,称重取样以CFU/g为单位报告,体积取样以 CFU/ml为单位报告,表面取样以 CFU/cm2为单位报告。
5.2 菌落数小于100CFU时,按”四舍五入”原则修约,以整数报告。
5.3 菌落数大于或等于100CFU时,将第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数,也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
5.4 若空白对照上有菌落生长,则此次检测结果无效。
注:菌落总数结果计算与报告方式实例见表2.1
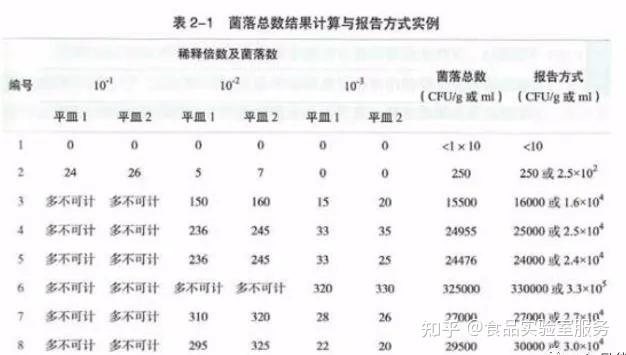
大肠菌群
GB 4789.3-2016 食品安全国家标准 食品微生物学检验 大肠菌群计数 MPN法
·大肠菌群:在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽孢杆菌。包括肠杆菌科的埃希氏菌属、柠檬酸杆菌属、肠杆菌属和克雷伯氏菌属。
·大肠菌群与肠道致病菌的来源相同,在外界中的生存力接近,在检验方法上,也以大肠菌群的检验计数简便易行,因此可作为水、土壤、乳品、食品饮料等被粪便污染的间接指标。
·大肠埃希氏菌
·大肠杆菌(Escherichia coli, E.coli) 革兰氏阴性短杆菌,大小0.5x1~3微米。周生鞭毛,能运动,无芽跑。能发酵多种糖类产酸、产气,是人和动物肠道中的正常栖居菌,婴儿出生后即随哺乳进入肠道,与人终身相伴,几乎占粪便干重的1/3.
01 样品稀释
固体和半固体样品:
·称取25g样品,放入盛有225mL 磷酸盐缓冲液或生理盐水的无菌均质杯 内 ,8000r/min~10000r/min均质1min~2min,或放入盛有225mL磷酸盐缓冲液或生理盐水的无 菌均质袋中,用拍击式均质器拍打1min~2min,制成1∶10的样品匀液。
液体样品:
·以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶 (瓶内预置适当数量的无菌玻璃珠)或其他无菌容器中充分振摇或置于机械振荡器中振摇,充分混匀,制成1∶10的样品匀液。
·用1mL 无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓缓注入9mL磷酸盐缓冲 液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。
·根据对样品污染状况的估计,按上述操作,依次制成十倍递增系列稀释样品匀液。每递增稀释 1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15min。
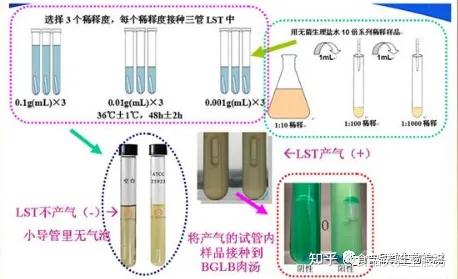
02 初发酵
每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管 月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种量超过1mL,则用双料 LST肉汤),36 ℃± 1 ℃ 培养24h±2h,观察倒管内是否有气泡产生,24h±2h产气者进行复发酵试验(证实试验),如未 产气则继续培养至48h±2h,产气者进行复发酵试验。未产气者为大肠菌群阴性。
03 复发酵试验
用接种环从产气的 LST 肉汤管中分别取培养物1 环,移种于煌绿乳糖胆盐肉汤(BGLB)管中, 36 ℃±1 ℃培养48h±2h,观察产气情况。产气者,计为大肠菌群阳性管。
04 结果报告
按3确证的大肠菌群 BGLB阳性管数,检索 MPN 表(见附录 B),报告每g(mL)样品中大肠菌群的MPN值。
GB/T 4789.3-2003 食品卫生微生物学检验 大肠菌群测定
01 样品稀释
·制备1:10样品匀液
以无菌操作将检样25g(mL)放于含有225mI.灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做成1 : 10的均匀稀释液。固体检样最好用均质器,以8 000 r/min~10 000 r/min的速度处理1 min,做成1 : 10的均匀稀释液。
·制备1:100样品匀液
用1mL无菌吸管吸取1:10样品匀液1mL,注入盛有9mL灭菌生理盐水或其他稀释液的试管中,振摇试管混合均匀,制成1:100的样品匀液。
·制备10倍品匀液
领取1mL灭菌吸管,按上条操作依次做10倍递增稀释液,每递增稀释一次,换用1支1mL灭菌吸管。
·移取样品
根据食品卫生标准要求或对样品污染情况的估计,选择三个稀释度,每个稀释度接种三。
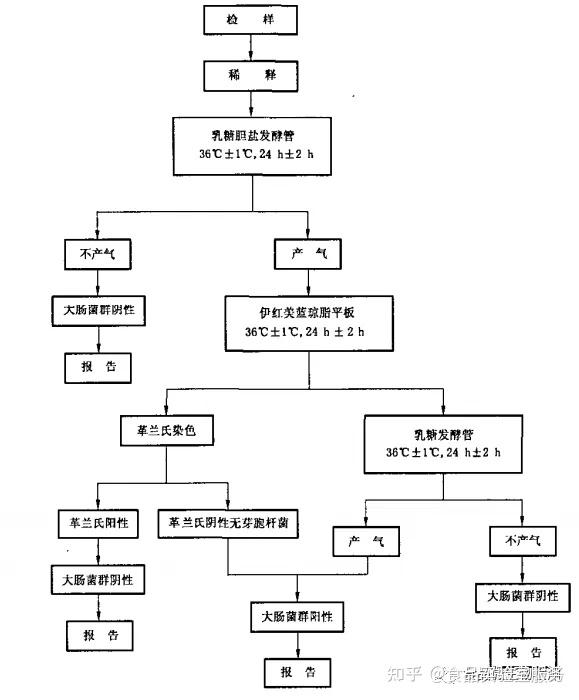
02 乳糖发酵试验
将待检样品接种于乳糖胆盐发酵管内,接种量在1mL以上者,用双料乳糖胆盐发酵管,lmL及以下者,用单料乳糖胆盐发酵管。每一稀释度接种三管,置36 ℃± 1 ℃培养24 h±2 h,如所有乳糖胆盐发酵管都不产气则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。
03 分离培养
将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36 ℃± 1 ℃温箱内,培养18h~ 24h,然后取出,观察菌落形态,并做革兰氏染色和证实试验。
伊红美蓝琼脂:伊红Y和美蓝抑制绝大部分革兰氏阳性菌的生长.伊红Y为酸性染料,美蓝为碱性染料,琼脂是凝固剂。大肠菌群发酵乳糖产酸时,细菌带正电荷,所以染上伊红(红色),再与美蓝结合形成紫黑色菌落,大部分有金属光泽。
03 证实试验
在上述平板上,挑取可疑大肠菌群菌落1- 2个进行革兰氏染色,同时接种乳糖发酵管,置36 ℃± 1 ℃培养24 h±2h,观察产气情况,凡乳糖管产气、革兰氏染色为阴性的无芽孢杆菌,即可报告为大肠菌群阳性。
04 报告
根据证实为大肠菌群阳性的管数,查MPN检索表,报告每100mL (g)大肠菌群的MPN值。
好了,今天的分享就到这里。同时欢迎小伙伴们踊跃投稿,分享自己在检测过程中的经验。
原文地址:https://zhuanlan.zhihu.com/p/709532110 |
|
 /3
/3 