金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
与大多数科学技术一样,在准备流式细胞术样品时,“垃圾样品,垃圾数据-(garbage in, garbage out)”这句格言很贴切。从高质量样本开始是获得可靠、高质量数据的第一步。以下是一些关于应对样品制备过程中常见挑战的专家建议,以及提高流式细胞术数据质量的其他技巧。
提前计划样品制备
尽管直接投入新的方案可能会令人兴奋,但也不要试图省去仔细的准备工作,即使这意味着需要更多的步骤或一些额外的时间。规划所有准备步骤并留出足够的时间—更好的数据带来的好处将远远超过麻烦。流式细胞术应用科学家Sharon Sanderson 表示:“一切准备就绪,开始准备样品后,就可以避免处理过程中的任何延迟,并避免样品在工作台上放置的时间超过必要的时间”。“收获和染色之间的时间过长可能会导致脆弱细胞(如粒细胞)的活力较差或丢失。” 如果可能的话(根据实验的性质适当)将样品保持在 4℃ 冷却,以减少坏死和细胞凋亡。
优化固定和透化
优化固定和透化可能具有挑战性,特别是当您同时研究细胞内和细胞外蛋白质时,因为这些类型的分子使用不同的方案。例如,细胞外蛋白质可进行表面染色,但可能会受到用于接触细胞内蛋白质的透化试剂的不利影响。
Proteintech 产品经理建议“细胞内靶标需要更复杂的方案来固定和透化细胞,以允许试剂进入细胞,” “如果要对核蛋白进行染色,则需要更严格的透化方法,不仅要穿透细胞膜,还要穿透核膜。” 她建议如果可能的话,尽量简化固定,因为虽然它“有助于样品保存,但它也会增加细胞的自发荧光。”
优化条件包括平衡健康的细胞外染色与充分获取细胞内蛋白质。您可以根据文献资料来自行优化,或利用可用的高质量商业固定和透化缓冲液。她指出,一些抗体制造商用特定的商业缓冲液验证他们的产品。“这使得样品制备和方案设计变得更加容易,因为您有一种经过验证的方法可以使用,例如 Proteintech 的 FoxP3/转录因子染色缓冲液试剂盒,”她说。
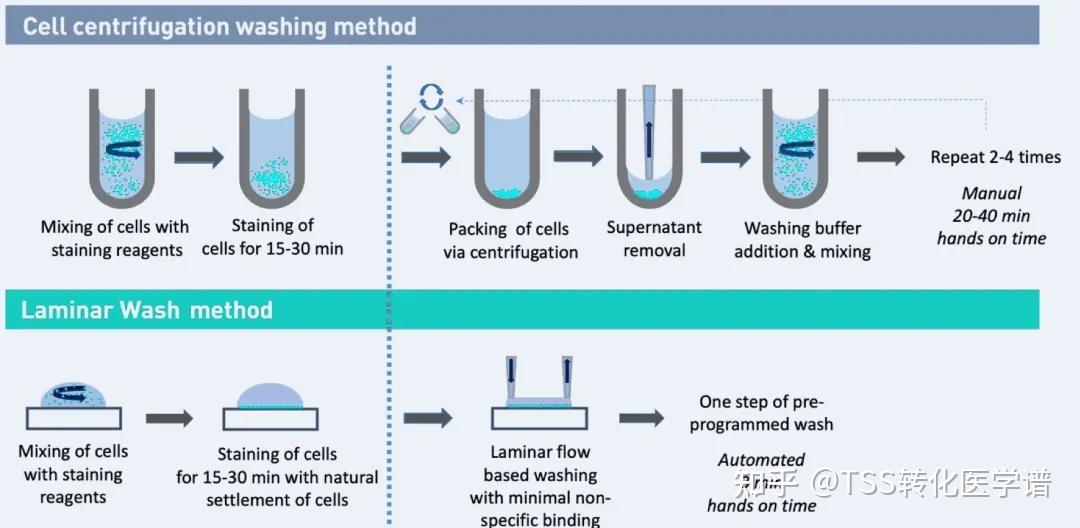
制作和保存单细胞悬浮液
制作和维持单细胞悬浮液对于流式细胞仪有效计数细胞和标记物至关重要。尽管某些样品很容易实现这一点,但其他样品(例如固体组织)可能更难以转化为单细胞,因此您可能需要尝试多种方法来找到最适合您的样品类型的方法。研究文献中的方法是一个很好的起点,可能包括切碎组织、过滤网筛选、酶消化的组合。“您希望通过以对细胞损伤尽可能小的方式收获细胞或解离组织来保持细胞的完整性,” Sanderson说。“如果您对稀有细胞类型感兴趣,您可能希望选择更温和的方法,例如分散酶等中性蛋白酶,这是一种比胰蛋白酶更温和的治疗方法。”
获得单细胞悬浮液后,Sanderson建议在显微镜下进行目视检查,寻找单个细胞而不是细胞团,并验证是否有足够的细胞用于计划的实验(使用细胞活力染料并使用血细胞计数器或自动细胞计数器进行计数在这里很有帮助)。 “这可以帮助您避免浪费昂贵的染色试剂并从不良样品中获取数据,”她说。
您的单细胞悬浮液可能需要进一步的刺激才能保持无团块。“添加 DNAse I 或 EDTA 可以减少死亡和垂死细胞释放的 DNA 团块的形成,”Sanderson 说。“在采集样品之前,您可以通过将制备物通过70 µm 细胞过滤器,进一步帮助去除可能堵塞细胞仪或损害结果的团块。”
去除污染细胞
当从混合细胞类型的组织中制备样品时,去除不需要的细胞尤其重要。“这方面的例子是,在收集骨髓和红细胞时,确保去除骨骼中的所有肌肉,肌肉细胞会使得流式细胞术检测白细胞变得困难,”桑德森说。通常使用密度梯度或低渗裂解去除红细胞 (RBC),低渗裂解通过渗透压使红细胞破裂。“可以使用水、氯化铵或专门的红细胞裂解液,例如 Erythrolyse,”Sanderson 说。“必须小心确保红细胞充分裂解,而不是将细胞留在裂解溶液中太长时间,因为这会导致白细胞的细胞死亡增加。”
临床采样挑战
使用新鲜血液进行转化分析的临床研究可能会在样本运输和储存过程中遇到挑战。运输生物样本的效果部分取决于样本类型和计划的检测方案。Precision for Medicine 是一家全球临床研究组织,提供全面的临床试验服务以推进药物开发,并拥有一支全球物流团队,为安全样本运输提供建议。Precision for Medicine 转化生物学高级总监 Angelina Bisconte 表示:“当临床场所需要进行样本处理工作,或者样本预计运输时间为 24 小时或更长时间时,往往会出现挑战。”
Precision 建议对需要在 8 小时内进行检测的样本使用血液固定剂或稳定剂。直接吸取管中包含的固定剂可提供长达 96 小时的稳定性。“使用可用的血液稳定剂,血液样本可以在冰箱中保存数月并进行批量处理,” Bisconte说。“我们使用商业稳定剂进行批量受体占用测定取得了相当大的成功,这是一些最具挑战性的流式测定。” 与任何试剂一样,测试血液固定剂或稳定剂在流式细胞术测定中是否发挥良好作用非常重要。“我们认为了解样品运输对我们的检测读数有何影响以及如何最大限度地减少任何问题非常重要,” Bisconte说。“投入时间与 Precision 合作,以便我们能够科学地实现每项临床研究的目标,我们可以提供最全面的建议,以帮助最大限度地提高用于样本检测的样本质量。”
这种额外的准备时间绝不会被浪费。“不要低估样品制备的重要性,因为如果您的样品不理想,您的结果也将不理想,” Sanderson说。
提高流式细胞术的样品制备
文章来源:Biocompare |
|
 /3
/3 