金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
基因编辑(gene editing),又称基因组编辑(genome editing)或基因组工程(genome engineering),是一种新兴的比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术,这种技术允许人类对目标基因进行定点"编辑"。
想象你的DNA图谱是一幅画,这幅画包含你的相貌、健康、性格、寿命等信息,有了基因编辑技术,你就可以将不满意的地方删掉重新描绘一下。
例如,CCR5基因是艾滋病病毒HIV进入宿主的关键受体,有研究人员觉得这个基因是万恶之源,于是乎利用基因编辑技术将人类胚胎的CCR5基因删除掉,“基因编辑婴儿”就诞生了。CCR5基因缺陷的婴儿是谁?现在几岁了?健康吗?真的可以完全抵抗HIV的入侵吗?……
咳咳,八卦之前请不要忘记你的身份,一名专业的科研狗子,即使吹牛都要做好调研-列好知识点-背熟稿子-关键时候一气呵成,快跟我往下看~
近年来出现了一系列基因组编辑技术,包括锌指核酸酶( Zinc-finger nucleases, ZFNs)、转录激活剂样效应核酸酶(Transcription activator–like effector nucleases, TALENs)和RNA引导的CRISPR/Cas9核酸酶系统等。
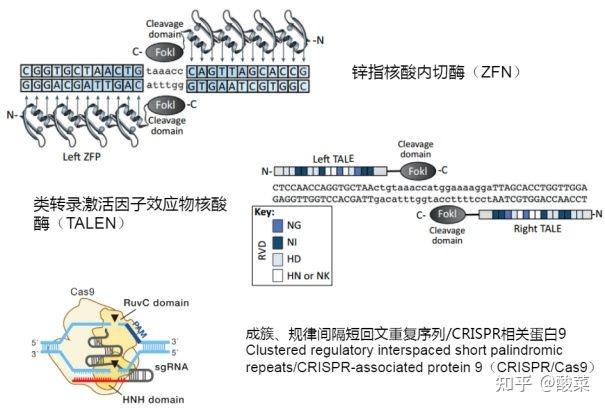
图2 三类基因组编辑工具(图片来源:原创力文档)
基因编辑依赖于经过基因工程改造的核酸酶,也称"分子剪刀",在基因组中特定位置产生位点特异性双链断裂(Double Strand Break, DSB),诱导生物体通过非同源末端连接(Non-homologous End Joining, NHEJ)或同源重组(homologous recombination, HR)来修复DSB,但修复过程容易出错,从而导致靶向突变。
接下来让我们一起揭露这些不同基因编辑技术的真面目吧!
(一)锌指核酸酶( Zinc-finger nucleases, ZFNs)
(1)基本结构
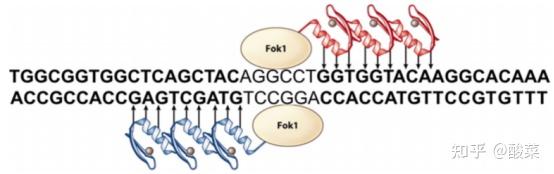
图3 锌指核酸酶与DNA结合的示意图(图片来源:参考资料[1])
作为老大哥的第一代基因编辑技术ZFNs,在1990年首次被报道,它主要包含负责特异性识别序列的锌指DNA结合结构域和进行非特异性限制性内切酶FokI切割的DNA切割结构域。
其中锌指DNA结合结构域由三个独立的锌指重复结构(如图2中的蓝色和红色所示)组成。一个典型的锌指(Cys2His2)由30个氨基酸组成,形成两个反平行的β-片,与α-螺旋相对。
锌指基序利用α-螺旋中的残基与DNA序列中的3个碱基对结合,因而一个锌指DNA结合结构域可以识别9 bp长度的DNA序列,那么多个ZFs可以结合形成一个更大的DNA识别域,从而提高基因修饰的特异性和效率。
DNA切割结构域中的单独的限制性内切酶FokI并不具备识别能力,需要与串联的锌指结合结构域融合,并与另一个FokI切割域碰头后形成二聚体,才能发挥切割功能,导致DNA的双链断裂。
(2)作用机制
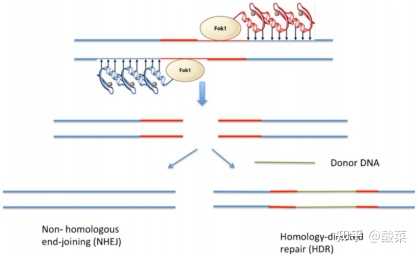
图4 ZFN切割DNA后启动修复断裂双链的示意图(图片来源:参考资料[1])
DNA双链被切割后,如何被修复呢?这就是基因编辑的关键所在!
如图4所示,DNA双链被切割后,双链断裂修复被启动,可以通过非同源末端连接(NHEJ)进行修复。NHEJ容易出错,通常会在断裂处产生一些碱基对(10-20bp)的插入或删除(indels),这种突变可能导致基因的框架移位或破坏,进而导致基因敲除。
相反,如果细胞在含有编码整个新基因或内源性基因小突变的供体DNA的情况下使用ZFNs处理,细胞可以使用供体DNA作为模板来修复受损的DNA,从而修复具有致病性的突变基因,这个过程称为同源定向修复(homology-directedrepair, HDR)。
(二)转录激活剂样效应核酸酶(Transcription activator–like effector nucleases, TALENs)
尽管ZFN已被用于各种生物的目标基因组编辑,但有两大限制阻碍了其更广泛的应用。近年来,第二代基因编辑技术转录激活子样效应核酸酶(TALENs)迅速成为ZFNs的替代基因组编辑工具。
(1)基本结构
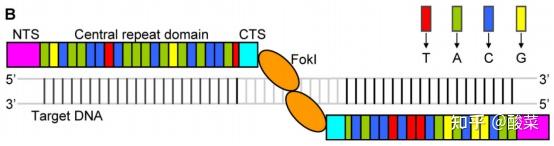
图5 TALEN结构示意图(图片来源:参考资料[2])
与ZFNs类似,TALENs也包含DNA结合结构域,以及使用非特异性的FokI结构域作为DNA切割模块,并发挥二聚体的功能。
如图5所示,TALENs由N端段(NTS,粉色框)、中心重复结构域、C端段(CTS,青色框)和FokI催化结构域(橙色椭圆)组成。N端一般有转运信号,C端有核定位信号和转录激活结构域。中央重复域即DNA结合域,由一系列串联重复序列组成的。
在每个重复单位中,+12和+13位的氨基酸残基是是实现靶向识别特异DNA碱基的关键位点,随靶点核苷酸序列的不同而异,被称作重复可变双残基(Repeat variable di-residue, RVD)。
不同的RVD能够相对特异地分别识别T、A、C和G碱基中的一种或多种(例如,NG识别胸腺嘧啶(红框),NI识别腺嘌呤(绿框),HD识别胞嘧啶(蓝框),NN识别鸟嘌呤(黄框)和腺嘌呤)。
两个TALENs在目标位点尾尾方向形成异源二聚体,形成一个位点特异性的DNA DSB。
(2)作用机制
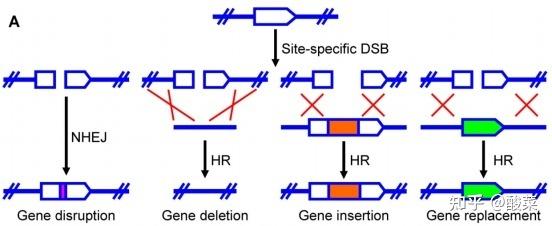
图6 TALEN介导的基因组编辑的示意图(图片来源:参考资料[2])
与ZFNs引起的DSB的修复机制一致,如图6所示,位点特异性的染色体DSB被NHEJ或HR修复,导致基因断裂、基因缺失、基因插入或基因置换。
但与ZFNs的DNA结合不同,TALENs由于其蛋白质DNA编码简单和模块化的特性,可以轻松快速地构建,以针对几乎任何DNA序列。此外,TALENs的脱靶效应和细胞毒性显著降低,使其成为一种高效的基因组编辑工具。
(三)CRISPR相关蛋白Cas9核酸酶(CRISPR associated proteins 9, CRISPR/Cas9)
随着2020年诺贝尔化学奖的揭晓,第三代基因编辑技术CRISPR/Cas9更广为人知。有专家称CRISPR/Cas9就像福特T型车,虽然在T型车出现之前就有汽车了,但他们价格昂贵而且经常出故障,而一旦T型车问世,每个人都可以拥有一辆车,所以CRISPR/Cas9更快、更便宜、更容易以及更好!
(1)基本结构
CRISPR/Cas9系统由三部分组成:核酸内切酶(Cas9)、CRISPR RNA (crRNA)和反式激活crRNA (trans-activating crRNA, tracrRNA),是目前应用最广泛的基因编辑方法。
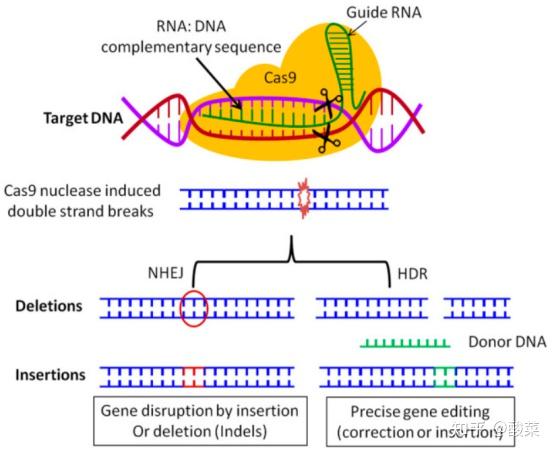
图7 CRISPR/Cas9介导的基因组编辑的示意图(图片来源:参考资料[3])
crRNA通过碱基配对与tracrRNA结合形成tracrRNA/crRNA复合物,此复合物引导核酸酶Cas9 在与crRNA 配对的序列靶位点剪切双链 DNA。
其中原间距相邻基序(protospacer-adjacent motif, PAMs),是CRISPR/Cas9系统行使切割功能的基本条件,即病毒基因组中与Cas9核酸酶靶序列相邻的短2-6个碱基对序列。
Cas9/crRNA复合体能够识别PAM(5’-NGG)位点导致DNA解旋,使crRNA找到PAM位点相邻的DNA互补链,即可形成RNA-DNA异源双链结构,引导Cas9核酸内切酶产生双链断裂。如果crRNA与靶DNA不互补,Cas9将会被释放出来,寻找新的PAM位点。
(2)作用机制
随后,通过HDR或NHEJ机制修复,DNA的修复过程产生突变DNA,最终的突变DNA可能包括DNA序列的删除或插入(NHEJ),或替换特定的DNA序列作为进一步研究的标记(编码荧光蛋白、标签蛋白、抗生素或限制性内切酶消化的识别序列)。
目前crRNA和tracrRNA分子可形成双链结构,融合为嵌合的单一向导RNA (single-stranded guide RNA, sgRNA),使CRISPR/Cas9更容易在基因组工程中使用。
不论是ZFN还是TALEN技术,其定向打靶都依赖于DNA序列特异性结合蛋白的合成,这一步骤非常繁琐费时。
相比之下,作为第三代基因组编辑工具的CRISPR/Cas9技术,可使用一段序列特异性sgRNA引导单一的、多结构域的Cas9蛋白到靶点处,即可完成基因组的编辑。
好了,背熟了以上3个基因编辑技术,我猜科研狗子们已经不仅仅想要八卦和吹牛了,不安的小爪爪估计也跃跃欲试了。开篇就跟你们说了“基因编辑婴儿”事件,这一事件已经引起了国际上的强烈抗议,因为它逾越科研和医学伦理道德底线,后果很严重哦。
随着科技的发展,基因编辑的革命已经到来,有望开发出治愈绝症以及应对气候变化的新方法,使人类有机会从根本上改变人类与自然的关系。但是新的基因技术也带来了新的道德和实践风险,其中一些可能会像生物战一样具有可怕的威胁,那么基因编辑技术的前景应该如何与潜在的危险相平衡,谁来决定哪些风险值得冒呢?

又和我们一起学习到这里啦!棒棒的你们现在对基因编辑知多少了呢?你是否对第三代基因编辑技术CRISPR/Cas9想进一步了解呢?关注我们吧!下期更精彩哟!
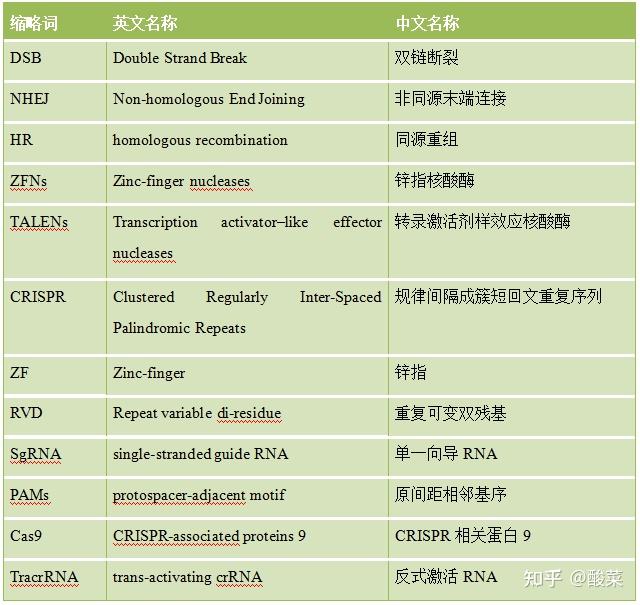
附表1 中英文缩略词表
参考文献
[1]Petersen Bjoern,Niemann Heiner,Advances in genetic modification of farm animals using zinc-finger nucleases (ZFN).[J] .Chromosome Res, 2015, 23: 7-15.[2]Sun Ning,Zhao Huimin,Transcription activator-like effector nucleases (TALENs): a highly efficient and versatile tool for genome editing.[J] .Biotechnol Bioeng, 2013, 110: 1811-21.[3]Abdelnour Sameh A,Xie Long,Hassanin Abdallah A et al. The Potential of CRISPR/Cas9 Gene Editing as a Treatment Strategy for Inherited Diseases.[J] .Front Cell Dev Biol, 2021, 9: 699597.
酸菜:“基因编辑婴儿”掀起轩然大波,科研狗子们八卦之前应该知道的几件事儿4 赞同 · 0 评论文章
 |
|
 /3
/3 