金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
RT-PCR是分子生物学中一项常规的实验,但对于刚刚进入实验室的小伙伴来说可能比较陌生。今天,我们就来聊聊如何进行RT-PCR操作。
准备阶段:合成引物,购买RNA提取试剂盒,购买反转录试剂盒,购买RT-PCR试剂盒,购买耗材:八联管,无酶加样枪头,无酶手套。
在进行RT-PCR之前,我们需要设计拟分析基因的引物,如何设计呢?首先我们需要找到该基因的编码序列CDS(Coding sequence)。这里我们以血红素加氧酶HO-1基因为例,在PubMed中的Gene数据库中进行查找。
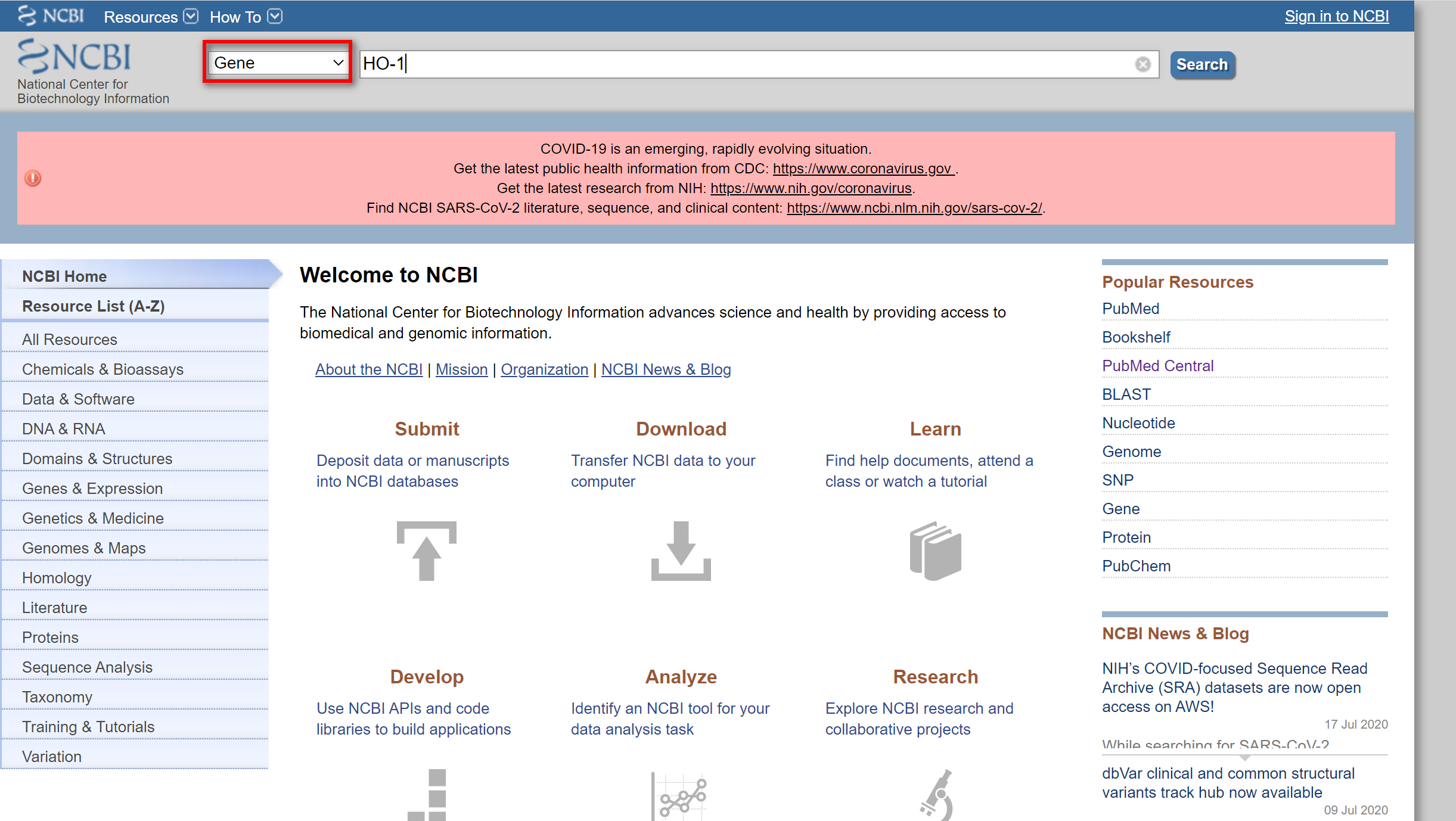
点击Search, 进入下级界面,找到正确种属,这里以human为例
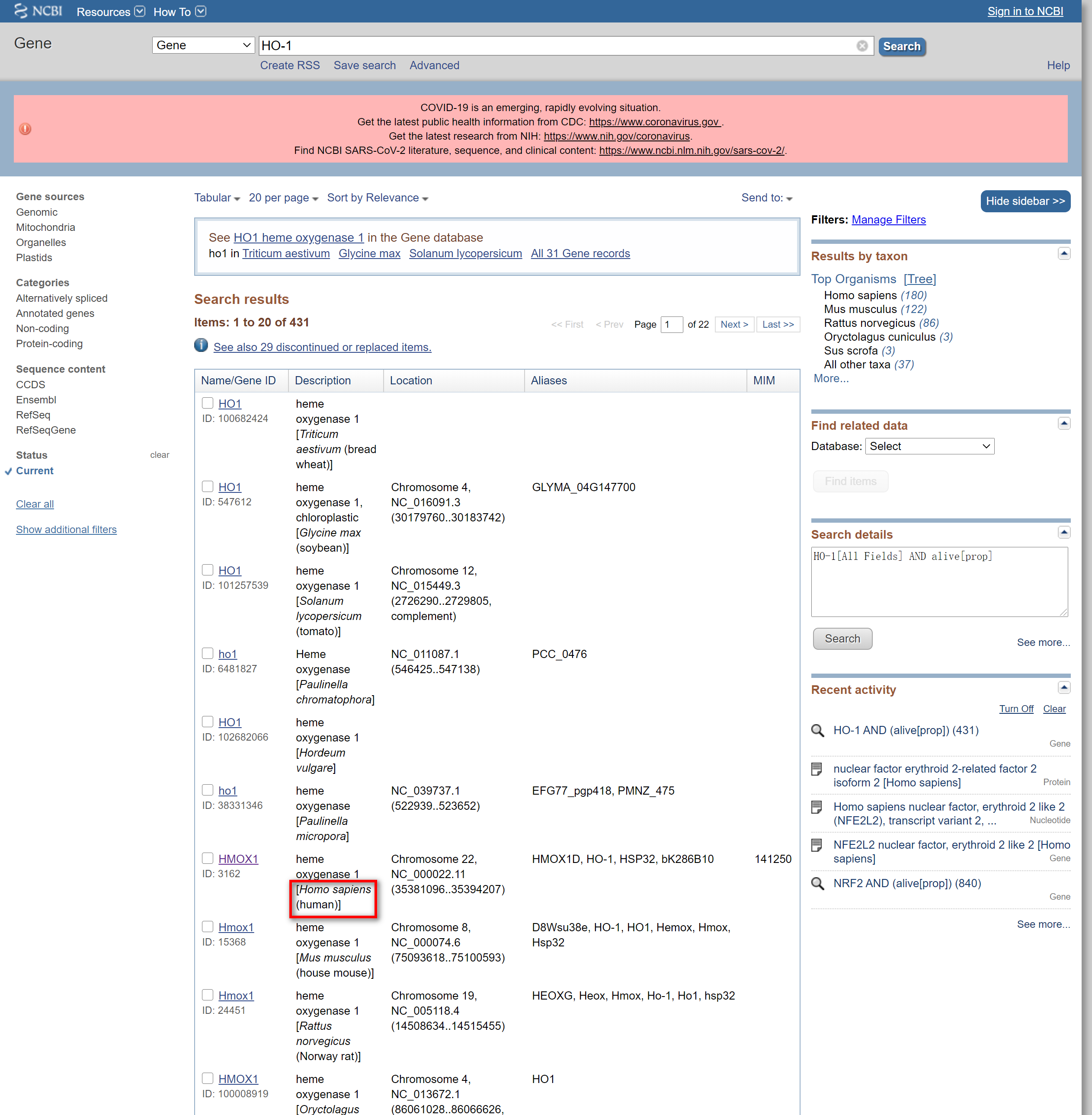
点击HMOX1,进入下级界面,往下翻
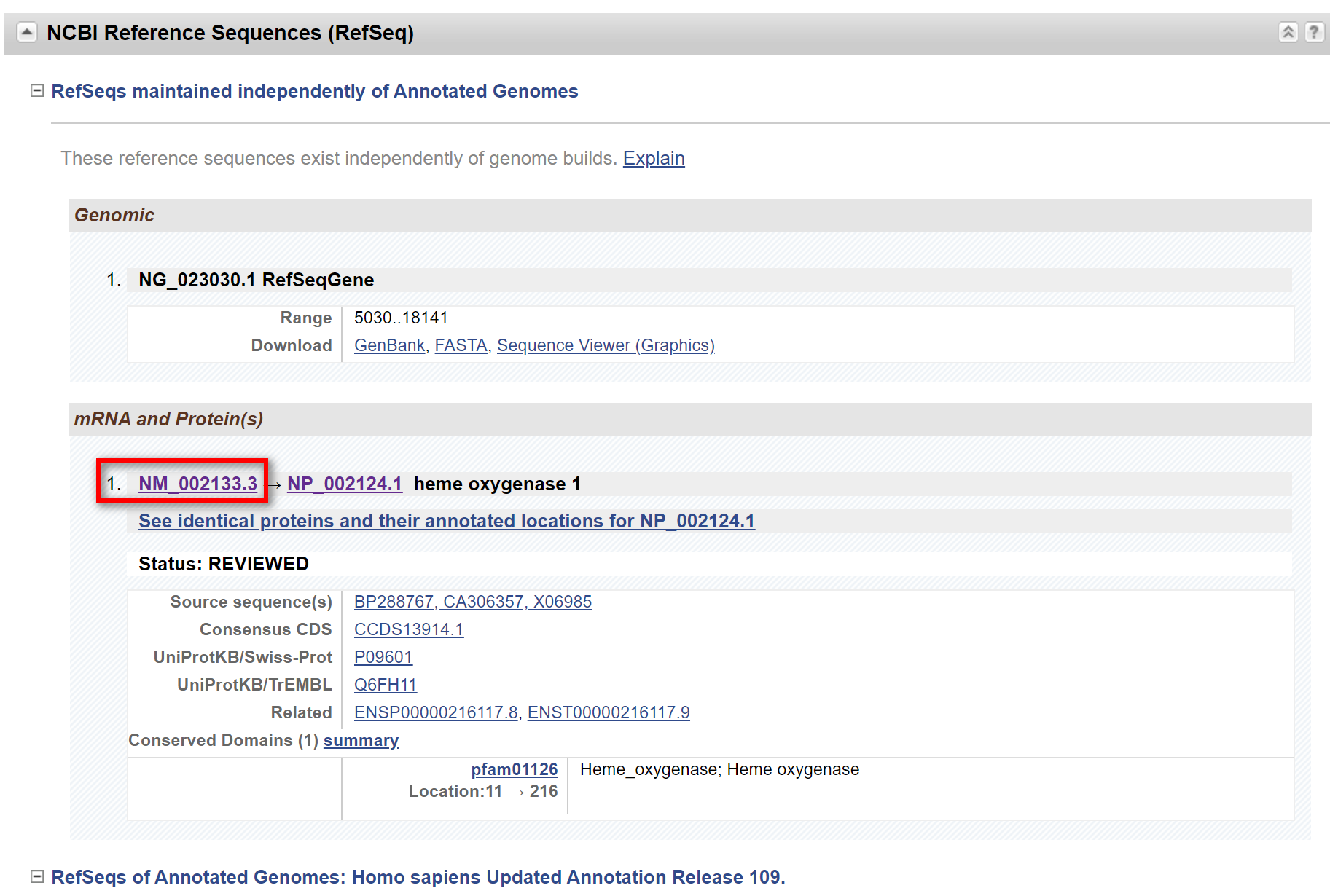
点击红色方框内链接,进入下级界面,往下翻,找到CDS
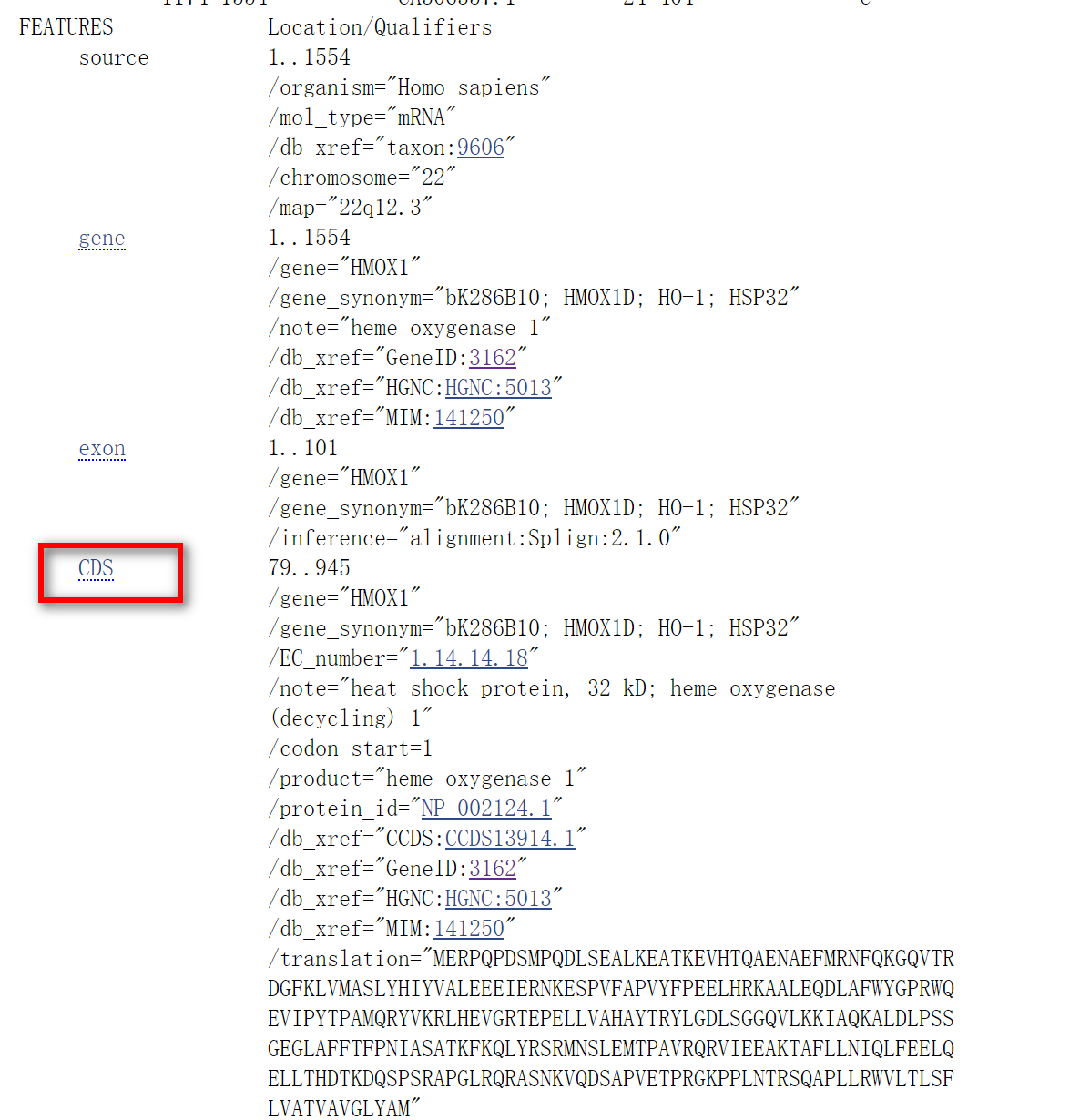
点击CDS,进入下级界面
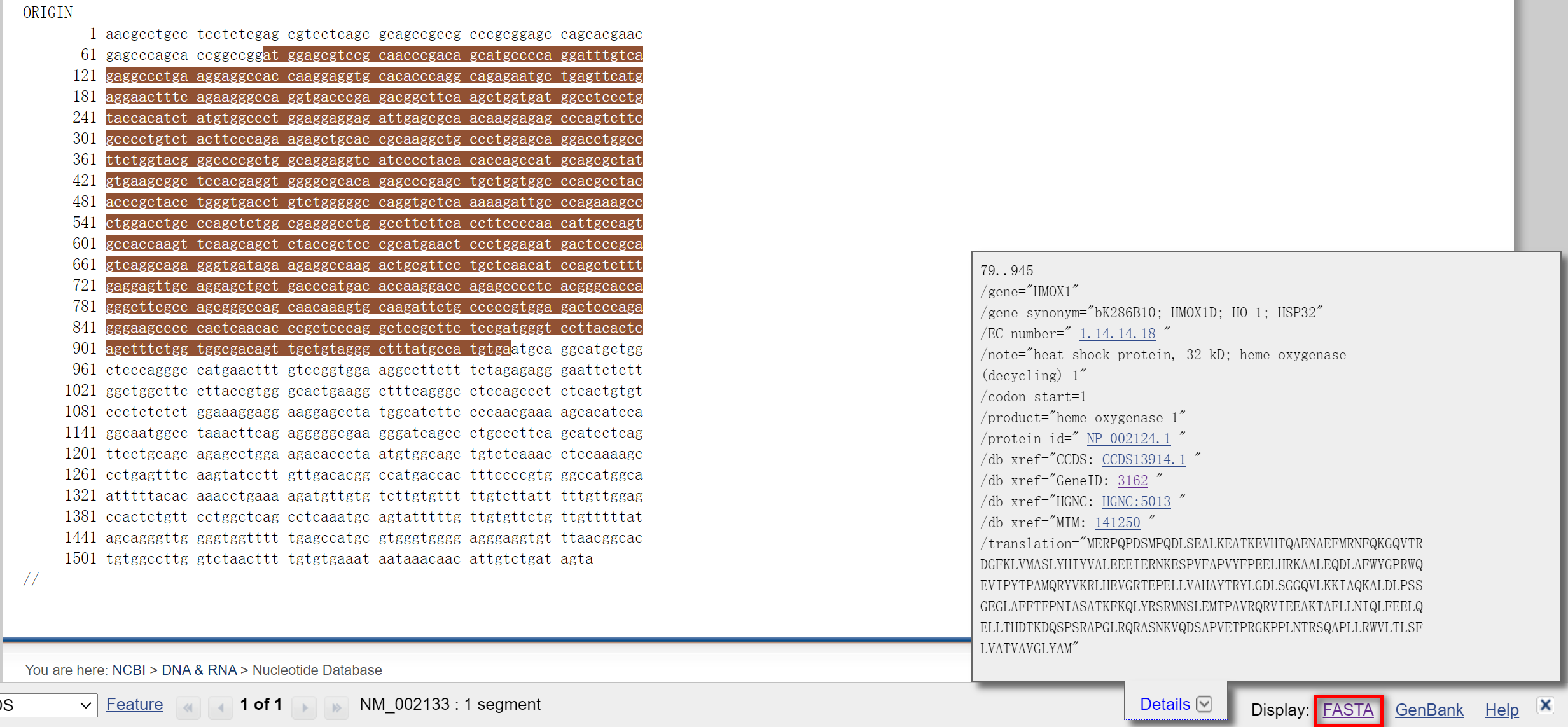
点击右下角的FASTA,就能得到我们需要的序列
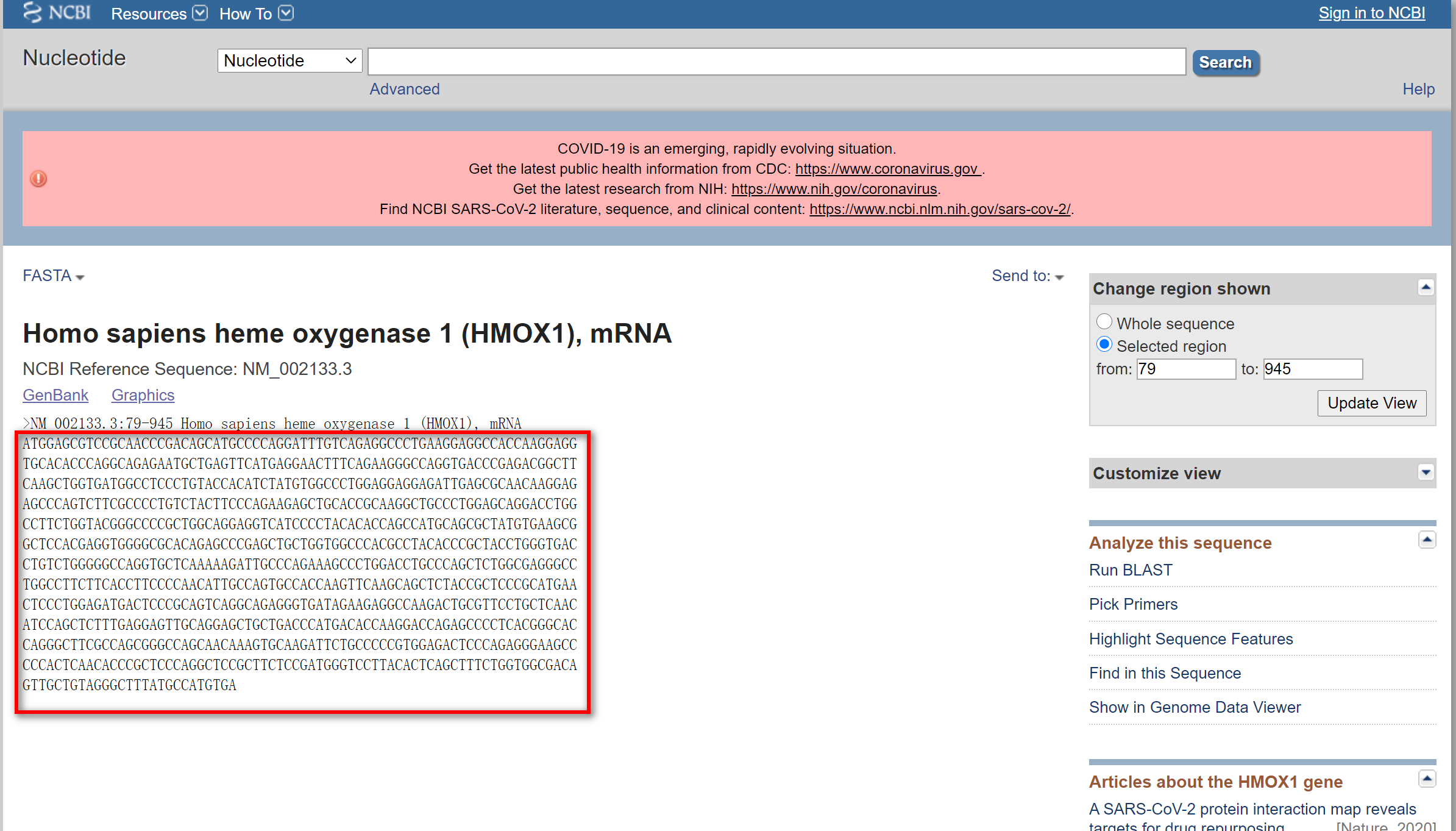
方框中的序列即为HO-1的编码序列。有了编码序列接下来可以设计引物了,网上很多网站可以进行这一工作,这里我们偷下懒,用上海生工的免费引物设计功能
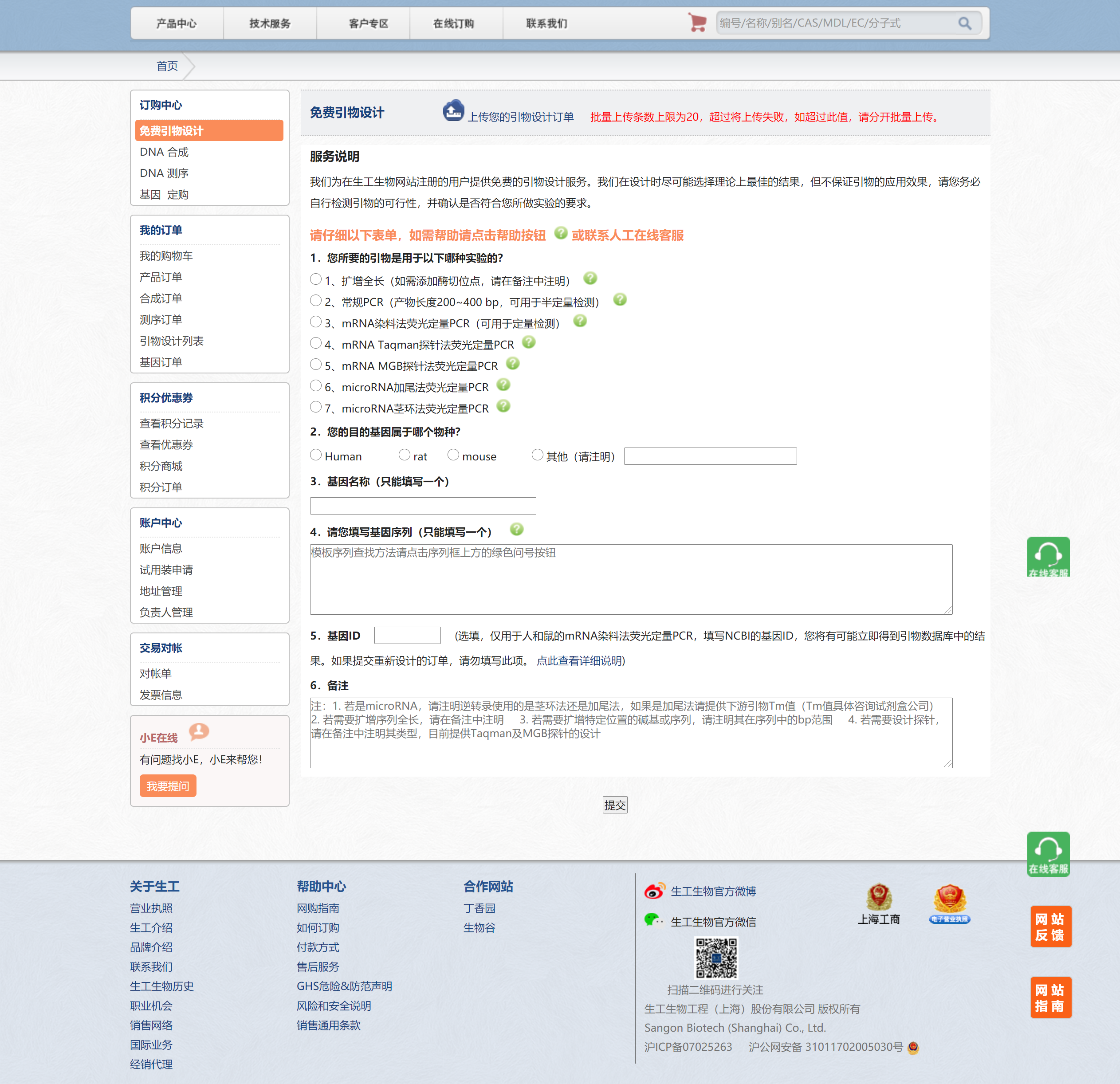
当引物设计好后,就可以开始正式实验了。注意除了目的基因的引物,还需要内参基因引物,例如β-Actin,GAPDH。
提取RNA:提取RNA,常用的如trizol法,吸附柱法。当然,这些都有相应的试剂盒,这里不做推荐。根据经费情况选择适宜的国产或进口试剂盒,按照说明进行操作就可以了。
RNA纯度检测:当用试剂盒提取到RNA后,需要对RNA的纯度进行检测,一般用微量分光光度计测定OD260/OD280的比值,介于1.9-2.0(或1.8-2.0)说明RNA纯度较高。
RNA完整性检测:通过RNA电泳,检测28S,18S,5S等小分子RNA条带,具体操作步骤根据购买的试剂盒说明书进行。
逆转录:这一步的目的是将RNA逆转录成cDNA,购买相应的反转录试剂盒,按照说明书进行操作即可。注意,该操作在八联管中进行,会用到qpcr仪(根据实验室qpcr仪操作说明完成操作)
qPCR:得到cDNA后,可以对其进行扩增并检测,SYBR染料法和探针法比较常用,根据需求选择相应的试剂盒。将相关试剂加入八联管(一般来说每个样本设置3个或4个复孔。记得要加入内参基因!),放入qpcr仪中,设置好温控程序,该程序可以使用qpcr试剂盒说明书推荐的程序,也可以按照实验室以往设置好的程序。
等待一两个小时后,就可以导出我们所需的Ct值进行分析了。但现在很多qpcr的程序中只能导出Cq值,两者是可以互通的。
数据分析:假设我们得到下面一组数据(瞎编的数据,Well编号出现了重复,之前没有注意,大家无需理会)
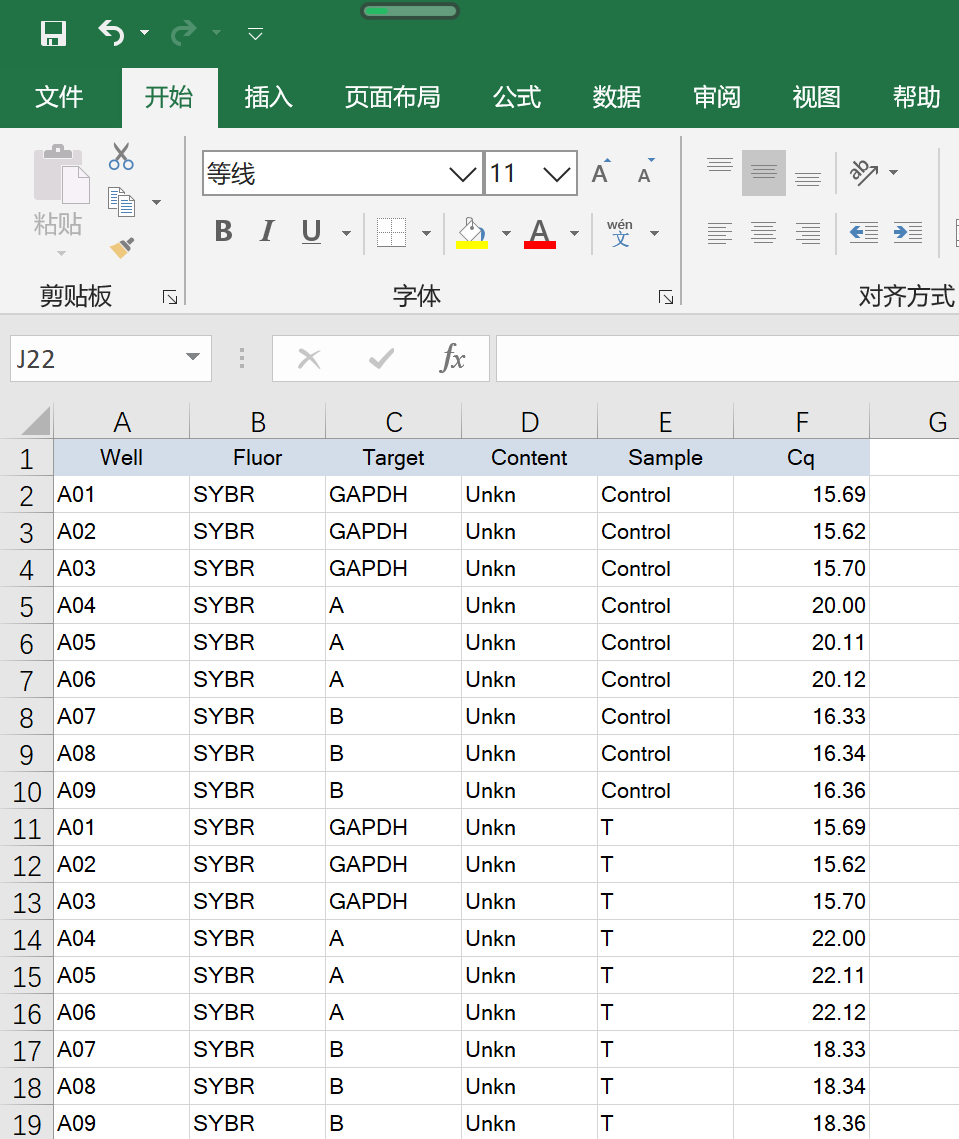
对数据进行分析:我们可以获得基因的绝对表达情况,需要作标准曲线,这也不难。但用得更多的是评估每个基因的相对表达。一般采用2-ΔΔCt计算,这里简单演示一下。
利用公式计算复孔平均值
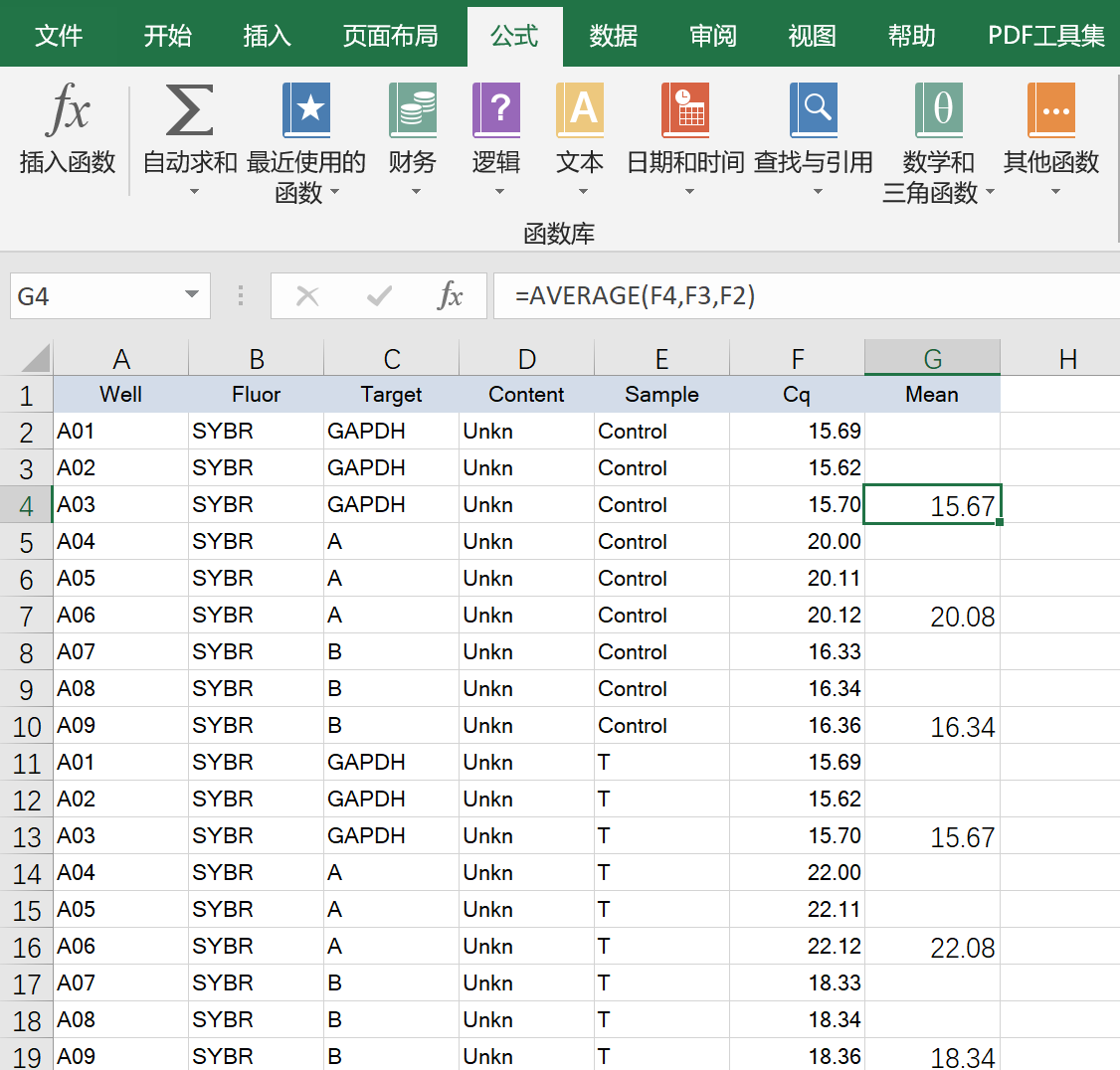
ΔCq=每组内基因的Cq-内参基因的Cq
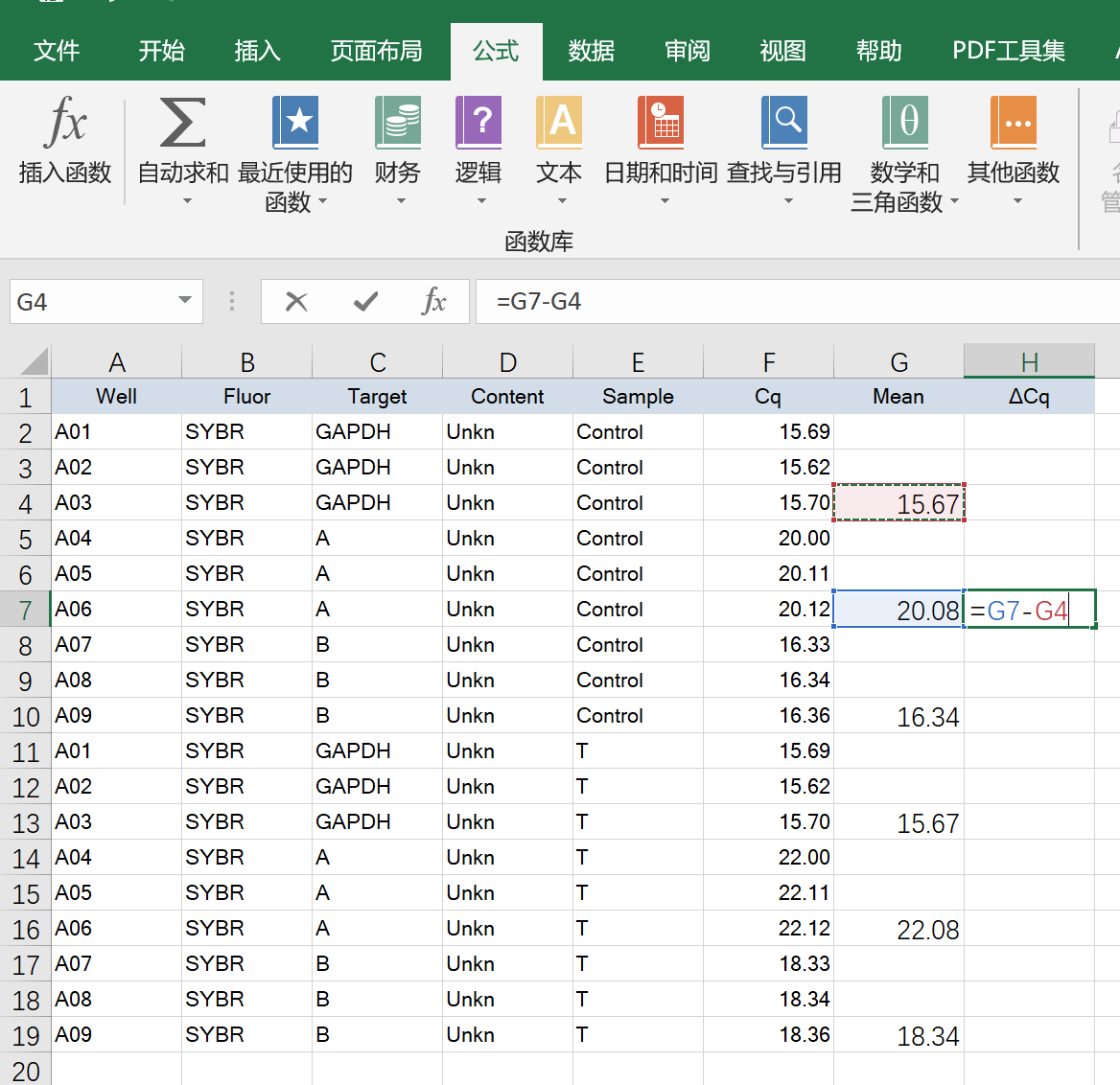
如法炮制,得到所有的ΔCq
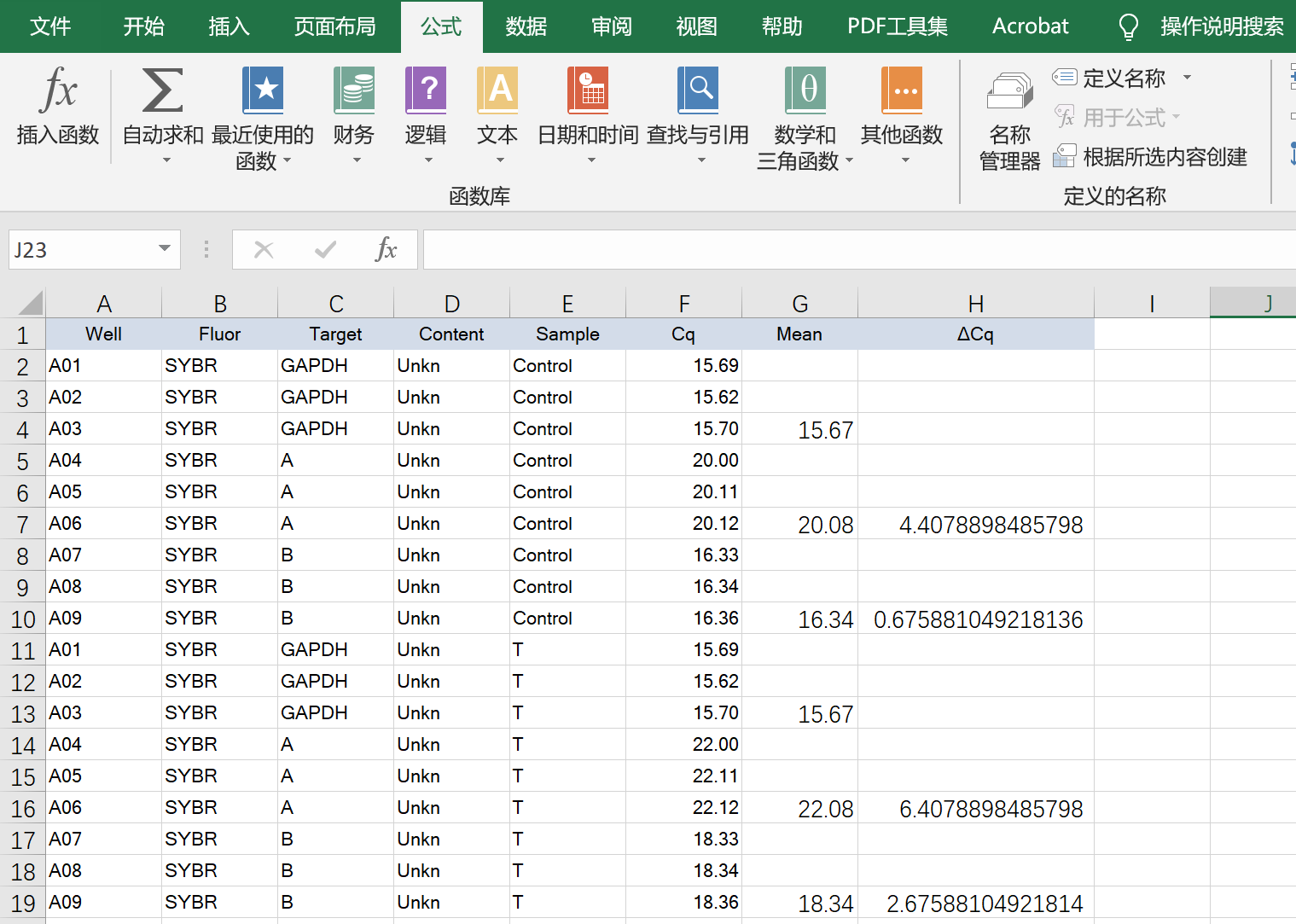
ΔΔCq=实验组基因的ΔCq-对照组Control对应基因的ΔCq,如图所示
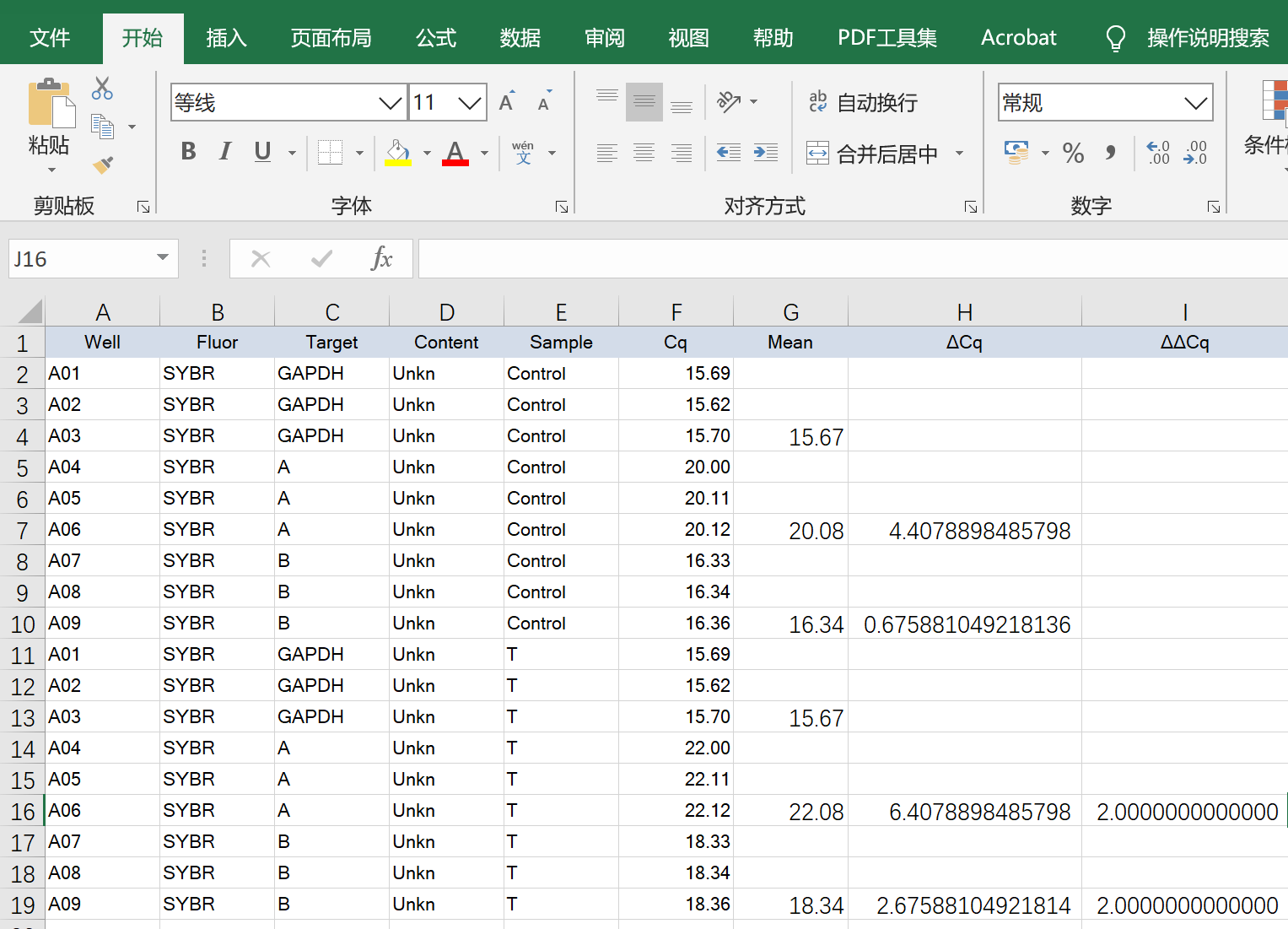
有了ΔΔCq,接下来就可以计算2-ΔΔCt
选择公式,输入power,点击转到
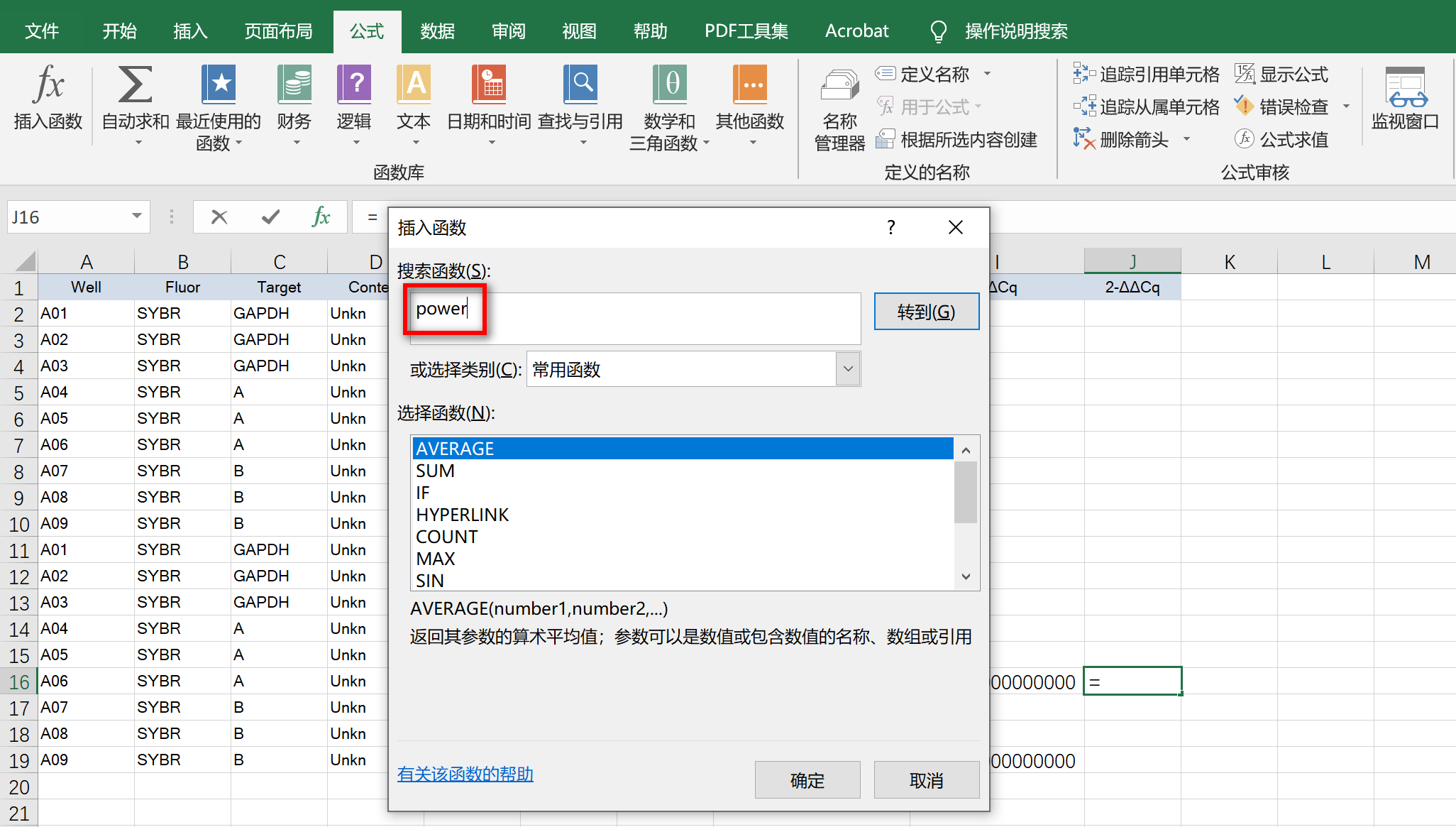
进入power函数设置窗口
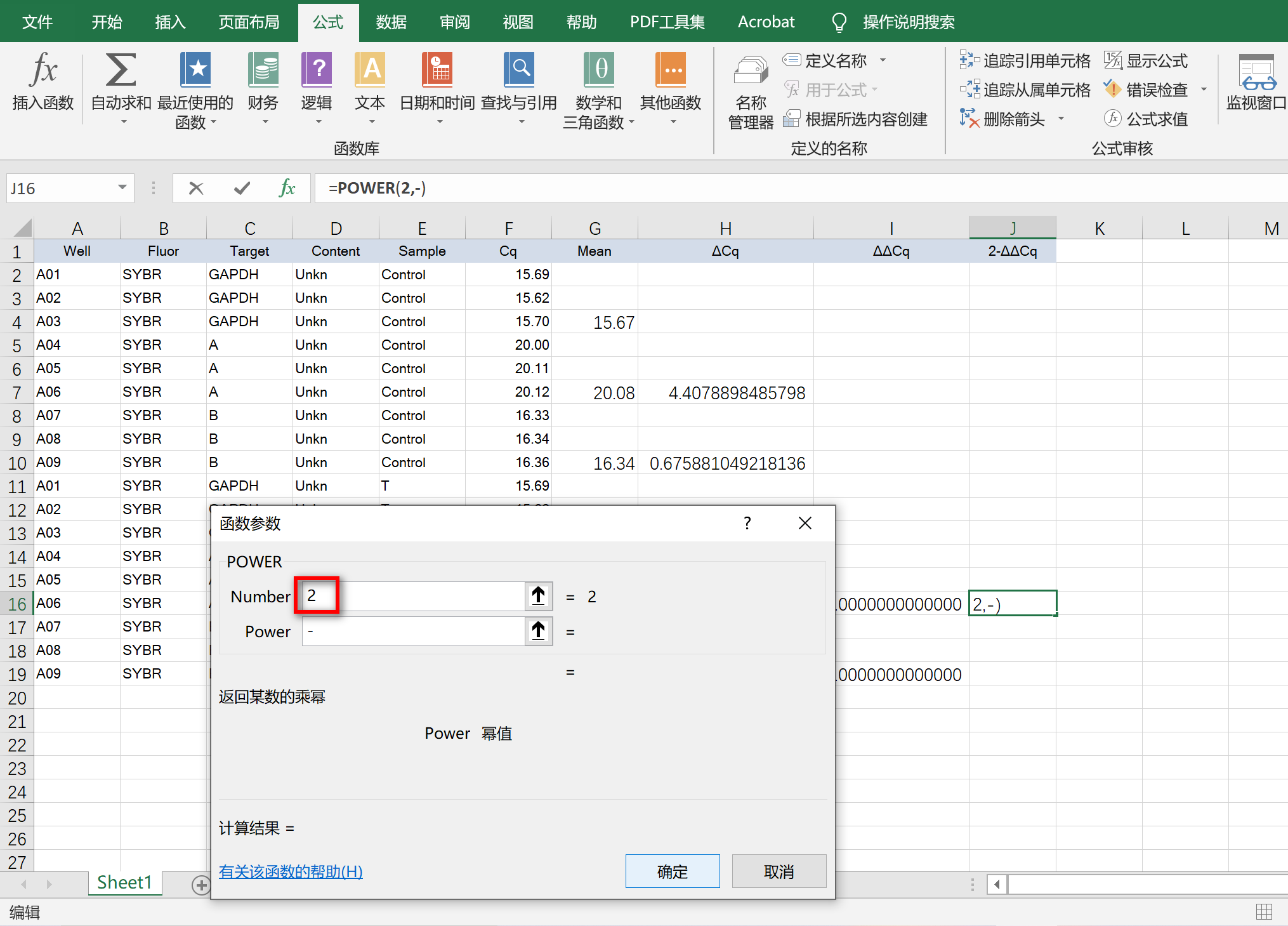
Number输入底数,Power输入幂值-ΔΔCq
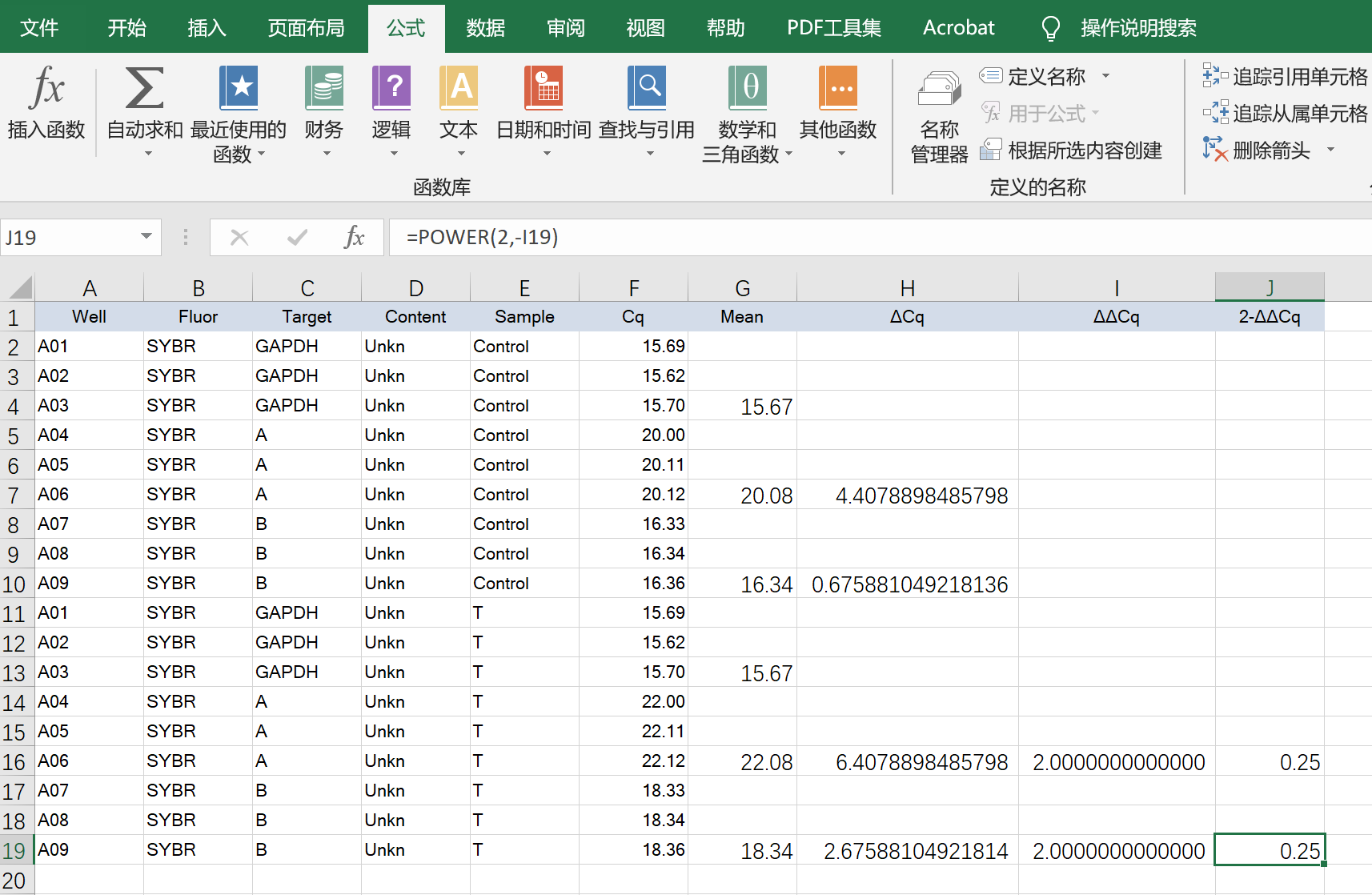
重复三次试验,就可以获得三次数据,有了三次数据,就可以进行统计分析了(有的数据处理是进行三次独立实验,有的会有其他操作,这里仅对方法介绍)。
统计分析:打开graphpad
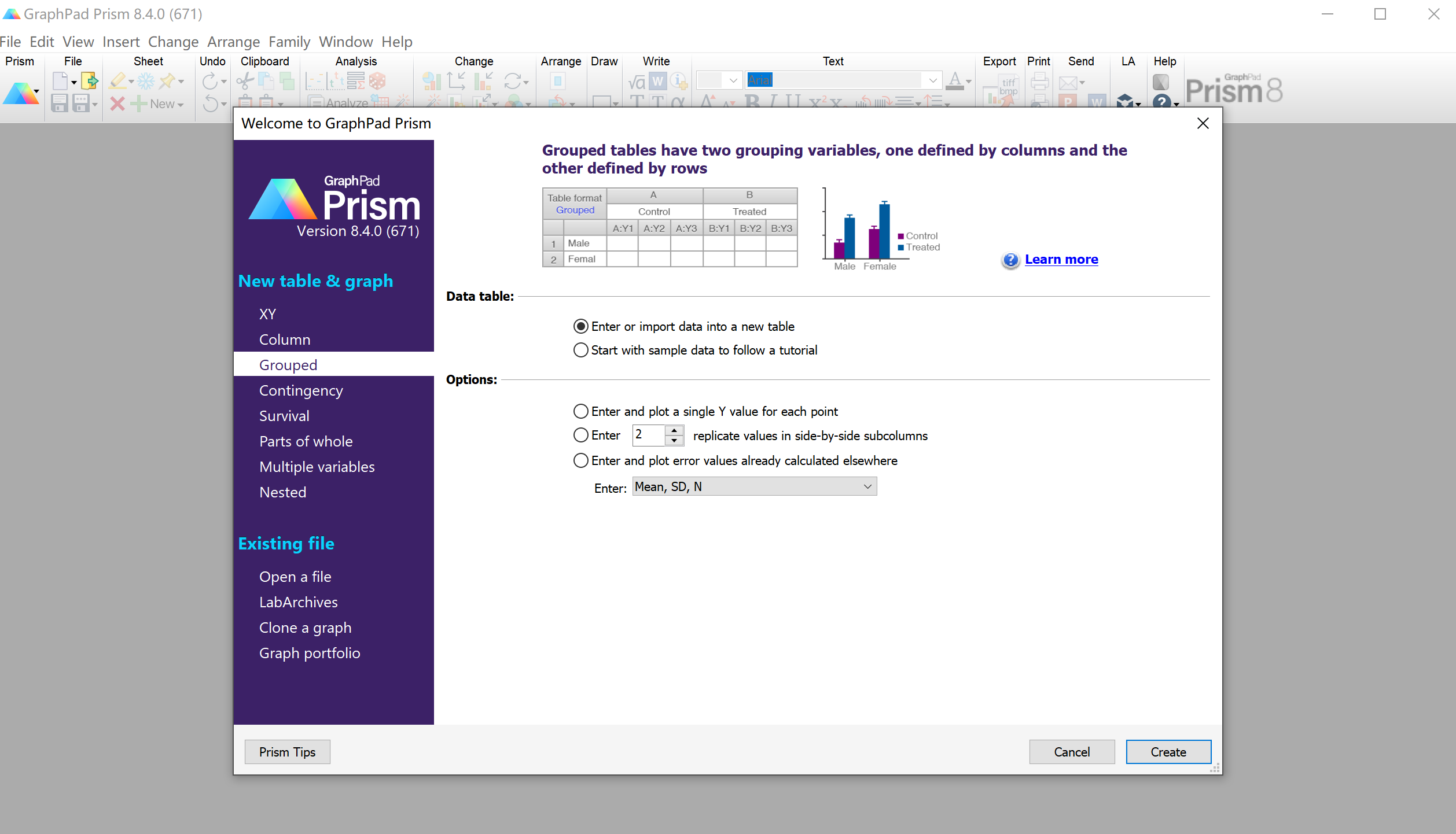
输入三次实验的数据,这里没有实验数据,就随便填写了几个
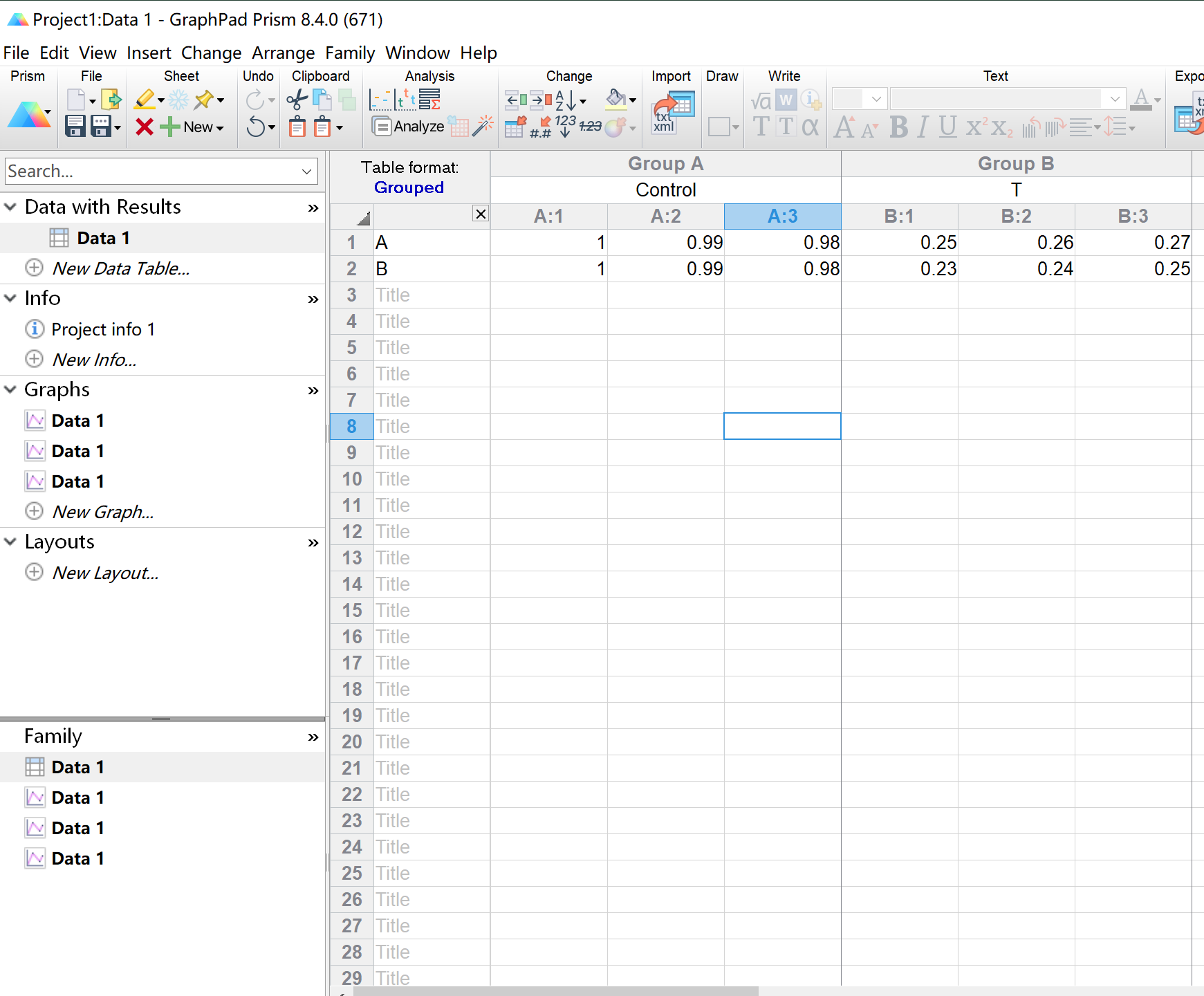
输入数据后,点击Analyze,对实验数据进行统计学分析,选择适合自己实验的统计学方法
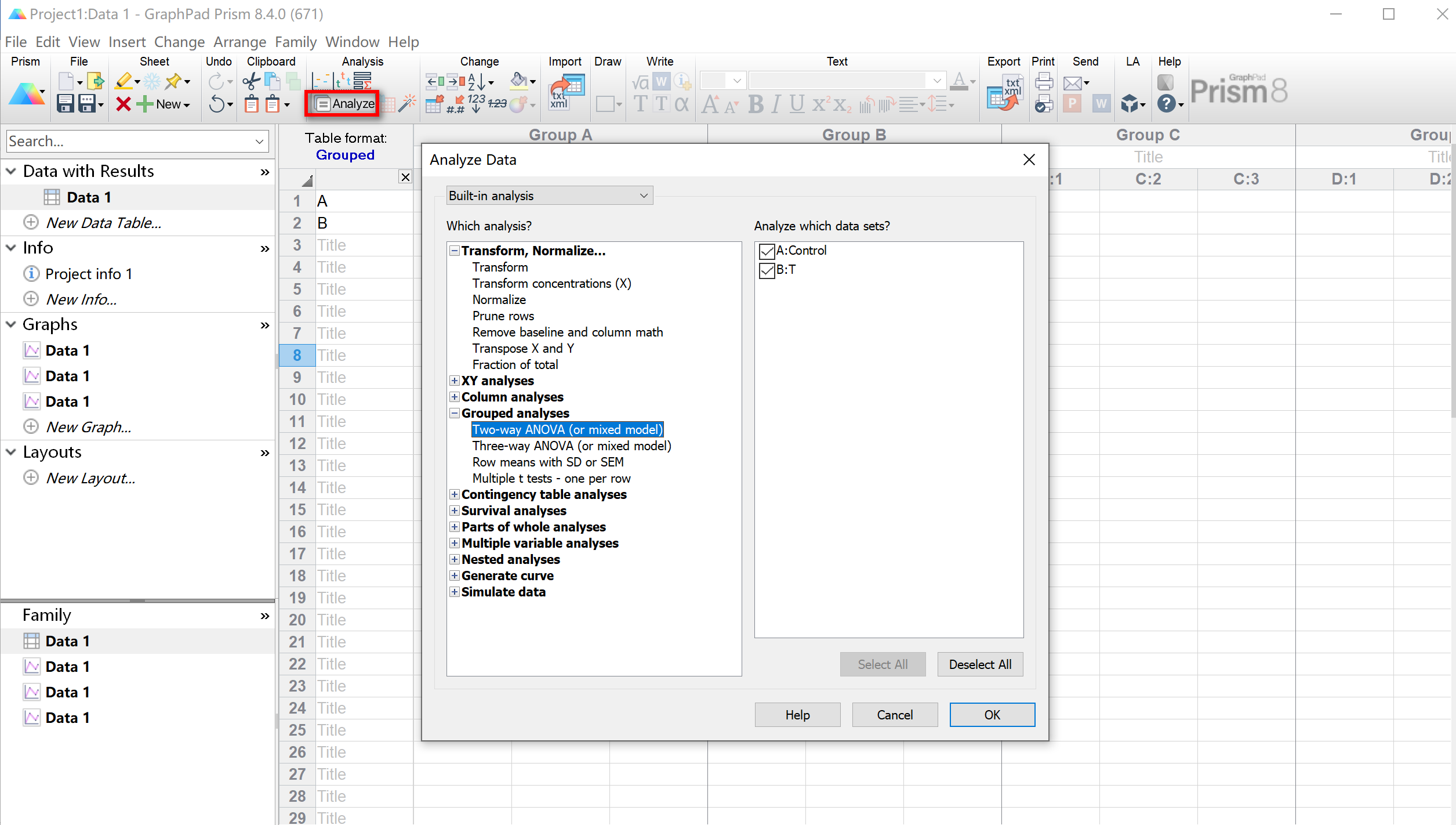
另外,点击Graphs可以绘制图片
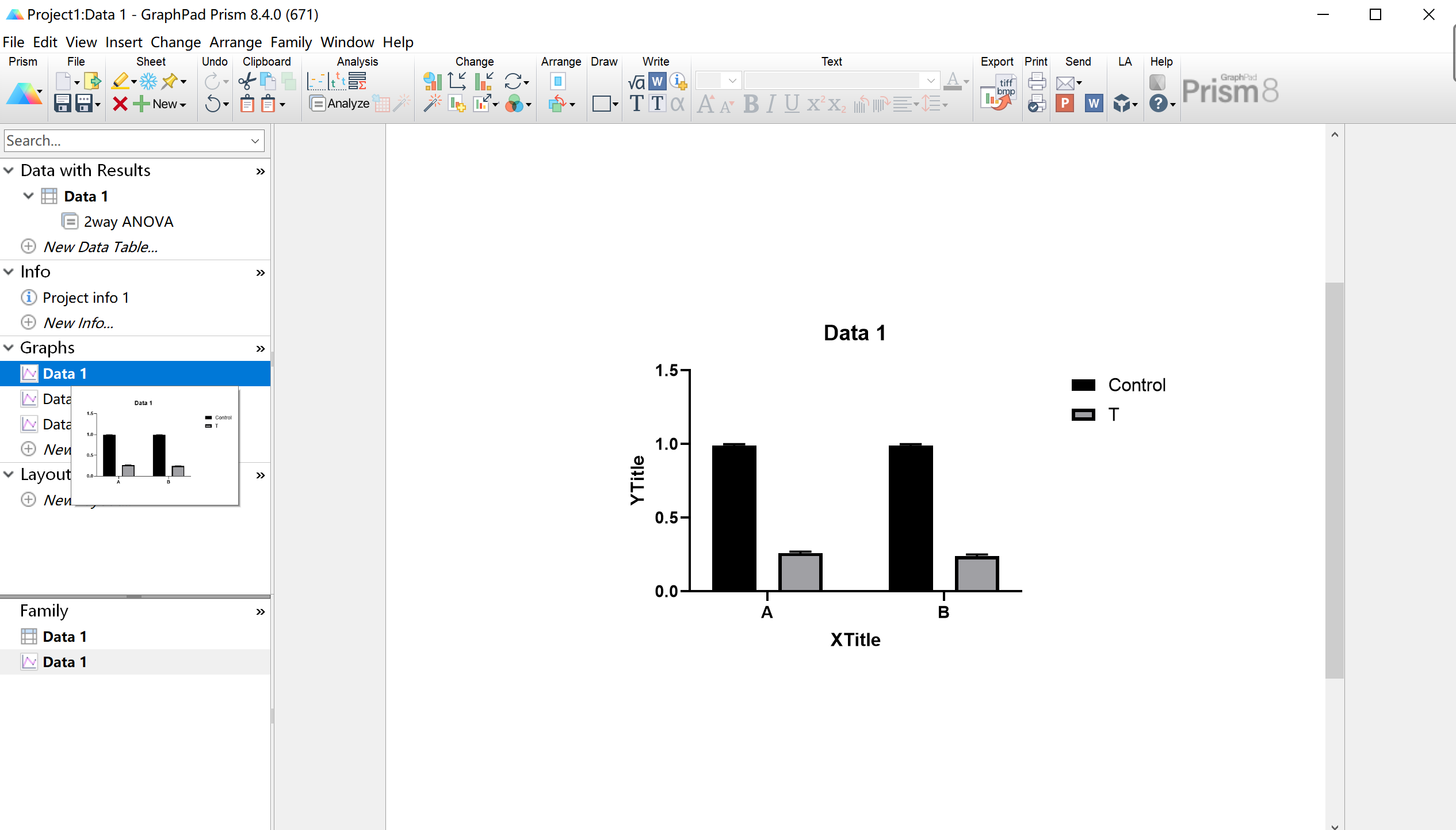
至此,RT-PCR实验流程基本走完。
原文地址:https://zhuanlan.zhihu.com/p/163070515 |
|
 /3
/3 