金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
CRISPR/Cas9技术因其操作便捷、简单、高效等特点,被广泛应用于生物医药医学研究。
<hr/>CRISPR/Cas9系统由一个单链向导RNA(small guide RNA, sgRNA)和一个具有核酸内切酶功能的Cas9 蛋白组成,如图1。在sgRNA特异性识别下,Cas9蛋白到达基因组特定位点,对双链DNA(double-stranded, dsDNA)进行切割,产生dsDNA断裂(double-strand break, DSB)。然后,DSB通过细胞自主性的非同源末端连接(nonhomologous DNA end joining, NHEJ)或同源重组(homology-directed repair, HDR)进行修复,其中占主导地位的NHEJ修复容易引发突变。革命性的CRISPR技术一问世就引发科研界和工业界的广泛关注,2013、2015、2017、2020和2021年多次被Science杂志评为十大科学进展之一。2020年,诺贝尔奖化学奖授予了CRISPR基因编辑技术开发者—加州大学伯克利分校教授詹妮弗 ·杜德纳(Jennifer Doudna)和德国马普感染生物学研究所教授埃马纽尔·夏彭蒂耶(Emmanuelle Charpentier)再次将CRISPR基因编辑推上热点。
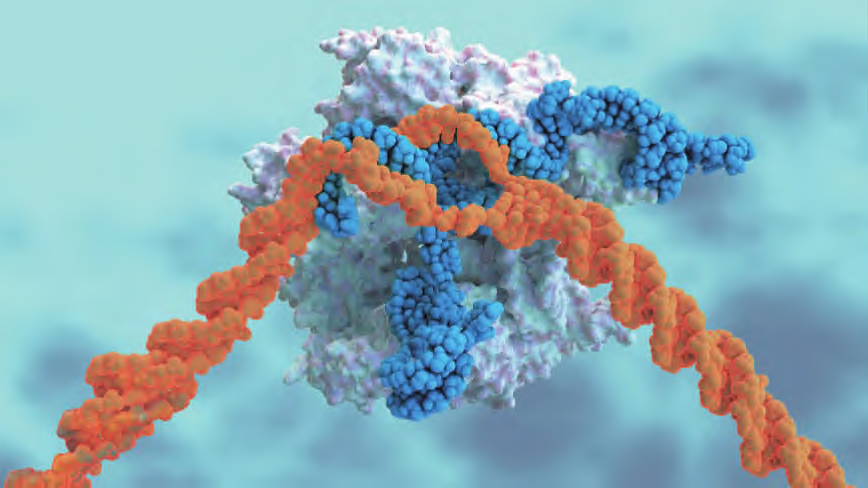
图1. sgRNA(蓝色),CAS9蛋白(白色),靶标基因(橙色)(图片来源:Science官网)
CRISPR/Cas9技术因其操作便捷、简单、高效等特点,被广泛应用于生物医药医学研究。本文概括总结了其在基因功能筛选、疾病模型建立、免疫治疗、基因治疗、类器官,以及活细胞标记和成像六大领域中的应用进展。
1、CRISPR/Cas9 全基因组功能筛选
CRISPR/Cas9全基因组筛选技术可在全基因组范围内便捷并高效地进行基因编辑,不仅能助力于发现疾病发生、发展过程中目的基因表达的变化,还能为药物进一步开发与应用提供重要依据。目前,该技术已经在肿瘤治疗、耐药性研究及病毒感染研究等方面广泛应用。
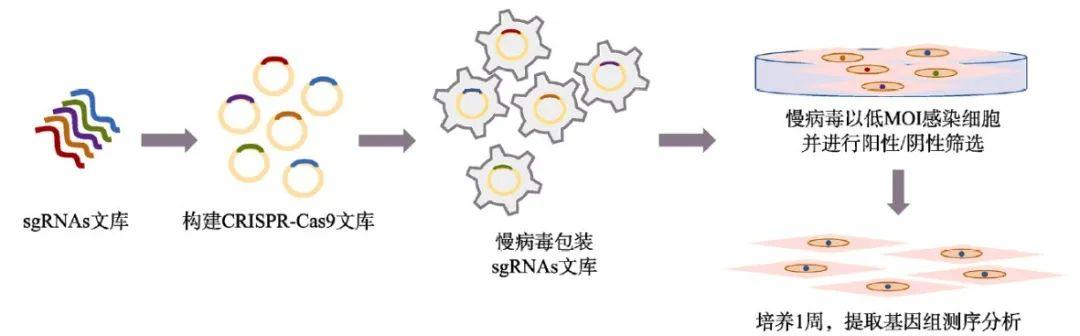
图2. CRISPR/Cas9全基因组功能筛选系统工作流程(图片来源:参考文献【1】)
①确定表型与基因筛选范围;②构建全基因组敲除或激活基因的sgRNA文库;③包装慢病毒文库,通过低感染复数(multiplicity of infection, MOI)的全基因组慢病毒文库并感染目的细胞,构建稳定表达sgRNA的细胞文库并获得稳定表达株;④筛选细胞表型:对转染后的细胞施加抗生素或药物等压力,通过细胞的存活情况进行阳性筛选(保留能存活的细胞)、阴性筛选(挑选死亡细胞)或根据细胞增殖能力和标记基因进行筛选等;⑤分别提取筛选后细胞的基因组并建库,然后利用高通量测序手段获得细胞文库中的sgRNA序列信息,并筛选目的性状的关联基因,进行后续步骤。[1]
2020年,瞿昆教授课题组和美国加州大学圣地亚哥分校Bryan K. Sun教授课题组在Genome Research杂志上报道,利用基于CRISPR/Cas9系统的CRISPR干扰技术(CRISPRi)对人表皮细胞中2263个IncRNA进行了表达抑制筛选,预测了10个具有显著性差异并可能具有功能的长链非编码RNA。通过进一步验证和筛选,发现PRANCR这一新型长链非编码RNA可以调控角化细胞的细胞周期,增殖和克隆增生,该基因的缺失则会导致表皮分层受损,并破坏表皮系统稳态。[2]
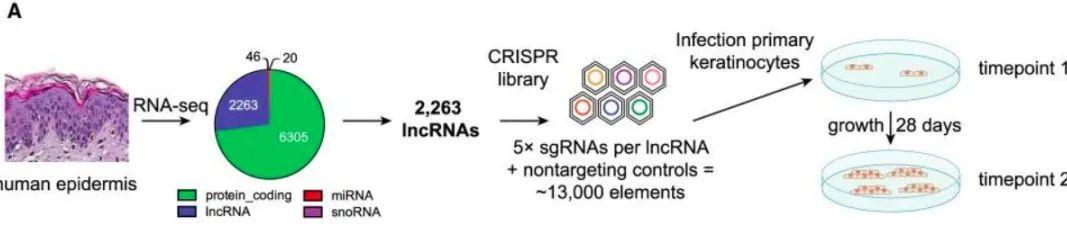
图3. CRISPRi文库设计策略和 CRISPRi 筛选示意图(图片来源:参考文献【2】)
两种基因的编码区部分或全部异常融合在一起,形成一个新的基因异常被称为基因融合(gene fusion),在实体瘤中的发生频率很高(如图4所示)。目前,已报道发现的融合基因有20,000多种,但它们在肿瘤发生和进展中的作用尚不完全清楚。Garnett研究组分析显示来自43种不同癌症类型的8,000多种融合基因。研究人员利用CRISPR/Cas9文库筛选,首次发现了在胶质母细胞瘤AM-38细胞、卵巢癌ES-2细胞、头颈癌SAS细胞中共同存在的一种融合基因YAP1-MAML2。这种融合基因通过上调表达YAP1,激活Hippo信号传导,促进肿瘤细胞的耐药、抗凋亡和变异,最终导致肿瘤患者的不良预后。综上,通过抑制Hippo信号通路治疗携带YAP1-MAML2融合基因的实体瘤患者是肿瘤治疗的新思路。[3]
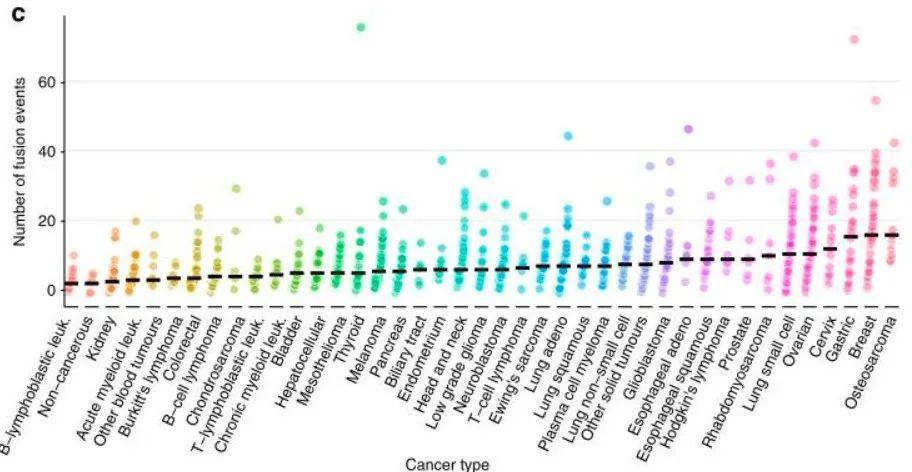
图4. 不同类型癌细胞系中发生基因融合的频率(图片来源:参考文献【3】)
另外,利用CRISPR/Cas9基因功能筛选还可以进行药物耐药性机制的研究。如吉西他滨是治疗晚期或转移性胆囊癌的常用药物,但某些患者不可避免地对该药物产生抗药性及相关的不良反应。为了探索胆囊癌的耐药机制,Xu等利用CRISPR/Cas9技术对胆囊癌细胞NOZ进行了功能基因组筛选,鉴定了ELP5基因的缺失赋予了NOZ细胞抵抗吉西他滨的能力。[4]
2、疾病模型
动物疾病模型主要用于模拟人类疾病的生物学和病理特征的研究,在疾病发生机制和药物筛选等基础和转化研究中发挥关键作用。CRISPR/Cas9技术因具有编辑效率高、操作简单和适用范围广等优点,已广泛用于肿瘤、神经退行性疾病、白化病等疾病模型的建立。
小细胞肺癌(small cell lung cancer,SCLC)是一种高度侵袭性的神经内分泌性肺部肿瘤,约占所有肺癌病例的15%。SCLC增殖速度快、易复发和转移,缺乏有效的新型治疗方法。SCLC动物模型的建立对其发病机理的深入研究和探索新型治疗靶点至关重要。Tyler Jacks研究团队通过CRISPR/Cas9技术同时敲除抑癌基因Trp53和Rb1,成功构建了SCLC的小鼠模型。并借助这一模型,验证了p107和p130这两个视网膜母细胞瘤蛋白家族成员的缺失能够加速肿瘤的生长、显著降低荷瘤小鼠生存期(图5)。该研究证明了使用CRISPR/Cas9系统在SCLC小鼠模型中模拟肿瘤抑制基因丢失的可行性,为进一步研究SCLC的致病机理和未来治疗靶点奠定了基础。 [5]
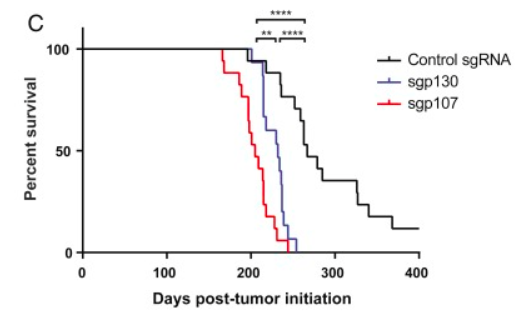
图5. Trp53/Rb1/Cas9 动物的生存分析(图片来源:参考文献【5】)
大多数动物模型都是通过敲除特定基因构建的,而基于单碱基编辑的点突变敲入在构建模式生物、修饰突变基因方面也具有较大潜力。RAG1、RAG2 和IL2RG是一组与B细胞和T 细胞成熟相关的基因。研究人员通过对RAG1、RAG2 和IL2RG位点进行单碱基编辑,通过编码终止密码子,提前结束基因的表达。将这些胚胎种植给代孕猪后,通过测序证明,携带纯合或杂合突变的仔猪都会因肺部感染等原因死亡。对死去的仔猪进行尸检发现它们的胸腺和脾严重发育不足(图6),造成的免疫缺陷,与试验预计表型相同。该实验通过单碱基编辑成功构建出了免疫缺陷的仔猪,这也是第一次将单碱基编辑技术用于大型动物。[6]
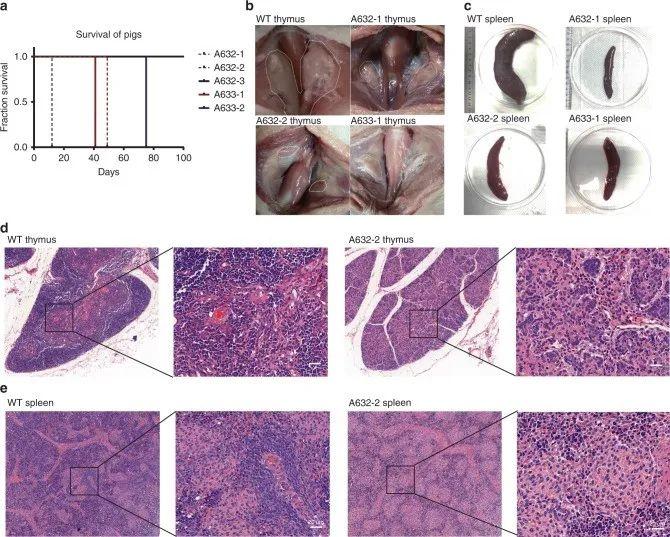
图6. RAG1、RAG2和ILRRG突变仔猪的表型(图片来源:参考文献【6】)
3、免疫治疗
免疫治疗是通过调动患者自身免疫系统杀伤肿瘤细胞的一种方法,主要分为免疫检查点阻断和嵌合抗原受体T细胞免疫疗法(CAR-T)。CRISPR/Cas9技术通过筛选对免疫治疗至关重要的基因、对相关基因进行基因水平改造等手段,为免疫疗法带来了新的突破。
CAR-T疗法可通过在对T细胞进行基因工程手段体外修饰改造后,使T细胞不依赖人类白细胞抗原(Human leukocyte antigen, HLA)也可以靶向识别并杀伤肿瘤细胞,Andrew 教授使用全基因组CRISPR/Cas9筛选,发现T细胞受体(T cell receptor, TCR)通过单形MHC I类相关蛋白MR1识别和杀死多种人类肿瘤细胞,同时对非癌细胞保持惰性(图7),该克隆的T细胞能够杀死自体和非自体黑色素瘤。该研究筛选并证明了MR1分子表现出了泛癌细胞识别的T细胞抗原受体 (TCR)特性,为HLA非依赖性、泛癌、泛人群的T细胞介导的免疫治疗提供新的思路。[7]
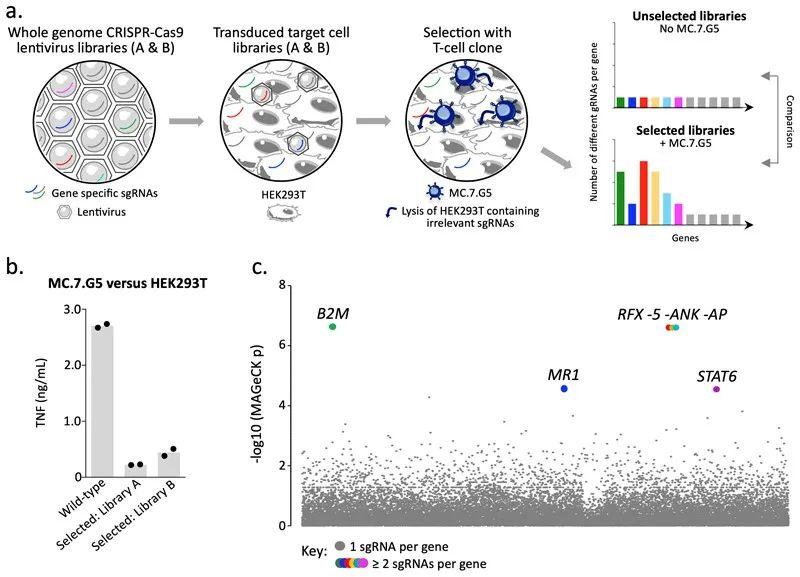
图7. CRISPR/Cas9全基因组筛选揭示MR1为MC.7.G5的候选靶点(图片来源:参考文献【7】)
程序性细胞死亡-1受体(Programmed Cell Death-1 Receptor, PD-1)与其配体PD-L1结合后,抑制T细胞的活化和细胞因子的产生,从而导致肿瘤微环境中的免疫抑制。阻断PD-1/PD-L1信号通路的激活可以解除肿瘤微环境中T细胞的免疫抑制,恢复T细胞的肿瘤杀伤功能。研究证明抑制β-catenin可下调PD-L1的表达。在此基础上,He等开发了基于天然聚合物的递送载体,通过此载体将CRISPR/Cas9系统的质粒递送到肿瘤细胞核,敲除β-catenin下调PD-L1的表达。经过编辑的细胞PD-L1的表达水平显著下降,与活化的CD8+T细胞共培养后,发现CD8+T细胞对编辑后的肿瘤细胞表现出强烈的细胞毒性,可以清除大多数肿瘤细胞,而对未编辑肿瘤细胞的细胞毒性要弱得多。另一方面,还发现与编辑过的肿瘤细胞共培养后的T细胞增殖,远高于与未编辑过的肿瘤细胞共培养的T细胞。γ 干扰素(IFN-γ)是活化T细胞分泌的重要抗肿瘤细胞因子,实验中发现与编辑过的肿瘤细胞共培养后,IFN-γ+T细胞显著增加。说明这种基因编辑不仅通过影响肿瘤细胞,还通过增强免疫系统,提高了机体对肿瘤的杀伤能力。[8]
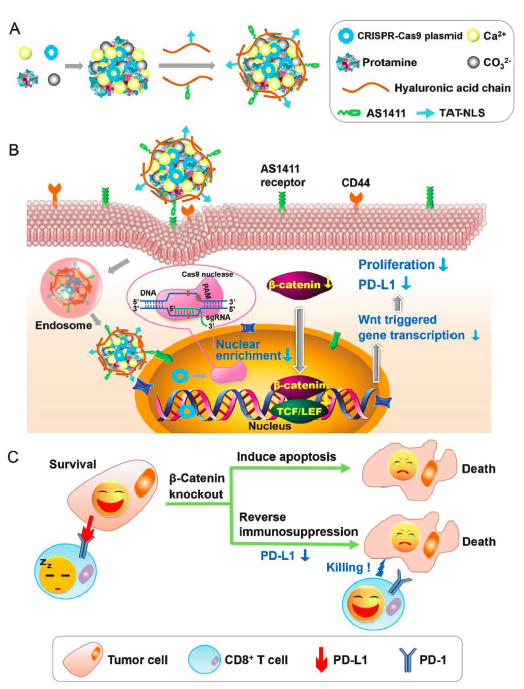
图8. CRISPR/Cas9质粒的多功能化递送系统抗肿瘤机制示意图(图片来源:参考文献【8】)
A)制备 CRISPR/Cas9 质粒的多功能化递送系统,B)肿瘤靶向递送 CRISPR/Cas9 质粒实现有效的基因组编辑用于调控肿瘤细胞行为,C)基因组编辑后涉及的主要抗肿瘤机制。[8]
4、基因治疗
基因治疗是指将外源基因导入靶细胞,修正或补偿由于基因异常或缺失导致的疾病的一种治疗方法。CRISPR/Cas9技术凭借其编辑效率高、可同时靶向多个靶基因等特点,已被用于肿瘤、神经退行性疾病、造血系统疾病和艾滋病等疾病的基因治疗。
包括镰刀状细胞贫血病、β-地中海贫血症在内的β-血红蛋白病,是一类由β-珠蛋白基因突变引起的疾病。该疾病的治疗策略之一是用胎儿血红蛋白(HbF)替代缺陷且不足的成人血红蛋白(HbA)。但由于HbF启动子HBG1处有阻遏物的结合位点,HbF的表达在一岁左右就被关闭了。Humbert 等通过CRISPR/Cas9技术对CD34+的造血干细胞和祖细胞的HBG1处进行编辑,然后将细胞重新注入非人灵长类动物模型中,发现基因编辑细胞的移植率高达30%,持续时间超过1年,外周血中高达18%的红细胞可表达HbF(如图9),证明了被编辑的细胞有效且稳定地重新激活了HbF的表达,这种结果足以逆转镰状细胞贫血病和β-地中海贫血症的症状。[9]
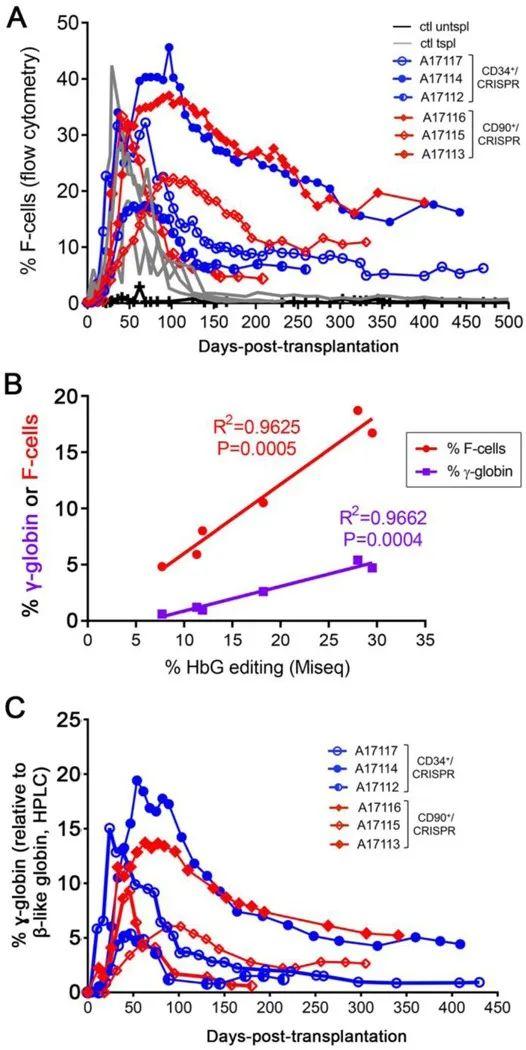
图9. 移植动物的HbF值(图片来源:参考文献【9】)
5、类器官
类器官是可以在实验室中生长的微型器官,它来源于组织和胚胎干细胞/诱导多能干细胞,可以通过CRISPR/Cas9技术进行遗传编码来培养类器官。目前,类器官在生命科学研究中应用广泛,其在发育生物学、病理学、细胞生物学、精准医疗以及药物毒性和药效试验等领域都有着巨大的应用潜力。
2020年,Dekkers等人获取正常乳腺组织上皮,并进行长期培养与扩增,借助CRISPR/Cas9基因编辑技术,靶向敲除乳腺癌相关抑癌基因,并借此成功评估了单个基因突变的致瘤能力。乳腺类器官突变成乳腺癌类器官的过程重述了肿瘤发生过程,有助于乳腺癌发病机制的研究。乳腺癌类器官技术的推广应用有助于进一步识别新的癌症驱动基因和新的药物靶点发现,有助于更好地理解乳腺肿瘤细胞侵袭、转移和耐药的机制。[10]
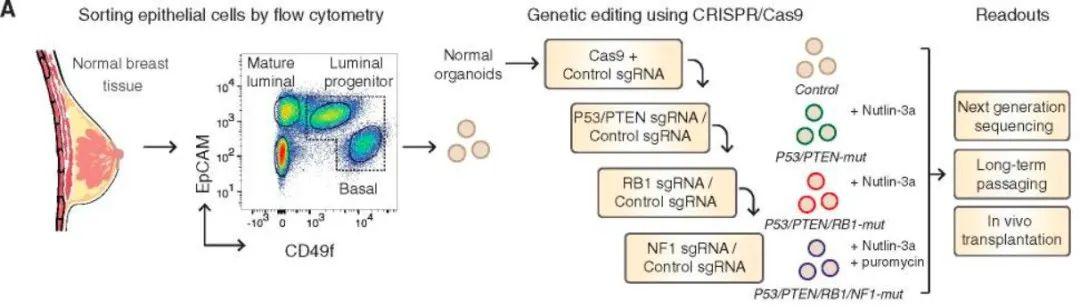
图10. 人类乳腺类器官的产生和转化(图片来源:参考文献【10】)
①从来源于正常人乳腺组织的基底和管腔祖细胞通过流式细胞仪分选并 (n = 10) 生成类器官;②在与乳腺癌有关的 4 个抑癌基因 P53、PTEN、RB1 和 NF1 的类器官中进行顺序 CRISPR-Cas9 介导的基因编辑;③本研究中使用的功能读数。[10]
6、活细胞标记和成像
CRISPR/Cas9基因编辑技术不仅可以对基因组进行编辑,还可以对基因组进行活细胞成像,即在仅有靶向性而无切割活性的Cas蛋白后面融合一个绿色荧光蛋白实现特定基因位点的标记。
2016年,Hanhui Ma利用在gRNA 3’端融合了不同的RNA适配体,包括MS2、PP7、boxB(如下图15),将红、蓝、绿三种荧光蛋白连接在RNA适配体相对应的蛋白,利用三原色原理取得了可同时标记六个不同基因组位点的效果。这个结果将CRISPR/Cas9的优势远远放大,与其他成像技术相比,CRISPR/Cas9更为灵活,可同时靶向多个不同的基因组位点,只要改变gRNA序列,理论上可以做到靶向任意位点,使我们可以同时调控或标记多个位点以观察基因调控网络的整体运作过程。[11]
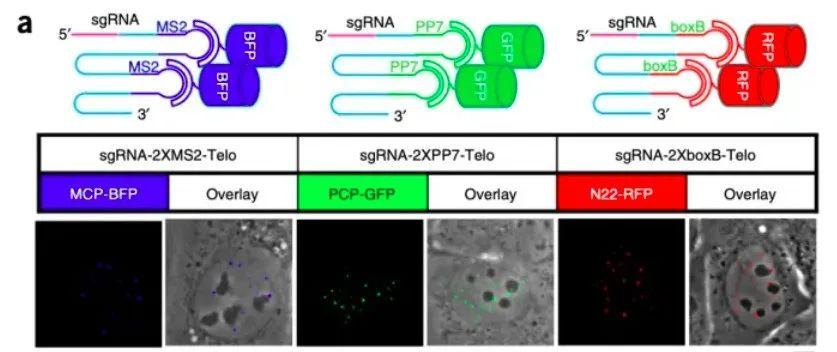
图11. 基因组DNA标记的三原色(图片来源:参考文献【11】)
结语
CRISPR是一种极具发展潜力的新型基因编辑工具,随着基础研究和临床应用的不断革新,可以预期在不久的将来,基于CRISPR基因编辑技术衍生出来的成果以及疗法将改变全球病患的生活。而生命科学领域的从业者也将持续的探索,优化并迭代现有CRISPR编辑技术,不断拓展它的应用前景。
有任何关于CRISPR/Cas9相关技术的问题,欢迎评论区留言或者私信咨询~
参考文献:
[1] 刘思远, 易国强, 唐中林. 基于CRISPR/Cas9 系统在全基因组范围内筛选功能基因及调控元件研究进展. 遗传, 2020,42(5): 435–443.
[2] Cai P, Otten ABC, Cheng B, Ishii MA, Zhang W, Huang B, Qu K, Sun BK. A genome-wide long noncoding RNA CRISPRi screen identifies PRANCR as a novel regulator of epidermal homeostasis. Genome Res. 2020 Jan;30(1):22-34. doi: 10.1101/gr.251561.119.
[3] Picco G, Chen ED, Alonso LG, et al. Functional linkage of gene fusions to cancer cell fitness assessed by pharmacological and CRISPR-Cas9 screening. Nat Commun, 2019, 10: 2198.
[4] Xu SW, Zhan M, Jiang C, et al. Genome-wide CRISPR screen identifies ELP5 as a determinant of gemcitabine sensitivity in gallbladder cancer. Nat Commun, 2019, 10: 5492.
[5] Ng SR, Rideout III WM, Akama-Garren EH, et al. CRISPR-mediated modeling and functional validation of candidate tumor suppressor genes in small cell lung cancer. Proc Natl Acad Sci USA, 2020, 117(1): 513-521.
[6] Xie JK, Ge WK, Li N, et al. Efficient base editing for multiple genes and loci in pigs using base editors. Nat Commun, 2019, 10: 2852.
[7] Crowther MD, Dolton G, Legut M, et al. Genome-wide CRISPR-Cas9 screening reveals ubiquitous T cell cancer targeting via the monomorphic MHC class Ⅰ-related protein MR1. Nat Immunol, 2020, 21: 178-185.
[8] He XY, Ren XH, Peng Y, et al. Aptamer/ peptide-functionalized genome-editing system for effective immune restoration through reversal of PD-L1-mediated cancer immunosuppression. Adv Mater, 2020, 32(17): 2000208.
[9] Humbert O, Radtke S, Samuelson C, et al. Therapeutically relevant engraftment of a CRISPR-Cas9-edited HSC-enriched population with HbF reactivation in nonhuman primates. Sci Transl Med, 2019, 11(503): eaaw7368.
[10] Dekkers JF, Whittle JR, Vaillant F, et al. Modeling breast cancer using CRISPR‐Cas9–mediated engineering of human breast organoids. J Natl Cancer Inst. 2020;112(5):540‐544. doi:10.1093/jnci/djz196
[11] Ma H, LC Tu, A Naseri, et al. (2016). Multiplexed labeling of genomic loci with dCas9 and engineered sgRNAs using CRISPRainbow. Nat Biotechnol. 2016 May; 34(5): 528–530.
[12] 史梦然, 沈宗毅, 张楠, 王璐瑶, 喻长远, 杨昭. CRISPR/Cas9 系统在疾病研究和治疗中的应用. 生物工程学报, 2021,37(4): 1205–1228.
喜欢我们的内容,欢迎关注@药明康德市场部!或者点赞、评论、分享给其他读者吧! |
|
 /3
/3 