金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
境内的一、二类医疗器械在当地的省或市食品药品监督局办理,三类的到国家食品药品监督局办理;境外的医疗器械不管是一类、二类、三类都要到北京国家食品药品监督局办理。
以安徽省第二类医疗器械产品首次注册为例:
第一、受理条件
1.申报产品已确定为第二类医疗器械(不包含体外诊断试剂),注册申请人为安徽省省内企业; 2.按照有关规定取得企业营业执照和组织机构代码证; 3.已具备拟注册产品的生产能力;已按照《医疗器械生产质量管理规范》的要求建立医疗器械生产质量管理体系;4.申请人应当编制申请注册医疗器械的产品技术要求。应当按照产品技术要求进行检验,并提交检验报告。5.已完成对临床评价资料的汇总和分析; 5.办理医疗器械注册申请的人员具有相应的专业知识,熟悉医疗器械注册管理的法规、规章和有关的技术要求。
第二、申请材料:
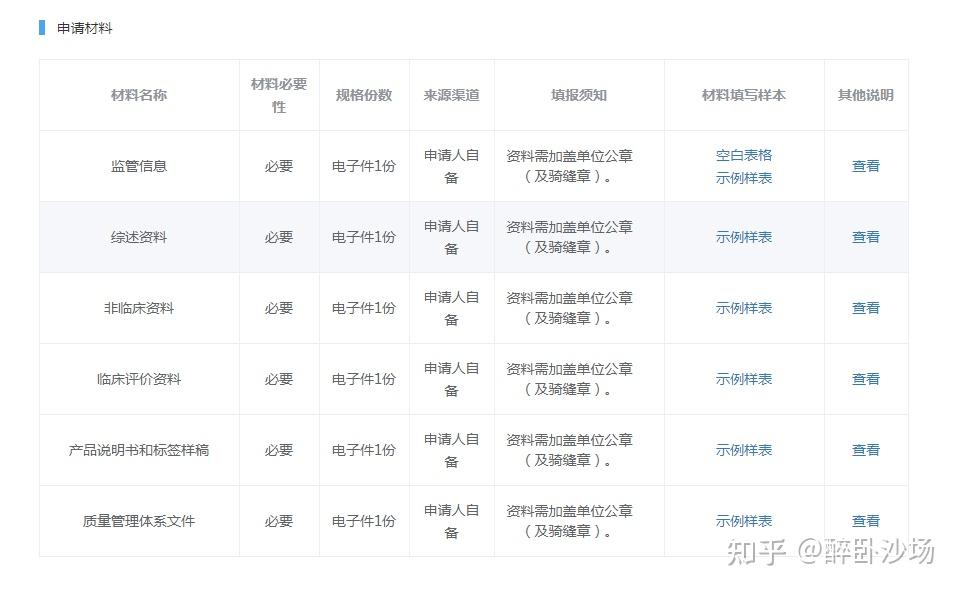
第三、办理流程:
申请人登录安徽政务服务网(https://www.ahzwfw.gov.cn),找到相应申请事项,提交申报信息并上传电子申报材料。
1.受理:窗口工作人员审查申请材料,对申请材料齐全且符合法定形式的,出具《受理通知书》;申请材料不齐全或不符合法定形式的,一次性告知需要补正的全部内容,并出具《补齐补正通知书》。企业应按照财务通知及时缴纳相关费用。
2.审查:省局许可注册处审核申请材料内容,转省药品审评查验中心审评。根据审评报告结论提出综合评定意见。
3.决定:首席代表或分管局领导根据综合评定意见作出审批决定。符合要求的,出具《准予行政许可决定书》及证照、批件;不符合要求的,出具《不予行政许可决定书》。对不予许可的应说明理由,并告知申请人依法享有申请行政复议或提起行政诉讼的权利。
4.办结制证送达:根据申请人申请的送达方式,省药品监管局窗口送达《准予行政许可决定书》及证照、批件或《不予行政许可决定书》,并信息公开。 |
|
 /3
/3 