金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
今天我们所熟知的质谱法(MS)是由三位杰出人物,Wilhelm Wien、J.J. THOMSON和Francis Aston的开创性工作的技术进步的结果。如果要选择一个标志着质谱诞生的决定性文献,Thomson在1907年发表的「On rays of positive electricity」[1]的论文经常被考虑,然而还有许多其他值得关注的论文。
MS的历史本身就是一个引人入胜的故事,大家如果对此感兴趣,可以参考Griffiths[2]和Munzenberg[3]的文章,对这方面的知识有进一步的了解。
从早期开始,MS已经从重大的技术进步中获益。今天,MS在日常生活的许多不同方面发挥着作用。
当我们去看医生,抽出体液进行测试时,许多体液会被MS分析。构成我们所有电子设备基础的掺杂半导体使用MS作为质量控制过程的一部分。MS也大大加强了航空安全,我们在进入航站楼前的爆炸物检测,就是在MS的帮助下进行的,而且,MS也可以帮助发现我们食品供应中的毒素,这些应用几乎无穷无尽。
什么是质谱检测,它是如何工作的?
质谱是一种化学分析形式,用于测量样品中原子和/或分子的质荷比(m/z)。它还能够区分同一元素的不同同位素。根据质谱仪的类型,这些测量通常可以用来确定样品成分的确切分子量,并识别未知化合物。
有许多不同类型的质谱仪,但它们都有三个共同的特点(图1)。首先是一些可以使样品中的原子或分子被电离的手段。中性物种不能被质谱仪中使用的电场引导,因此有必要产生离子。有许多不同的方法可以实现这一点,它们被统称为离子源。
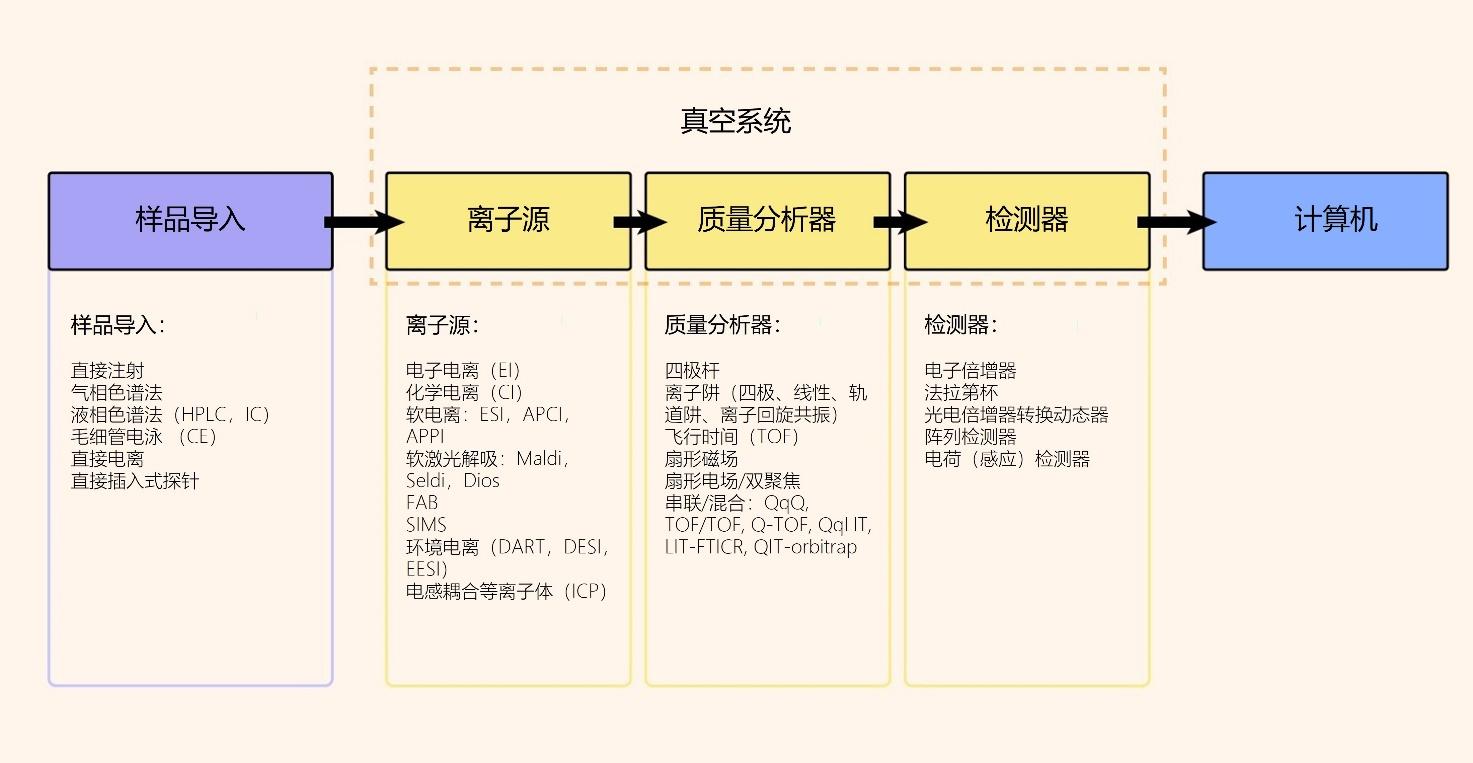
图1 | MS的主要步骤和每个步骤的常见选择概要
所有质谱仪的第二个组成部分是质量分析器本身。有几种不同的方法可以测量离子的m/z比率。飞行时间(ToF)、扇形磁场和四极质量分析器是最常见的,每一种都有其自身的优势和限制。
所有质谱仪系统共有的最后一个部件是检测或计算特定m/z值的离子数量的手段。这些设备被称为检测器,它们也有几种不同的形式,最常见的是电子倍增器、法拉第杯、阵列检测器和电荷(感应)检测器。同样,每一种都有其特定的优势和劣势[4,5]。
最后一个需要考虑的因素是如何将离子源与样品耦合,以便产生用于测量的离子,特别是考虑到所有的质谱仪都必须在真空下操作。
在某些情况下,样品也将被安置在真空下,在其他情况下,样品将在大气压力下(一般被称为环境质谱技术),有些可能在引入电离室之前加入一些其他形式的分离技术。下面的章节将更详细地介绍质谱仪的这三个常见组成部分。
离子源
电离对于任何质谱分析都是必不可少的,为此有许多适合不同样品类型和应用的方法。大体上,这些方法可以细分为气相方法、解吸方法和喷雾方法。以下是每种方法的概要。
气相方法
- 电子电离(EI):分析物分子必须处于气相状态,以便与加热的灯丝在真空中产生的高能电子进行有效的互动。EI可以被认为是一种相当苛刻的分子破碎和电离方法,最常用于样品相对挥发性和低分子量的情况[6]。
- 化学电离(CI):将浓度高于分析物的气体引入EI电离室。载气与电子的相互作用将产生几个分子离子,随后与过量的载气进一步反应,形成不同的分子离子。然后这些离子将与被分析物分子反应,通过几种不同的机制形成被分析物分子离子。CI是一种非常软的电离技术,不会导致广泛的碎片化[7]。
- 实时直接分析(DART):形成等离子体,产生离子、电子和激发态物种。激发态物种与液态、固态或气态样品的相互作用,然后负责分析物分子的电离。DART能够分析不同形状和尺寸的材料,无需事先准备样品,而且在环境条件下进行分析[8]。
- 感应式耦合等离子体(ICP):准备好的含有分析物的液体被气溶胶化,并利用等离子体转化为气相离子。ICP有能力电离几乎所有的元素。
解吸方法
- 基质辅助激光解吸电离(MALDI):由要检测的分子类型决定的「基质」被过量地添加到要分析的样品中。然后用激光照射样品,使分析物分子气化,几乎没有碎片或分解。带正电和负电的离子都可以产生。MALDI是主要的「软」电离方法之一,特别适用于分析大分子或易溶分子[9]。
- 快速原子轰击法(FAB):一束加速的电离原子被聚焦到要分析的样品上,喷出并电离目标分析物[10,11]。这是一种软电离技术,能够产生带正电和负电的离子。
- 热离子源:加热的Cs,产生正离子,是最常见的一次离子源,可以用静电离子光学器件聚焦,用于二次离子MS。
- 等离子体离子源:通常用于产生气态离子束,电子被发射到气体中,通常是纯氧,使其电离并产生等离子体。然后离子可以通过电荷过滤并加速成束。
- 液态金属离子源(LMIS):源是低熔点金属,通常是Ga,对其施加热量和电场在一个小的点源上产生离子。由LIMS产生的离子束的特点是最小的光斑尺寸和最高的亮度,在需要高空间分辨率的MS成像中特别有利。
喷雾方法
- 电喷雾离子化(ESI):带电液滴的雾状物通过溶剂蒸发缩小,直到气相离子被喷出。这种软电离技术适用于分析大分子和大分子[12,13]。
- 解吸电喷雾离子化(DESI):与ESI非常相似,只是在ESI源中形成的带电液滴被引导到在环境压力下的样品中。反射的液滴然后携带解吸和电离的样品[14]。
质量分析器
样品电离后,离子必须被分离,这发生在质量分析器中。常用的质量分析器包括:
- 飞行时间(ToF):根据离子通过已知长度的飞行管到达检测器的时间长短,根据它们的m/z比率进行分离。
- 四极杆:进入四极杆的离子在电势的作用下轨迹发生偏转,偏转的方式与它们的m/z值成正比。改变电位只允许特定m/z值的离子到达室端并被检测。
- 扇形磁场:扇形磁场根据离子的m/z比值将其分散在轨迹中,其方式类似于玻璃棱镜将光分散成不同的波长或颜色。
- 离子阱:工作原理与四极杆类似,但电极是环形的,通过将具有不稳定振荡的离子从系统中排放到检测器中而不是检测那些具有稳定振荡的离子来分离和检测离子。
- 轨道阱:从许多其他类型的质量分析器中借用了技术。两个电隔离的杯状外电极面对面,有一个纺锤形的中央电极,特定质量电荷比的离子围绕着它扩散成轨道环。电极的圆锥形将离子推向捕集器最宽的部分,然后外电极被用于电流检测。这是这里描述的唯一一种使用图像电流而不是一些检测装置来检测离子的方法。
- 串联质谱法(tandem MS):是指涉及一种以上的质谱仪的混合方法,以提高特异性和/或质量分辨能力。它们通常被称为MS/MS技术[15]。
将离子源与质量分析器配对使用
由于有这么多不同类型的离子源、电离机制和不同类型的质量分析器,有许多不同的排列组合系统,可以通过一些工程努力来建立。然而,有一些类型的离子源和质量分析器彼此之间是非常合适的,这些包括最常用的商业仪器。
例如,许多激光系统的脉冲性质非常适合ToF质量分析器,它需要一个脉冲离子源作为其质量鉴别的基础。本节将更详细地介绍一些常见的离子源和质量分析器的配对。
MALDI-TOF
如上所述,许多激光系统的脉冲性质和这种对ToF分析的要求使得这对电离机制和质量分析非常理想地相互适合。当激光在基质/样品点上发射时(在真空中保持),离子形成并加速进入ToF飞行管,时钟启动后,质量开始被测量。
该方法还能够通过步进扫描平台、在激光重复发射下连续扫描平台或通过扫描激光束来生成图像[16]。由此产生的图像可以提供大量的样品信息,如大型组织切片。
由于MALDI是一种软电离技术,分子信息得以保留,感兴趣的化合物不需要像荧光显微镜那样被标记来检测。因此它提供了一种「无标签」成像的方法。
ICP-MS
尽管最初使用的是四极杆质量分析器,但现在大多数ICP-MS系统都使用ToF质量分析器。这里最大的优势是,与那些使用四极杆的系统相比,整个质谱产生的速度更快,质量分辨率更高。一些专门的系统使用扇形磁场仪器,通常与用于高精度同位素比率测量的多收集器检测系统相配。
此外,通过与激光束耦合形成激光烧蚀(LA)-ICP-MS,该技术也可以适应于形成由烧蚀材料的质量分析产生的图像。由于这是一种破坏性的技术,而且材料只能分析一次,所以追溯挖掘和处理ToF数据的能力是一个很大的优势。在ToF成像中,整个质谱将被储存在所产生的图像的每个(x,y)像素位置,因此新的离子图像可以很容易地在分析后生成。
DART-MS
DART-MS也使用ToF质量分析器,原因如前所述。然而,由于它是一种环境压力技术,注意源(环境)到质谱仪(真空)的接口很重要。
在最初的设计中,分析物离子通过一对孔口被引向质量分析器,它们之间有轻微的电位差。两个孔口的排列是交错的,以捕获中性污染并保护高真空区域。离子通过一个中间的圆柱形电极被引导到第二个孔口,但中性分子以直线路径行进,因此被阻止进入质量分析器,并被真空泵清除。
二次离子质谱法(SIMS)
二次离子质谱(SIMS)技术中使用的电离方法是FAB的一个近亲。产生一束带正电或负电的离子,但不使用碰撞池将离子束转化为中性物质。这束离子被直接用来轰击样品的表面。最常用的离子是正电离子束的Cs+和O2+以及负电离子束的O-。Cs+和O离子是由前面描述的热电离和等离子体源形成的。
请注意,Cs和O都是反应性物种,而不是惰性的。在SIMS中,这是故意的,因为两者都将被植入样品中,并影响其化学和物理特性。但它们影响这些特性的方式是,如果使用Cs+,或者使用O2+或O-的正离子,将导致更有效地产生负离子。
Cs和O光束在直流源中最常被观察到,所使用的高加速电压导致样品中的分子严重破碎,从而在分析过程中没有分子信息被保留。它们的使用将被视为一种硬电离方法。
为了规避这个问题,小型和大型团簇离子(Au3+,Bi3+,C60+,Ar2000+)的脉冲源也已经被开发出来,这将被认为是更柔和的电离方法,并在产生的质谱中提供更多的分子细节。这些源通常以脉冲模式操作,进一步减少对样品表面的损害。
ToF、扇形磁场和四极杆质谱仪都是SIMS仪器中常用的仪器。
检测器
所有质谱系统的一个关键因素是用于将质量分离离子的电流转换为可测量的信号的检测器的类型。根据包括动态范围、空间信息保留、噪声和对质量分析器的适用性等因素,使用不同类型的检测器。
常用的检测器包括:
- 电子倍增器(EM):离散金属板的串行连接,将离子电流放大约108倍,变成可测量的电子电流。
- 法拉第杯(FC):撞击集电极的离子导致电子从地面流过电阻,由此产生的电阻上的电位降被放大。
- 光电倍增管转换二极管:离子最初撞击到一个二极管,导致电子发射。产生的电子然后撞击荧光屏,而荧光屏又释放出光子。然后光子进入倍增器,在那里以级联的方式进行放大--很像EM。
- 阵列检测器(包括同时测量不同m/z的几个离子的检测器和对位置敏感的离子检测的检测器):涵盖了广泛的检测器类型和系统,可以结合多种检测技术[1]。
质谱仪与其他技术结合
气体和液体分离技术经常与质谱结合使用,以提高灵敏度和方便解释。液相色谱法(LC)、气相色谱法(GC)、毛细管电泳法(CE)和凝胶电泳法(GE)是常见例子。这些方法的组合在与ICP-MS和DART-MS串联时尤其常见。
气相色谱质谱法(GC-MS)
气相色谱是一种分析/分离技术,将复杂的化合物混合物注入色谱柱,根据其相对沸点和对色谱柱的亲和力进行分离。
气相色谱法使用的高温使其不适合高分子量的化合物(如蛋白质),因为热使它们变性。它很适合用于石油化工、环境监测和修复以及工业化学领域。样品可以是固体、液体或气态。
分离后,化合物可以用质谱技术进行分析,如ICP-MS,进行鉴定,或用EI或CI进行电离,并在ToF质量分析器中进行分析[17]。最近有文献已经对GC-MS领域的进展进行了回顾[17,18]。
液相色谱质谱法(LC-MS)
液相色谱法与气相色谱法相似,只是样品现在是在液相中。样品被溶解在溶剂中,并被注入色谱柱中,色谱柱由被溶解的化合物(流动相)和固体(固定相)组成。
样品成分和色谱柱的固定相之间的相对亲和力导致了样品成分的分离,然后可以通过质谱检测。由于流出物在液相中,这种分离技术很适合与ICP-MS和ESI-MS方法联用,但也可以与离子阱和Orbitrap质谱仪联用。Pitt[19]和最近的Seger[20]对临床生物化学的原理和应用进行了回顾,而Korfmacher[21]对药物发现中的应用进行了回顾。
交联质谱法(XL-MS)
了解多蛋白复合物的结构和组织对于理解细胞功能至关重要。化学交联结合质谱分析(XL-MS)是一种对结构生物学技术的补充,如低温电子显微镜(cryo-EM)和X射线晶体学,但提供的结构信息分辨率较低。
在XL-MS中,蛋白质或蛋白质复合物用交联试剂处理,在蛋白质的特定功能团之间引入共价联系。然后用一种分解蛋白质的酶消化交联的蛋白质,用LC-MS方法分析得到的混合物,以识别交联的肽并确定其序列。交联的位置提供了关于所研究系统的结构信息。
然而,解释是复杂的,因为以这种方式制备的样品含有比非交联蛋白的消化物多得多的独特化学物种。潜在的交联肽的数量随着序列长度的增加而呈四倍增长。尽管如此,XL-MS可以成为一个有用的工具,帮助开发蛋白质-蛋白质相互作用的结构模型[22]。
氢交换质谱法(HX-MS)
氢交换质谱(HX-MS)的目的与XL-MS相似--研究多蛋白复合物,特别是蛋白质结构和动力学。
HX-MS的优点包括:它可以探测溶液中的蛋白质结构,因此不需要结晶;它只需要极少量的样品(500~1000 pmol);它适合于研究难以纯化的蛋白质;它可以揭示结构和动力学随时间的变化。
HX-MS利用了一种化学反应,即蛋白质中的某些H原子与溶液中的H原子不断交换。如果用重水(D2O)代替水基H2O溶剂,那么这个交换过程可以被跟踪。特别是,与氨基酸骨架N原子结合的H(也被称为骨架酰胺H)对于探测蛋白质结构非常有用。
一旦H与D的交换完成,样品就可以通过质谱分析来提供关于蛋白质结构随小分子结合而变化的信息、蛋白质折叠的信息或关于没有结晶或不适合其他结构生物学方法的蛋白质的结构信息[23,24]。
基质辅助激光解吸/电离质谱成像(MALDI-MSI)
MALDI-TOF不仅是一种优秀的质谱分析方法,它还能够通过步进扫描平台、在激光反复发射下连续扫描平台或扫描激光束来生成图像[25]。这种技术被称为基质辅助激光解吸/电离质谱成像(MALDI-MSI)。
由此产生的图像可以提供丰富的信息,例如,大的组织切片,空间分辨率在50-200毫米之间。由于MALDI是一种软电离技术,分子信息得以保留,因此感兴趣的化合物不需要像荧光显微镜那样被标记来检测。因此,它提供了一种「无标签」成像的手段。
如何解读质谱数据
一个典型的质谱在图2中表示。在这种情况下,戊烷(C5H12)的质谱和结构显示,由CH3和CH2基团组成。
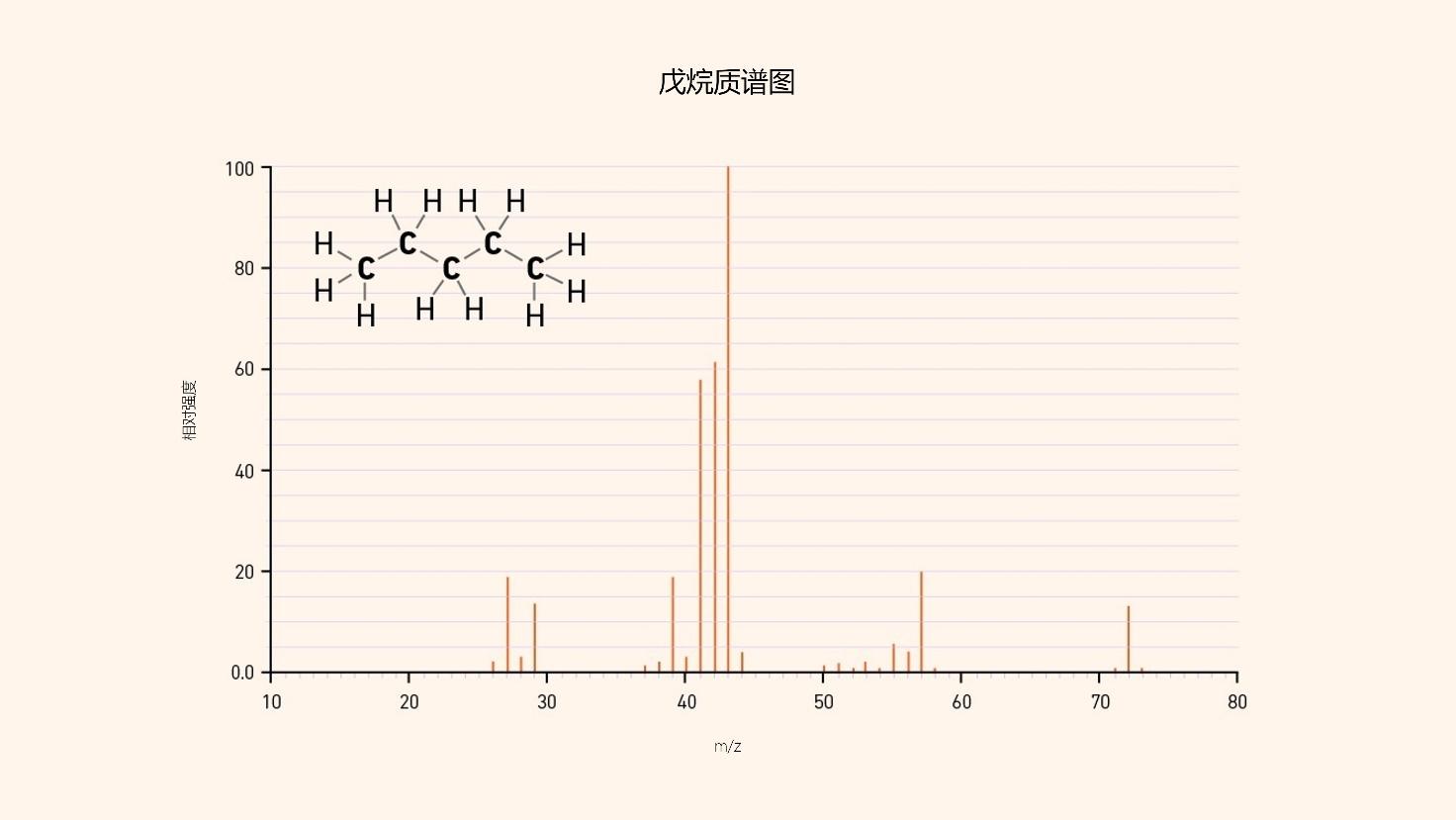
图2 | 戊烷的质谱
纵轴代表在质谱仪中检测到的离子的相对强度或信号,而横轴代表它们的m/z比率(质量除以电荷数)。因此,最强的峰将具有100的相对强度。
戊烷的化学式为C5H12。因此,该分子的近似质量是((12 × 5)+(1 × 12)),或72 amu。注意在质谱上,在m/z = 72 amu处观察到一个相对强度为10%的峰。这就是分子峰。整个分子在源中被电离成一个实体,没有任何碎片。但是其他更强的峰呢?这些是戊烷电离过程中碎片的结果。
如何解释观察到的下一个最重的质量(在m/z = 57 amu,相对强度为20%)?通过计算,我们可以提出它可能是C4H9,这将表明其中一个CH3基团在电离过程中被破碎掉了,留下了C4H9碎片分子离子。同样,在m/z = 43 amu处观察到的最强信号可以被解释为C3H7,这意味着一个C2H5分子被破碎了。
这相当于CH3和CH2中的一个基团。请注意,在m/z = 41和42处也有强的线条。这些是由于在破碎过程中从C3H7分子离子中剥离了额外的Hs。这构成了解释质谱的基础,不仅需要了解化学知识,还需要了解母分子的结构。
显然,对于现有的所有有机材料来说,这可能是一项艰巨的任务。幸运的是,有一些数据库可以显示许多此类物质的质谱,以帮助解释。
还有一个更复杂的因素,在元素或小分子的质谱中更经常观察到。这是来自每个元素的不同同位素。在戊烷的例子中,我们假设碳的质量为12 amu。这并不严格有效,因为碳有两种稳定的同位素:一种质量为12,另一种质量为13(该原子含有一个额外的中子)。这两种同位素的自然丰度约为99%的12C和1%的13C。
因此,如果使用硬电离技术并观察这一区域的质谱,就会发现在m/z = 12和13处都有一个峰值,其中12处的峰值大约是m/z = 13处峰值的100倍。请注意,m/z = 13处的峰值也很容易是由12C1H引起的,因此质谱仪的质量分辨率的重要性就很明显。
然而,同一元素的多种同位素也是有用的。这是前面描述的HX-MS的基础,也是多同位素成像质谱的基础[26,27],在这里,稳定的同位素被有意添加到化合物中,然后从样品中得到同位素比率图像。那些同位素比率大于自然丰度的区域表示样品中化合物被加入的区域,两个常用的稳定同位素是13C和15N。
诊断科学编辑团队收集、整理和编撰,如需更多资讯,请关注公众号诊断科学(DiagnosticsScience)。
参考文献
- J.J. Thomson, Dublin Philos Mag J Sci. 13, 561-575. (1907)
- J. Griffiths, Anal Chem. 80, 5678-5683. (2008)
- G. Münzenberg, Int J Mass Spectrom. 349-350, 9-18. (2013)
- D.W. Koppenaal, et al. Anal Chem. 77, 418 A-427 A. (2005)
- R. John, The Encyclopedia of Mass Spectrometry. 183-188. (2016)
- J.T. Watson, Encyclopedia of Analytical Chemistry. (2000)
- B. Munson, Encyclopedia of Analytical Chemistry. (2000)
- R.B. Cody, et al. Anal Chem. 77, 2297-2302. (2005)
- M. Karas, et al. Anal Chem. 57, 2935-2939. (1985)
- K.L. Rinehart, Science. 218, 254-260. (1982)
- M. Barber, et al. Nature. 293, 270-275. (1981)
- C.S. Ho, et al. Clin Biochem Rev. 24, 3-12. (2003)
- S. Banerjee, S. Mazumdar, Int J Anal Chem. 2012, 1-40. (2012)
- Z. Takáts, et al. J Mass Spectrom. 40, 1261-1275. (2005)
- G.L. Glish, D.J. Burinsky, J Am Soc Mass Spectrom. 19, 161-172. (2008)
- R.M. Caprioli, et al. Anal Chem. 69, 4751-4760. (1997)
- I. .pánik, A. Machyňáková, J Sep Sci. 41, 163-179. (2018)
- J.W. Honour, Methods Mol Biol. 53-74. (2006)
- J.J. Pitt, Clin Biochem Rev. 30, 19-34. (2009)
- C. Seger, L. Salzmann, Clin Biochem. 82, 2-11. (2020)
- W.A. Korfmacher, Drug Discov Today. 10, 1357-1367. (2005)
- E.D. Merkley, et al. J Struct Funct Genomics. 14, 77-90. (2013)
- S.R. Marcsisin, J.R. Engen, Anal Bioanal Chem. 397, 967-972. (2010)
- L. Mayne, Methods Enzymol. 335-356. (2016)
- J.H. Barnes, G.M. Hieftje, Int J Mass Spectrom. 238, 33-46. (2004)
- G. McMahon, et al. Appl Surf Sci. 252. (2006)
- C. Lechene, et al. J Biol. 5. (2006)
***
原文地址:https://zhuanlan.zhihu.com/p/484183255 |
|
 /3
/3 