金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
免疫检查点抑制剂彻底改变了多种肿瘤的临床治疗模式。然而,只有少数患者对免疫检查点抑制剂有响应,其中的耐药机制研究激起了广泛的兴趣。一种解释是各种致癌(oncogenic)通路以及肿瘤细胞存活所需的应激响应通路(通常被称为“non-oncogene addiction”)不仅赋予恶性细胞存活和/或增殖优势,还建立免疫学上“cold”肿瘤微环境(TME)来支持肿瘤进展。因此,靶向“oncogene”和“non-oncogene addiction”有望激活TME并提高ICIs的响应。
免疫检查点抑制剂的出现,尤其是抑制T细胞共抑制信号的CTLA4和PD1抑制剂,显著改善了实体瘤患者的临床结局,包括黑素瘤和肺癌。然而,并非所有实体瘤都对ICI免疫疗法敏感,只有一小部分ICIs敏感的肿瘤患者把ICIs作为独立治疗药物。这些观察结果激起了激烈的研究浪潮,旨在阐明ICIs临床耐药的分子和细胞机制,一是鉴定可以预测响应的生物标志物,二是开发安全的联用组合以增加疗效。
肿瘤细胞对ICIs重新激活肿瘤免疫产生耐药的常见机制是建立了免疫学上的“cold”肿瘤微环境——免疫效应细胞浸润减少,如CD8+细胞毒性T细胞和成熟的DC细胞;免疫抑制性细胞增加,如CD4+CD25+FOXP3+调节性T细胞(Treg细胞)和某些髓系单核细胞。因此,已经有相当大的努力致力于开发能激活TME的策略,以便免疫效应细胞充分浸润,从而恢复对ICIs的临床敏感性(Nat Rev Clin Oncol. 2022;19(1):37-50)。
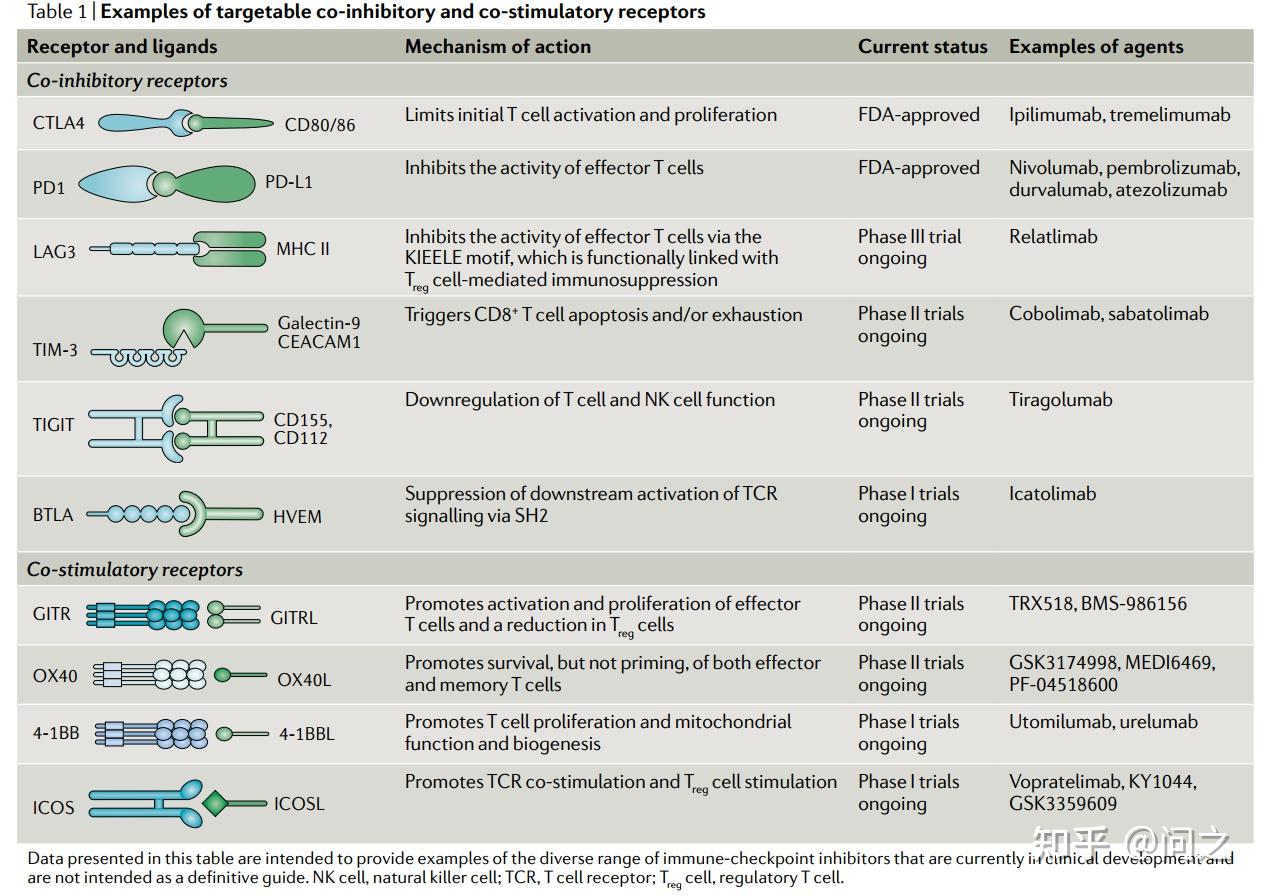
靶向免疫调节通路的免疫治疗策略(Nat Rev Clin Oncol. 2022;19(1):37-50)
除了直接抑制或耗尽免疫抑制性淋巴细胞和髓系细胞外,传统的化疗和放疗已经作为ICIs的潜在组合在临床试验中,至少某些患者的临床数据支持这些方案的有效性。靶向抗癌药物也引起了相当大的关注,这些药物被开发出来抑制肿瘤细胞特有的分子改变,与化疗和放疗相比,对恶性细胞的特异性更强,因而毒性有限,迅速成为多种血液瘤和实体瘤临床管理的中流砥柱。
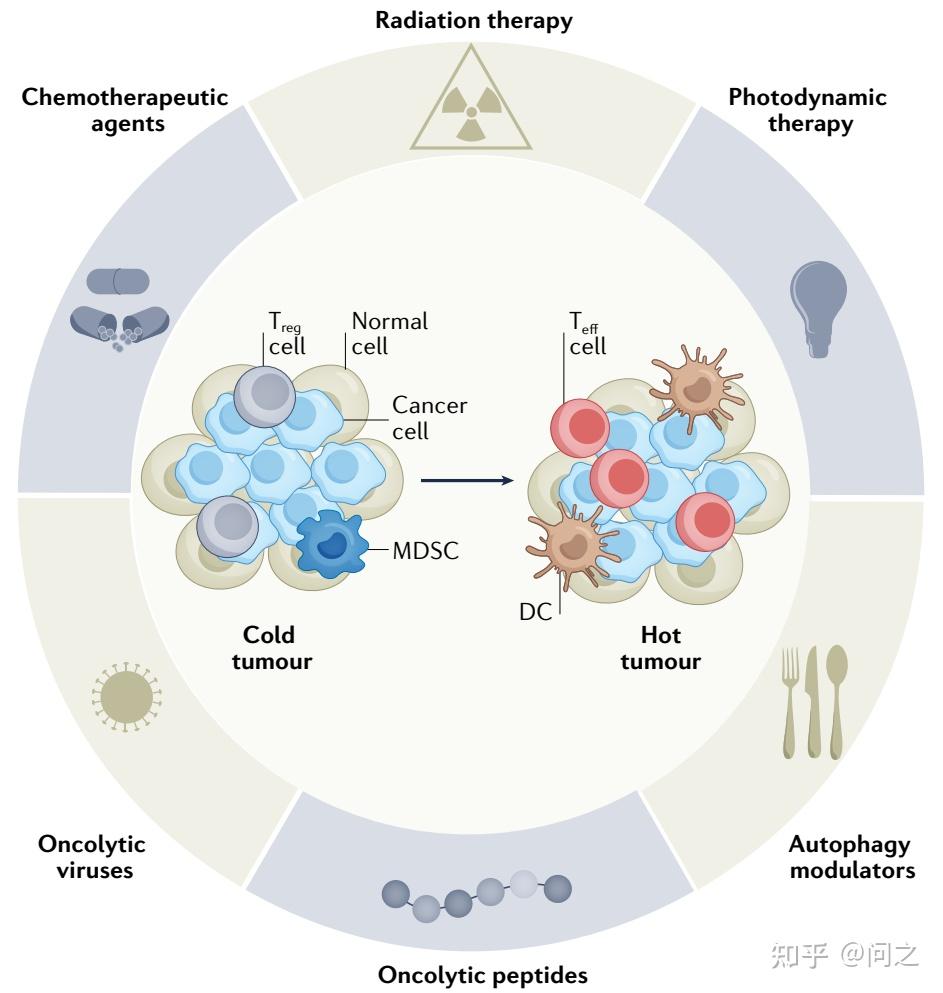
激发TME的替代方法
两种概念性截然不同的原则确立了靶向抗癌药物开发的理论基础:“oncogene addiction”和“non-oncogene addiction”。一方面,“oncogene addiction”是指遗传或表观遗传病变驱动肿瘤发生,由于它是肿瘤持续进展所必需的,因而是可行的治疗靶标。最具代表性的就是HER2靶向治疗。另一方面,“non-oncogene addiction”是指恶性转化过程中伴随着的细胞应激通路的过度激活,即本身不能驱动肿瘤发生,但仍然是肿瘤进展所必需的。比如,DNA损伤修复相关的BRCA1突变肿瘤其DNA同源重组修复存在缺陷,因此对PARP抑制剂高度敏感。
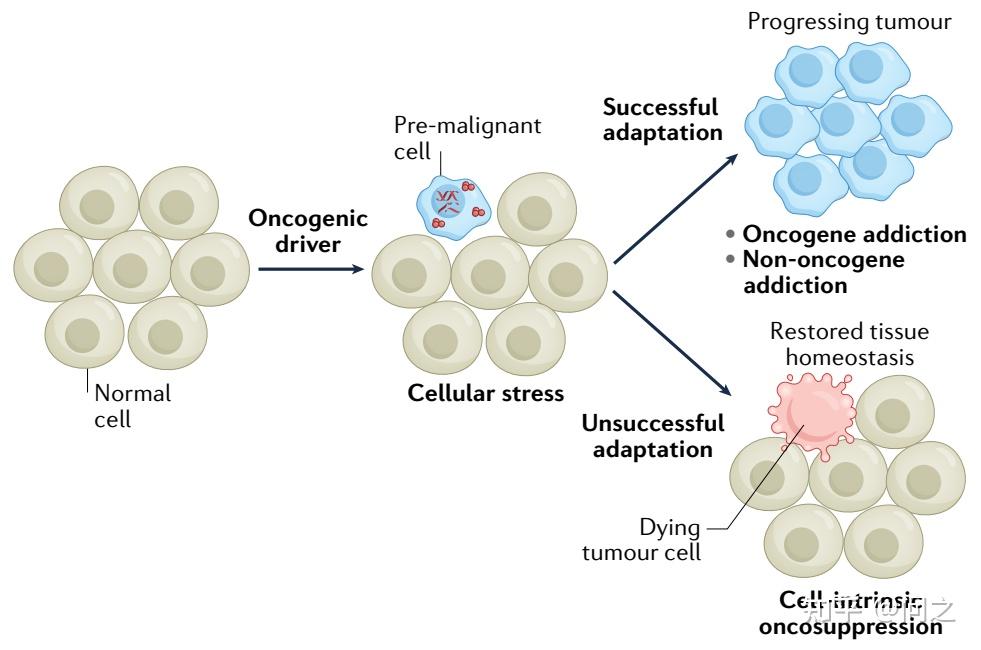
“oncogene addiction”和“non-oncogene addiction”
重要的是,大量证据表明,“oncogene addiction”和“non-oncogene addiction”的信号转导不仅给肿瘤细胞提供生存和增殖优势,而且在建立免疫抑制TME中发挥关键作用。按照这一概念,目前已经获批的或在晚期临床试验的各种靶向药物可以通过依赖于肿瘤自身或微环境组分强有力地激活TME并增强ICIs的响应。
2022年3月15日,美国威尔康奈尔医学院的Lorenzo Galluzzi等人在《Nature Reviews Drug Discovery》发表题为“Targeting oncogene and non-oncogene addiction to inflame the tumour microenvironment”的综述,重点讨论了靶向“oncogene addiction”和“non-oncogene addiction”的临床相关策略将“cold”、对ICI耐药的实体瘤转变为对ICI有较强敏感性的“hot”肿瘤,特别强调了剂量和治疗方案的影响。

Nat Rev Drug Discov. 2022;10.1038/s41573-022-00415-5
01 Oncogene addiction
靶向特定致癌基因或其主要信号转导已经是临床治疗多种实体瘤非常成功的方法。越来越多的证据表明,临床应用的各种此类抗癌药物包括HER2、EGFR、KRAS、BRAF和PI3K抑制剂,也具有强大的免疫刺激效应,因此代表了一种激活TME的强有力方法。
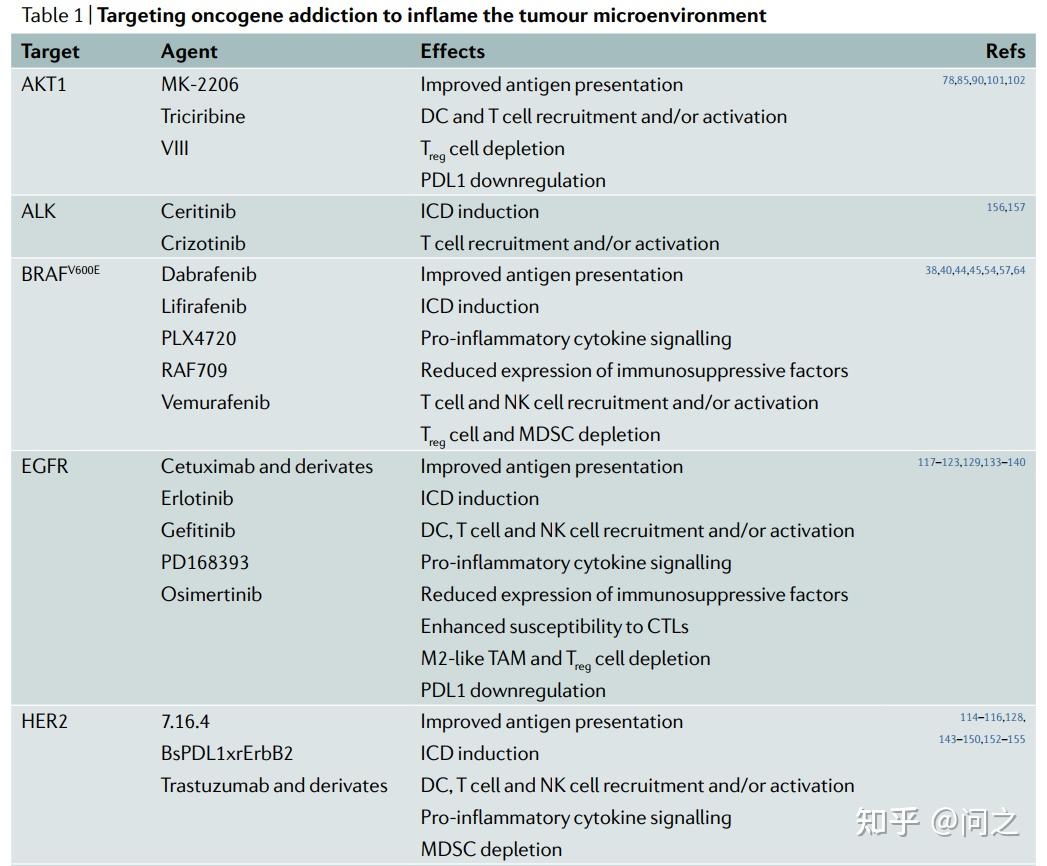
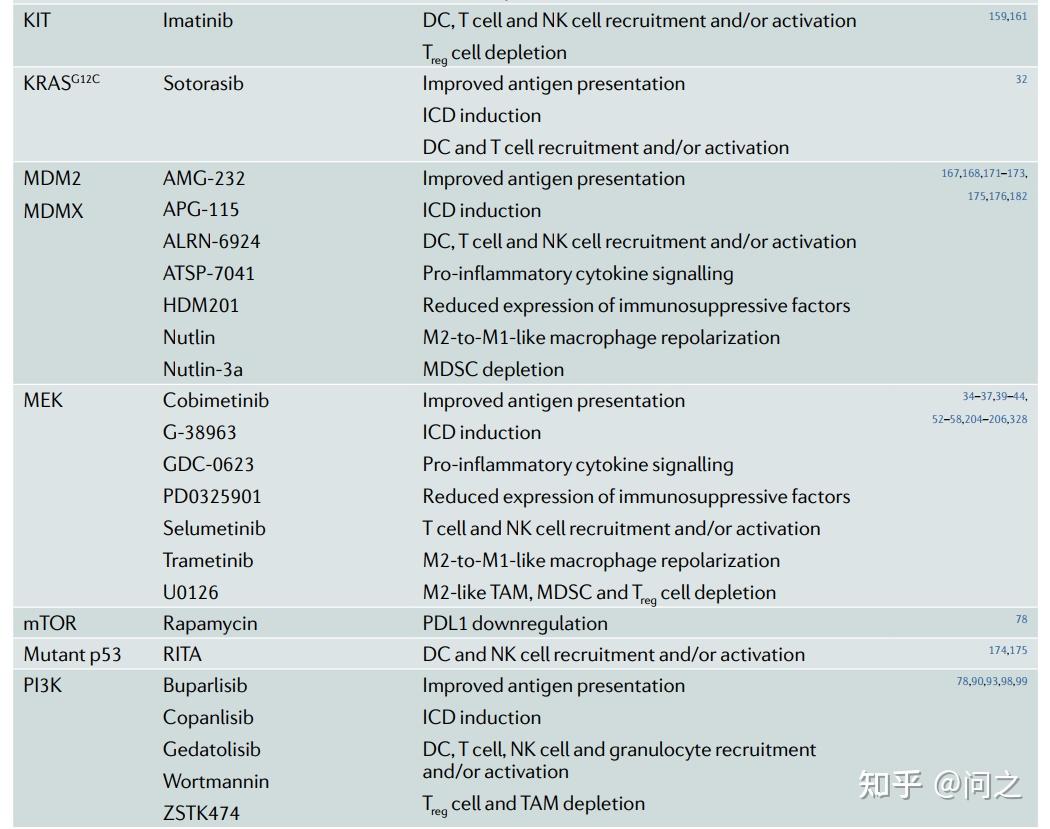
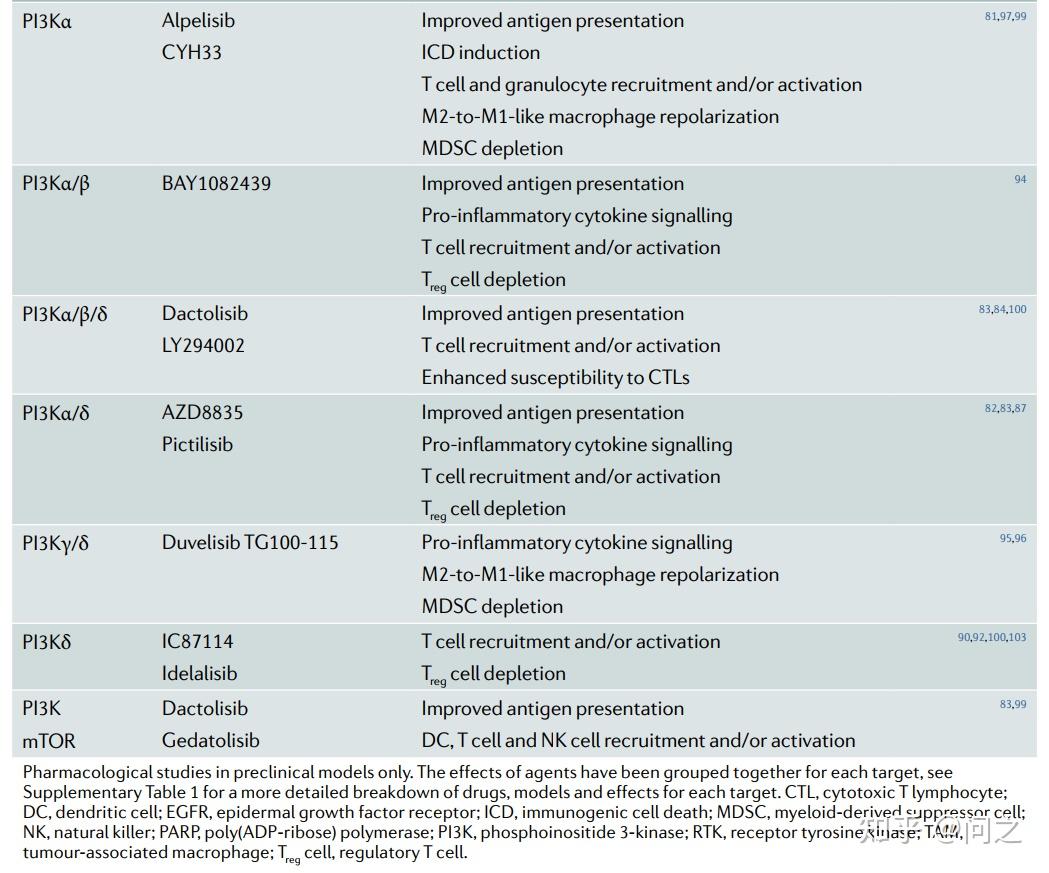
靶向“oncogene addiction”激活TME
02 Non-oncogene addiction
目前在临床或临床后期研究中的一些抗癌药物并不直接靶向致癌基因突变,而是抑制伴随肿瘤发生出现的应激反应通路,这些通路是肿瘤进展所必需的,但本身不驱动肿瘤发生。这些通路可能是与肿瘤发生相关的细胞内改变(如BRCA1或 BRCA2突变的肿瘤依赖于PARP)或环境特征(如缺氧肿瘤依赖于VEGFA信号)引起的。不管这种区别如何,各种靶向“non-oncogene addiction”的抗癌药物也会产生强烈的免疫刺激效应,因此可以用来激活TME。
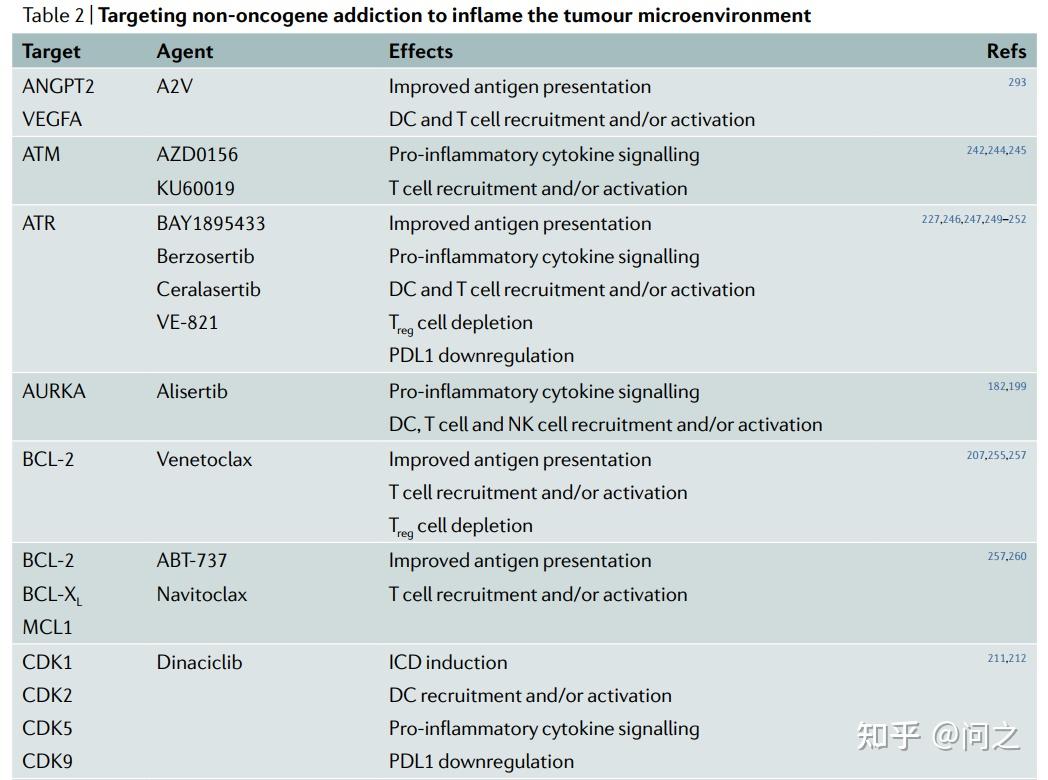
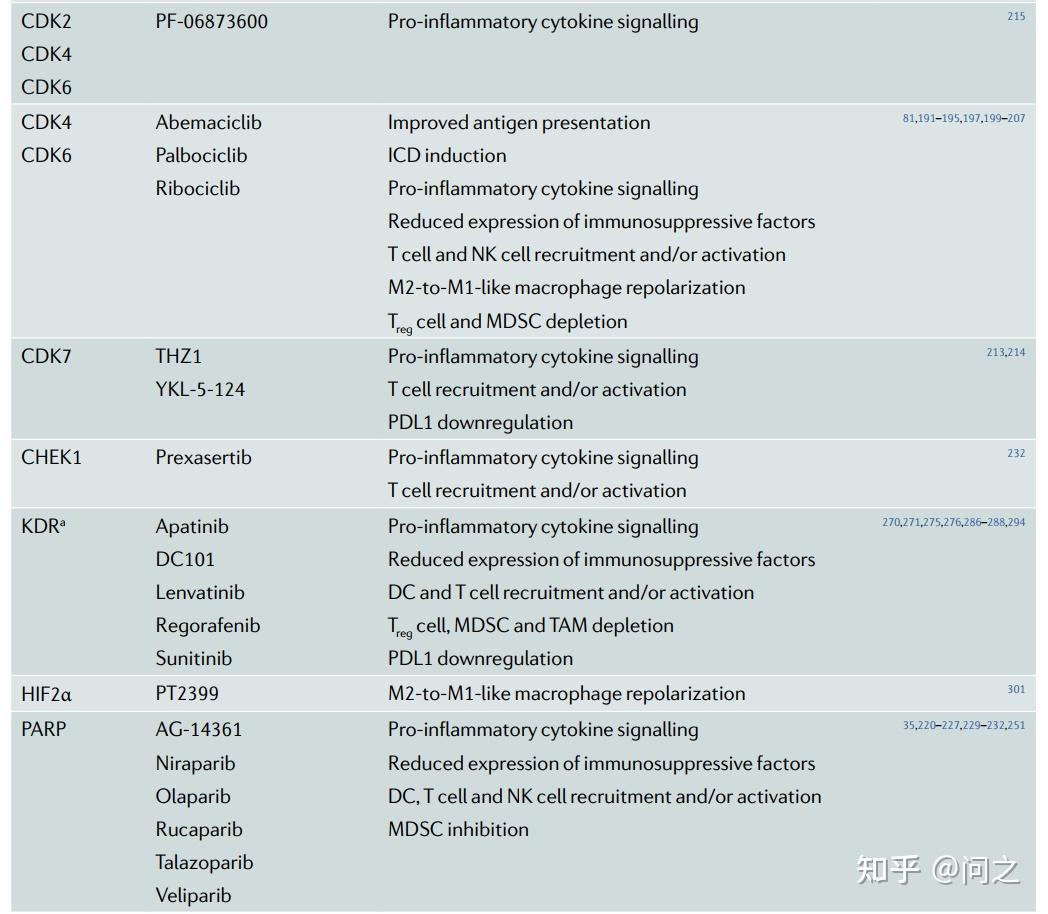
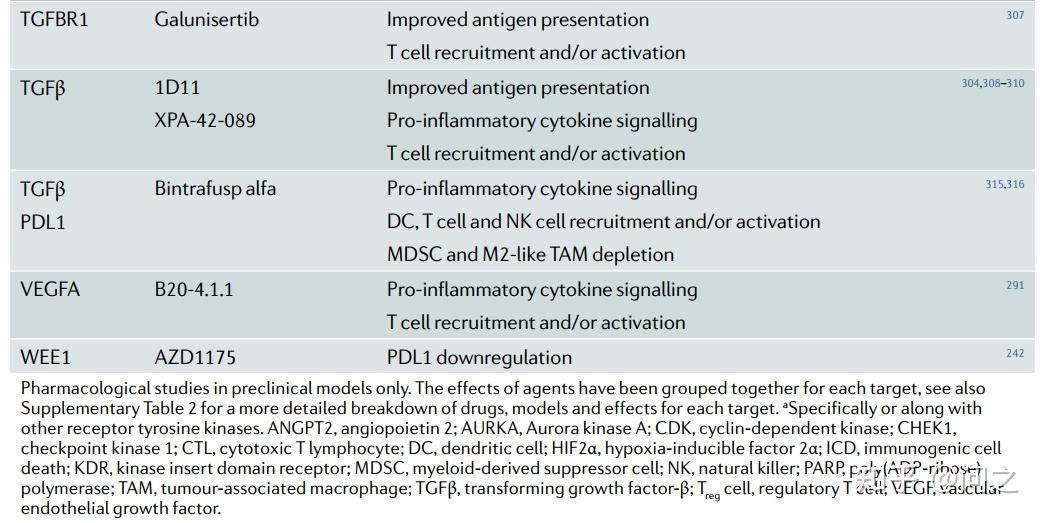
靶向“non-oncogene addiction”激活TME
03 优化策略以激活TME
尽管大量的文献支持靶向“oncogene addiction”和“non-oncogene addiction”可以激活TME从而提高ICI的敏感性,但是,这种治疗范式尚未用于癌症患者的常规治疗,因为其临床前和临床研究才刚刚开始。通过阻断致癌驱动基因以及癌细胞存活所需的非致癌应激反应通路以提高ICIs的临床响应应当考虑以下几点:
1. 分子特异性。靶向“oncogene addiction”和“non-oncogene addiction”的药物之所以能够有效地激活TME,是因为它们与TME中的肿瘤和非肿瘤成分的相互作用。这不一定是“on-target”效应,而且可能涉及不同的分子。此外,还可能引发代偿性和/或免疫抑制机制限制治疗效果。然而,在临床中这些通路可能会提供额外的可治疗的靶标以增加响应率或延长反应时间。比如,CDK4/6抑制剂激活TME的同时,促进PDL1上调(PD1或PDL1抑制剂)、细胞衰老(venetoclax或Navitoclax)和PI3K-mTOR信号激活(alpelisib或其他PI3K/mTOR抑制剂)。因此,有必要阐明靶向抗癌药物引发免疫刺激的精确分子机制,并精确解析这些药物引起的补偿性和免疫抑制机制。
2. 联合传统治疗手段。化疗和放疗不仅会激活TME,还会引起各种细胞保护和免疫抑制通路导致耐药,此部分内容可以参考相关文献。

Nat Rev Clin Oncol. 2020;17(12):725-741.

Nat Immunol. 2020;21(2):120-134.
3. 优化临床前研究。尽管已经有大量的临床前数据,但在临床实际中通过靶向“oncogene addiction”和“non-oncogene addiction”以提高ICI的敏感性还很有限。相信随着时间的推移该领域的研究会愈发成熟,我们也应该考虑如何优化临床前研究,包括确定合适的模型和治疗方案,以及能提高患者分级和预测临床结局的生物标志物。综述作者重点讨论了给药顺序和剂量方案的影响。
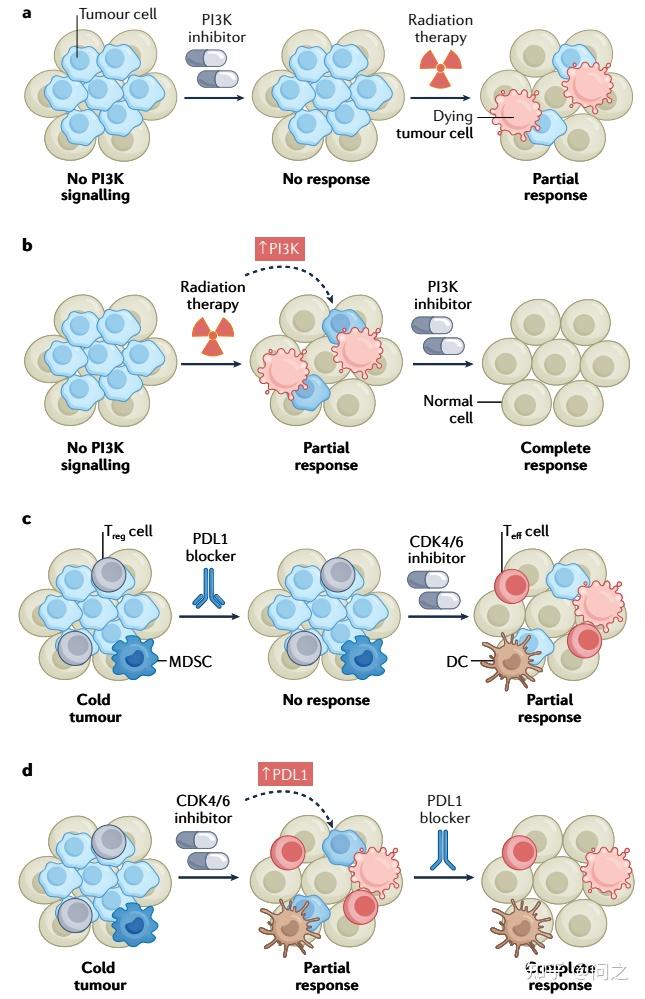
联用方案治疗顺序的重要性
目前,有少量III期研究正在探究“oncogene”和“non-oncogene”靶向药物联合ICIs的临床疗效。
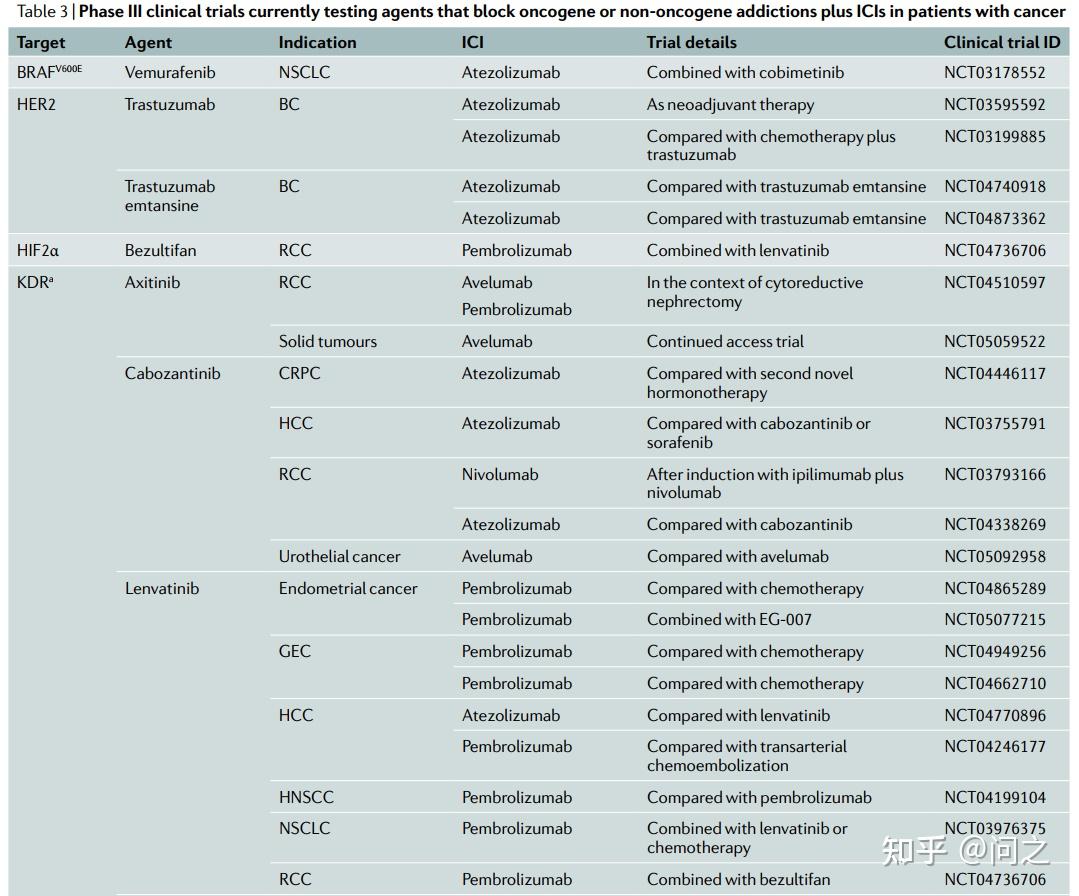
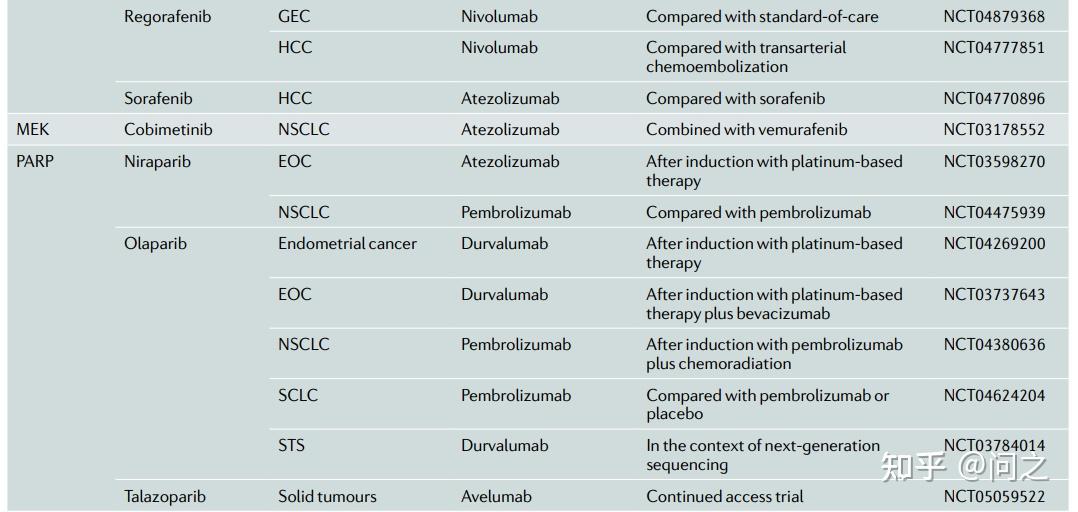
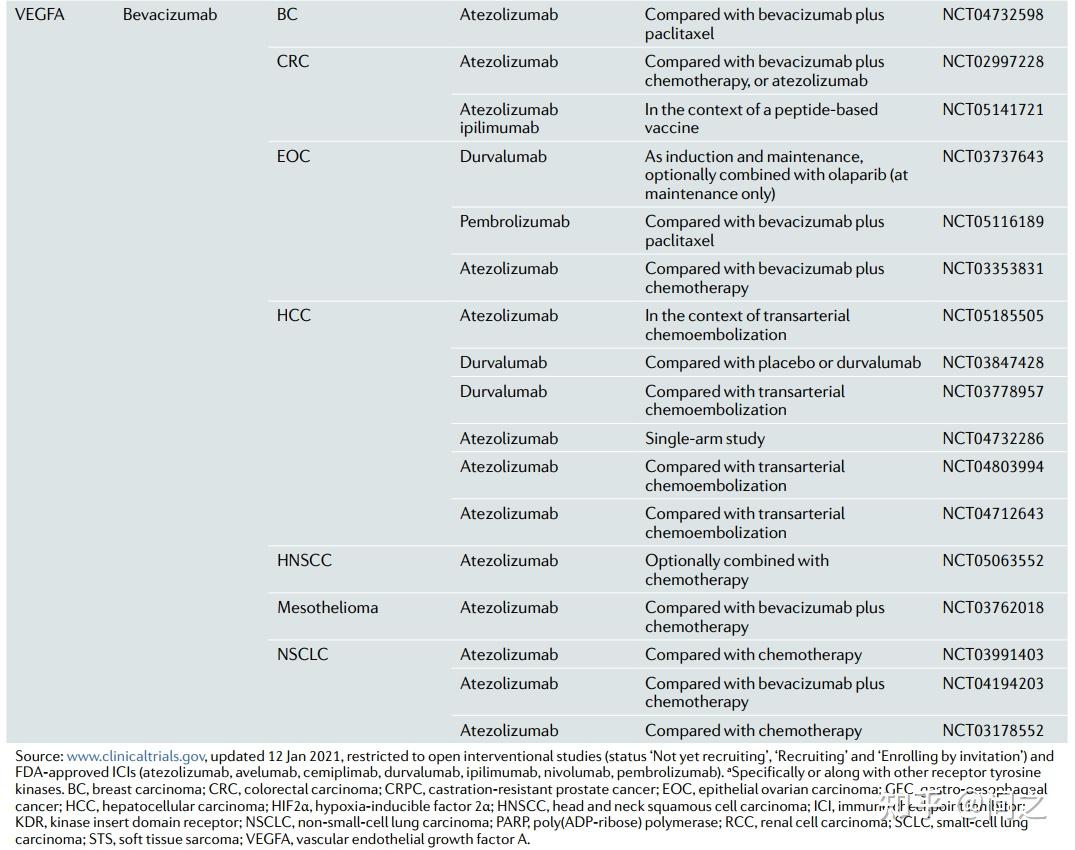
III期临床试验在研的靶向药物和ICIs组合
深入研究靶向药物激活TME的分子和细胞机制迫在眉睫,与此同时,有几个问题也需要解答:
1. 哪些生物标志物可以预测靶向药物的免疫激活作用?
2. 靶向药物和ICIs联用,获得性耐药机制又是如何?
3. 联用可能出现哪些副作用?
参考文献
1. Petroni G, Buqué A, Coussens LM, Galluzzi L. Targeting oncogene and non-oncogene addiction to inflame the tumour microenvironment. Nat Rev Drug Discov. 2022;10.1038/s41573-022-00415-5.
2. Kraehenbuehl L, Weng CH, Eghbali S, Wolchok JD, Merghoub T. Enhancing immunotherapy in cancer by targeting emerging immunomodulatory pathways. Nat Rev Clin Oncol. 2022;19(1):37-50. doi:10.1038/s41571-021-00552-7
3. Rodriguez-Ruiz ME, Vitale I, Harrington KJ, Melero I, Galluzzi L. Immunological impact of cell death signaling driven by radiation on the tumor microenvironment. Nat Immunol. 2020;21(2):120-134. doi:10.1038/s41590-019-0561-4
4. Galluzzi L, Humeau J, Buqué A, Zitvogel L, Kroemer G. Immunostimulation with chemotherapy in the era of immune checkpoint inhibitors. Nat Rev Clin Oncol. 2020;17(12):725-741. doi:10.1038/s41571-020-0413-z
5. Petroni G, Cantley LC, Santambrogio L, Formenti SC, Galluzzi L. Radiotherapy as a tool to elicit clinically actionable signalling pathways in cancer. Nat Rev Clin Oncol. 2022;19(2):114-131. doi:10.1038/s41571-021-00579-w |
|
 /3
/3 