金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
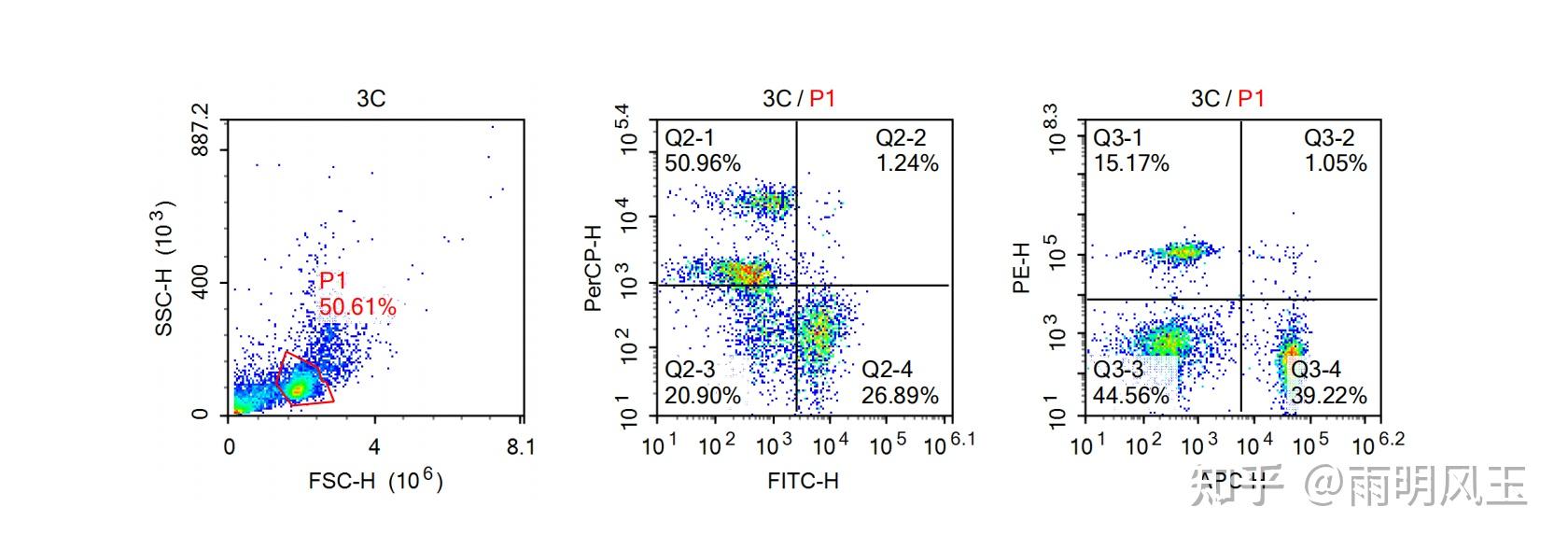
对照组结果:由左至右依次为图一、图二、图三。①图一:横坐标表示细胞大小,纵坐标表示颗粒度,根据颗粒度及细胞大小,得出最左下角为细胞碎片,用红线框定的为活细胞,这块区域为淋巴细胞。占样品量的50.61%,分析红圈中框定的细胞,得出图二、图三。②图二:横坐标(FITC标记CD19),CD19为B细胞表面
对照组结果(就是打了生理盐水的那一组):由左至右依次为图一、图二、图三。
①图一:横坐标表示细胞大小,纵坐标表示颗粒度,根据颗粒度及细胞大小,得出最左下角为细胞碎片,用红线框定的为活细胞,这块区域为淋巴细胞。占样品量的50.61%,分析红圈中框定的细胞,得出图二、图三。
②图二:横坐标(FITC标记CD19),CD19为B细胞表面标志物;纵坐标(PerCP标记CD3),CD3为T细胞表面标志物。因此Q2-4区域表示CD19单阳,表示B细胞占比为26.89%。同理,Q2-1区域表示CD3单阳,表示T细胞占比为50.96%。
③图三:横坐标(APC标记CD4),CD4为Th细胞表面标志物;纵坐标(PE标记CD8a),CD8a为CTL表面标志物。Q3-4区域表示CD4单阳,得出Th细胞占比为39.22%,Q3-1表示CD8a单阳,得出CTL占比为15.17%。
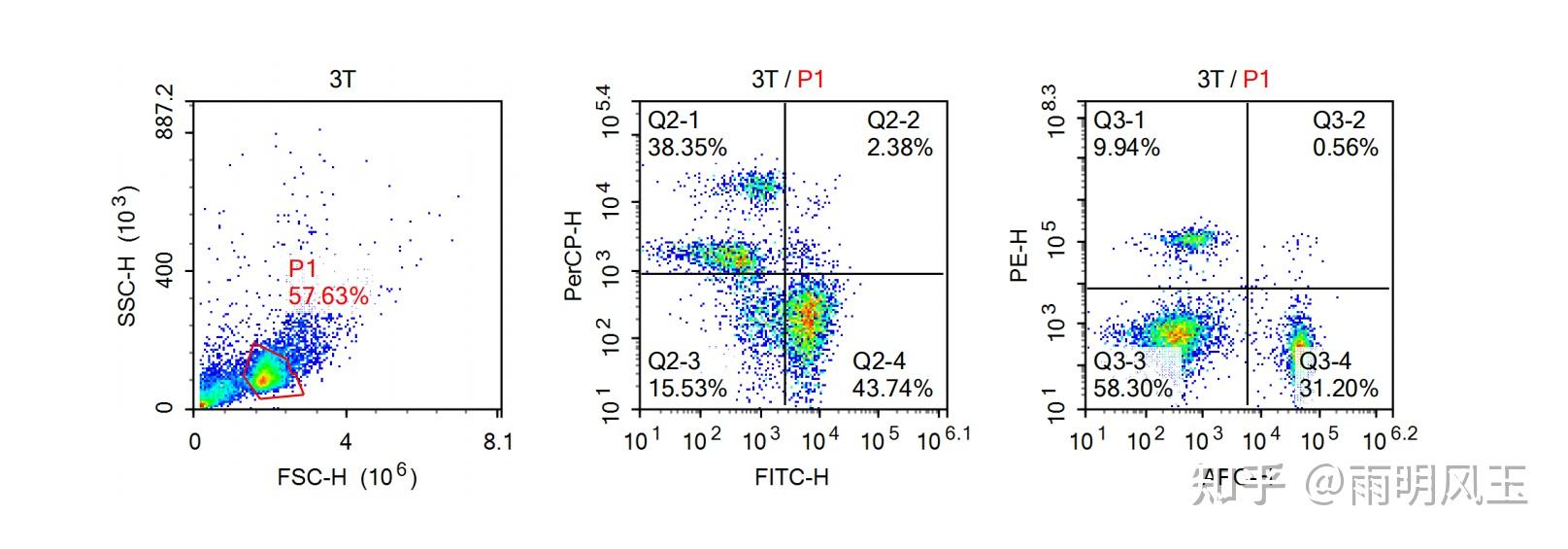
实验组组结果(就是打了体外抗原的):由左至右依次为图一、图二、图三。
①图一:横纵坐标同上,用红线框定的为活细胞,这块区域为淋巴细胞。占样品量的57.63%,分析红圈中框定的细胞,得出图二、图三。
②图二:横纵坐标同上。Q2-4区域表示CD19单阳,表示B细胞占比为43.74%。同理,Q2-1区域表示CD3单阳,表示T细胞占比为38.35%。
③图三:横纵坐标同上。Q3-4区域表示CD4单阳,得出Th细胞占比为31.20%,Q3-1表示CD8a单阳,得出CTL占比为9.94%。
由实验组与对照组进行比较,得出实验组在注入外部抗原后,淋巴细胞总体数量上升,B细胞数量大幅上升,T细胞数量明显下降;Th细胞与CTL细胞数量也下降,但CTL下降更明显。说明在注入外来抗原后,小鼠发生免疫应答,且主要为体液免疫应答。 |
|
 /3
/3 