登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
小编有6年肿瘤新药的研发经验,今天和宝子们分享一篇肿瘤相关的文献。文献由澳大利亚墨尔本大学联合Peter MacCallum 癌症中心在国际知名期刊《Nature reviews cancer 》发表的一篇回顾性文章,题目为:Towards targeting the breast cancer immune microenvironment。   有需要的宝子们可在后台联系小编获取原文~ 有需要的宝子们可在后台联系小编获取原文~
肿瘤免疫微环境是由癌细胞、免疫细胞、成纤维细胞、内皮细胞和其他基质成分之间的串扰形成的。尽管免疫肿瘤微环境(TME)是治疗靶点的来源,但它也被认为是肿瘤定向治疗的朋友或敌人。 T细胞在三阴性乳腺癌(TNBC)中的重要性很容易说明这一点,最终出现了免疫检查点疗法结合细胞毒性化疗作为早期和晚期TNBC的标准治疗,以及最近在激素受体阳性疾病亚群中有希望的疗效迹象。在这篇综述中,我们讨论了乳腺癌中免疫TME的各个组成部分,靶向或影响免疫TME的治疗方法,以及宿主生理的复杂性。 一
前言乳腺癌目前是全球最常见的癌症。乳腺癌占女性所有癌症诊断的31%,预计到2040年全球负担将进一步增加40%。尽管乳腺癌的存活率一直在提高,但该疾病造成的绝对疾病负担仍然很高,乳腺癌仍然是全球30-60岁妇女死亡的主要原因。基因表达数据已被用于对五种不同的乳腺癌亚型进行分类:人表皮受体2 (HER2)富集型、Luminal A型、Luminal B型、Basal-like型和Claudin-low型。在临床上,乳腺癌的治疗和预后取决于亚型,由HER2和激素受体表达(通过免疫组织化学)和疾病分期(图1)决定。晚期疾病几乎一致是致命的,需要持续治疗。晚期三阴性乳腺癌(TNBC)患者的预后仍然特别差,中位生存期不到24个月,部分原因是缺乏肿瘤靶向治疗。一个例外是her2扩增型乳腺癌,由于her2靶向治疗的出现,其预后在过去20年中有了显著改善。 目前治疗药物中,乳腺癌的全身治疗有三个方向:细胞毒性化疗、激素治疗和肿瘤细胞特异性靶向治疗。然而,新的治疗方法,如免疫检查点阻断(ICB),明确针对肿瘤微环境(TME)而不是肿瘤细胞本身,提供了一种新的靶向治疗方法。这强调了需要超越传统的乳腺癌亚型标记物(通常基于肿瘤细胞本身的分子特征),并考虑TME的异质性如何有助于更精细和临床相关的这些亚型分类。 现在很明显,构成TME的各种细胞类型不仅仅是肿瘤内的旁观者,而且在形成疾病病理过程中起着关键作用。重要的是,这些细胞可以通过分泌和表达促进细胞增殖和抑制抗肿瘤免疫反应的因子来促进疾病进展,或者相反,通过适应性免疫来对抗肿瘤生长。免疫在癌症中的关键作用也许最能证明的是流行病学数据强调,免疫功能低下的患者患癌症的风险更高,死亡率也更高。这些考虑为开发靶向治疗提供了基本原理,可以改变TME的平衡,有利于增强抗肿瘤免疫。这些疗法可能采取消耗巨噬细胞或成纤维细胞的形式,促进肿瘤生长或以ICB的形式增强适应性免疫。 临床试验表明,在显著降低乳腺癌复发方面,用派姆单抗抑制程序性细胞死亡蛋白1 (PD-1)或用atezolizumab联合化疗抑制程序性细胞死亡配体1 (PD-L1)比单独化疗更有效。在KEYNOTE-522临床试验中,据报道,使用默克的联合阳性评分(CPS)分析,派姆单抗治疗早期TNBC的反应与PD-L1蛋白表达无关。相比之下,KEYNOTE-355发现,在转移性TNBC患者中,使用相同的CPS测定,派姆单抗的反应与PD-L1蛋白表达升高相关。这些差异强调了进一步研究生物标志物的必要性,以及了解当前诊断方法在确定最有可能从ICB获益的患者方面的局限性。鉴于大多数早期TNBC肿瘤以拷贝数不稳定为特征,单次活检极有可能遗漏异质PD-L1表达。最近,高分辨率技术揭示了乳腺癌TME在不同亚型和不同亚型内的广泛异质性,这些异质性与不同的患者预后相关。重要的是,TME中淋巴细胞、髓细胞和成纤维细胞群体之间不仅存在数量差异,而且存在质量差异,这些差异有助于疾病的判断。在TME中的每个免疫细胞群和其他基质细胞类型中,有能够促进、抑制或驱动抗肿瘤免疫反应的离散细胞群。 在这篇综述中,作者首先描述了乳腺癌免疫TME的组成部分,并概述了它们在ICB应答中的作用。作者特别关注我们对单细胞和空间分析揭示的TME组成的理解的最新进展。作者讨论了TME如何随着疾病进展而变化,以及宿主因素如何影响免疫-肿瘤相互作用并进行了总结,针对乳腺癌患者TME的新疗法及其临床状况。最后,作者讨论了目前的乳腺癌治疗方法以及脱靶治疗对TME本身的新影响。 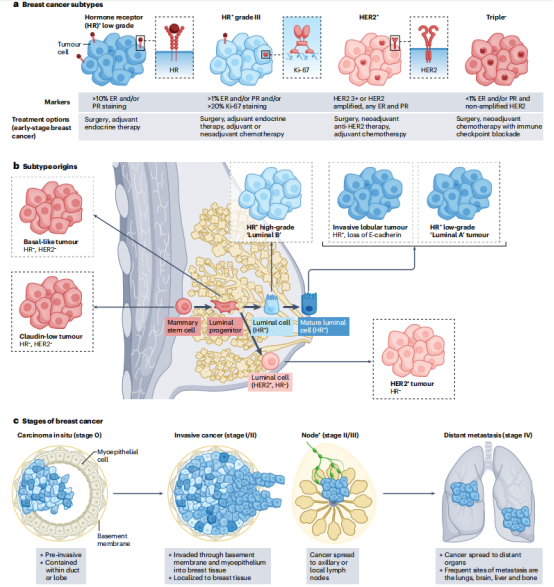 图1 乳腺癌的亚型、起源和分期 二
乳腺癌免疫TME的成分乳腺癌免疫微环境(TME)的组成是理解其在疾病进展和治疗反应中的作用的关键。TME由多种细胞类型组成,包括免疫细胞、成纤维细胞、内皮细胞及其他基质成分。免疫细胞在TME中扮演着双重角色,既可以促进肿瘤生长,也可以抑制肿瘤发展。T细胞,尤其是CD8+T细胞,被认为在抗肿瘤免疫中起到至关重要的作用。然而,TME中常常存在免疫抑制细胞,如调节性T细胞(Tregs)和髓源性抑制细胞(MDSCs),它们通过多种机制抑制抗肿瘤免疫反应。 此外,成纤维细胞和内皮细胞通过分泌细胞因子和化学因子,调节TME的免疫环境,影响肿瘤细胞的增殖和转移。单细胞分析和空间分析技术的进展使得我们能够更详细地描绘TME的组成和功能,揭示不同细胞类型之间复杂的相互作用。这些技术揭示了TME内在的异质性,通过分析不同亚型乳腺癌中TME的差异,有助于识别潜在的治疗靶点和预测治疗反应的生物标志物。 三
癌前病变和转移瘤的免疫TME在癌前病变和转移灶中,免疫微环境(TME)同样起着重要作用。在癌前病变中,TME的组成和功能可能预示着肿瘤的发生和发展。早期的免疫反应可以阻止癌前病变向恶性肿瘤的转化,但如果免疫监视失败,TME中的免疫抑制环境可能会促进肿瘤的发生和进展。癌前病变中的TME研究有助于早期检测和预防乳腺癌。转移性乳腺癌的TME与原发肿瘤有所不同,转移灶中的免疫环境对肿瘤细胞的适应和生存至关重要。转移灶TME中的免疫细胞、成纤维细胞和内皮细胞通过相互作用,形成一个有利于肿瘤生长和转移的微环境。研究转移性TME的组成和功能变化,可以揭示肿瘤转移的机制,并为开发新的治疗策略提供依据。例如,免疫检查点抑制剂在转移性乳腺癌中的应用,旨在通过解除免疫抑制,增强抗肿瘤免疫反应。了解转移灶中TME的特征,有助于优化免疫治疗策略,提高治疗效果。 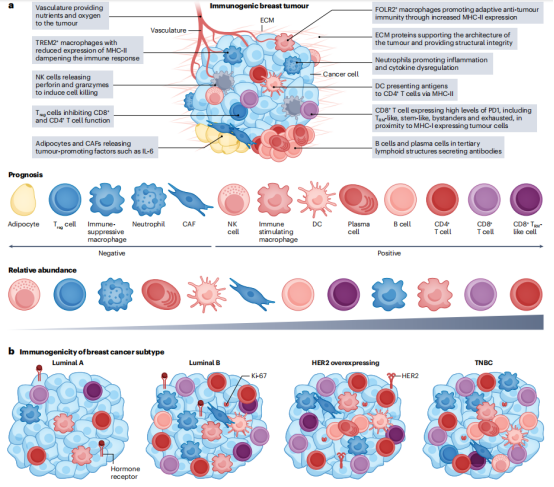 图2.免疫原性乳腺癌的肿瘤微环境 四
影响乳腺癌TME的宿主危险因素图3.乳腺癌免疫应答的影响因素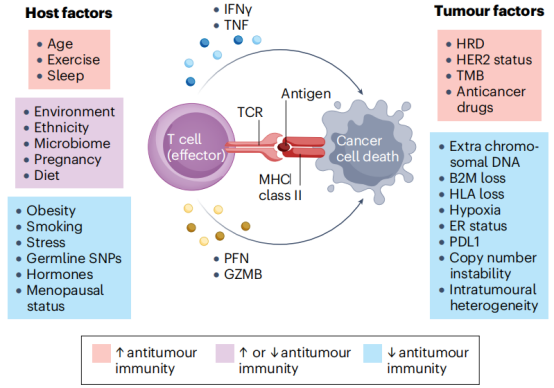 图3.乳腺癌免疫应答的影响因素 宿主风险因素对乳腺癌免疫微环境(TME)有显著影响。这些因素包括年龄、性别、遗传背景、代谢状态和生活方式等。 年龄是一个重要因素,随着年龄的增长,免疫功能逐渐衰退,导至免疫监视能力下降,增加癌症发生的风险。性别差异也影响TME,女性激素水平的变化,如绝经前后的雌激素水平变化,可以调节免疫反应和TME的组成。 遗传背景,如BRCA1和BRCA2基因突变,不仅直接影响乳腺癌细胞的行为,还通过调节TME的免疫环境,影响肿瘤的发生和发展。代谢状态,包括肥胖和糖尿病等代谢紊乱,已被证明与乳腺癌的发生和预后密切相关。代谢紊乱通过改变全身和局部的炎症状态,影响TME的免疫反应。 此外,生活方式因素,如饮食、运动和吸烟等,也对TME有显著影响。健康的生活方式可以增强免疫功能,降低癌症发生的风险,而不良的生活方式则相反。研究宿主风险因素对TME的影响,有助于理解乳腺癌的个体差异,为个性化治疗提供依据。 五
乳腺癌免疫治疗免疫治疗在乳腺癌中的应用正在迅速发展。免疫检查点抑制剂(ICB)是目前研究和应用的重点,通过阻断PD-1/PD-L1通路,解除免疫抑制,增强抗肿瘤免疫反应。在三阴性乳腺癌(TNBC)中,ICB已显示出显著的治疗效果,与化疗联合使用,可以显著降低乳腺癌复发率。 然而,不同患者对ICB的反应存在显著差异,这与TME的异质性和生物标志物的表达密切相关。研究发现,PD-L1的表达水平可以预测部分患者对ICB的反应,但这一预测标志物在不同临床试验中的结果并不一致,提示需要进一步研究以优化生物标志物的使用。 除了ICB外,其他免疫治疗方法如CAR-T细胞疗法、疫苗疗法和抗体药物偶联物(ADC)也在乳腺癌中进行研究和应用。CAR-T细胞疗法通过改造患者自身的T细胞,使其能够识别和杀伤肿瘤细胞,已在血液癌症中取得成功,正在向实体瘤包括乳腺癌扩展。疫苗疗法旨在通过激发机体免疫系统识别和攻击乳腺癌细胞,正在进行多项临床试验。ADC通过将抗体与细胞毒性药物结合,特异性地将药物递送至肿瘤细胞,提高治疗效果的同时减少副作用。 总之,免疫治疗在乳腺癌中的应用前景广阔,但仍需克服诸多挑战,包括优化治疗策略、识别有效的生物标志物和管理治疗相关的副作用。
|  /3
/3 