金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
数字PCR (digital PCR, dPCR)是在普通PCR和定量PCR基础上发展的第三代PCR技术,通过有限稀释和泊松分布统计实现**的**定量检测。相比于前两代PCR技术,dPCR能够实现DNA模板的**定量且对PCR抑制剂具有更强的耐受性。目前,该技术在致病菌和病毒、基因突变、甲基化DNA、转基因成分和食品掺假的检测中都得到了广泛的应用。
PCR技术的发展
近年来,分子生物学技术发展迅速,尤其是基于PCR衍生出的一系列技术,因其具有操作简单、快速准确、特异性强且灵敏度高的特点,己被广泛应用于各种检测领域。1983年,美国KB Mullis教授发明了PCR技术用于核酸检测,其被称为**代PCR。随后PCR技术出现井喷式发展,1992年科学家们在**代PCR技术的基础上引入荧光化学物质,发明了定量PCR技术(quantitative PCR, qPCR):通过荧光信号的变化对整个PCR过程进行实时监控,*后通过循环阈值(cycle threshold, Ct)和标准曲线对待测样本进行定量检测。数字PCR (digital PCR, dPCR)技术是近年来广泛应用于检测的第三代PCR技术。区别于qPCR依赖校准曲线对靶基因定量的策略,该技术通过将PCR体系分散成无数个小体积的反应单元进行扩增,允许单拷贝DNA的检测,可以实现对核酸的**定量。每个小反应单元含有少量或者没有目标序列,这有助于降低样本中的多种抑制剂的干扰和PCR体系中模板之间的竞争效应。表1总结了三代PCR技术的特点及其应用范围。

数字PCR的原理
dPCR的原理是通过有限稀释将含有目的DNA的PCR反应体系分散成无数个单一模板的PCR体系进行扩增,再通过统计检测结果及泊松分布校正实现目的DNA的**定量(图1)。
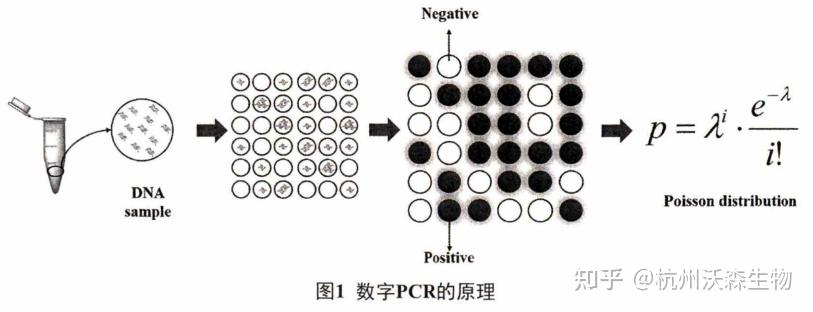
dPCR包括三个步骤:分散体系、PCR扩增和信号检测。通过样品的稀释和分散形成分散体系,这一步是限制dPCR发展应用的一个重要因素,其所引起的分散数量和分散体积的不同极大地影响着定量结果的精度与准确性。分散体系的形成增加了靶分子的有效浓度,并在一定程度上对存在干扰的复杂化合物进行了纯化,提高了靶分子和背景之间的比率%。基于dPCR统计的定量方式,反应体系的分散数量越多,低浓度靶分子的检测可能性就越大,检测灵敏度就越高,同时多个单一的反应单元也为多目标序列的高通量检测的发展提供了基础。此外,分散体积的不同会对拷贝数结果的测量产生影响,是造成dPCR精度下降的一个潜在因素,且与检测限的大小形成反比关系。
目前己成功应用于商业化的dPCR系统根据分散方式的不同可分为三种主要类型:基于油包水微滴生成技术的微滴式数字PCR(droplet digital PCR, ddPCR)、基于微孔芯片的微孔板数字PCR (micro-chamber digital PCR, mdPCR)和基于微流控技术的微流控芯片式数字PCR (microfluidic chip digital PCR, mcdPCR)。另外,基于水凝胶珠、琼脂糖珠和生物打印技术等样本分散方式的dPCR虽然尚未商业化,但在现有的实验研究中己取得一定进展。微滴式通过油包裹PCR体系形成无数个油包水微滴,每个微滴是一个独立的反应单元,这种特殊的微滴在进行PCR时能够保证完整的形态,不会互相扩散,也阻止PCR混合物液滴在热扩增过程的蒸发;微孔芯片式是利用光刻技术在硅基上刻蚀出微孔阵列,再通过表面改性、打磨等操作形成数万个纳升级的表面疏水和孔内壁亲水的微反应室;微流控芯片式则是利用微流控芯片装置使PCR反应体系准确快速地分散于芯片孔中,而每个孔都是一个小反应体系(纳升级)。

虽然基于微流控技术的微滴生成方法已经成熟,但是其技术本身带来的高昂成本以及复杂的转液手工操作使用户苦不堪言。振动注射技术的研发初衷就是要开发出全自动化,低成本,高可靠性的微滴生成方法。思纳福(sniper)振动注射技术的核心是一个特制的加样枪头。枪头浸入油相中,水相反应液匀速排出枪头,在进入油相的过程中,枪头前端进行匀速的摆动,从而产生均一的微液滴。采用振动注射技术,一方面可以通过控制流速,振动频率来灵活调整微滴体积的大小,另一方面该方法可以直接整合到自动化加样工作站流程中,无需昂贵的微流控耗材,能够直接在多孔板中生成微滴,在低成本的同时实现了液滴生成全流程的自动化。同时,振动注射技术对油相粘度不敏感,无需特殊的温控环境就能够产生均一可控的微滴。

关于信号检测,目前主要有光电倍增管(photomultiplier,PMT)、桂光电子计数器(multi-pixelphoton counter, MPPC)、电荷稱合器件(charge-coupled device, CCD)、互补金属氧化物半导体(complementary metal oxide semiconductor, CMOS)、扫描器等5种高分辨率的图像处理策略。
dPCR定量计数的方法相较于传统qPCR的定量方法更为简单,无需建立标准曲线和计算反应的扩增效率等繁琐步骤,而是通过直接计数的方式得出检测结果。根据阳性信号数量进行统计计算时,所得的*终结果不是真实的目标DNA分子拷贝数存在着一定的可能性,因此需要通过泊松分布概率公式对反应的结果进行校正计算。
数字PCR在生物学检测中的应用
dPCR发展至今己近20年,因其具有检测灵敏度高、特异性强且有效避免PCR抑制剂的影响等优势,在分子检测和疾病诊断等领域都得到了广泛应用。尤其是近几年随着dPCR仪器的不断开发,有大量的研究报道进一步证实了dPCR的优势。
⏩致病菌的检测
致病菌,是导致食源性疾病发生的主要原因。通过设计致病菌的靶基因序列的特异性引物和进行扩增是应用PCR技术实现检测的主要原理。dPCR作为第三代PCR技术,提高了检测的灵敏度和准确性,减少了前期的增菌培养过程,大大缩短了检测分析的时间,而且不需要建立标准曲线即可实现对目标分子的**定量检测。
⏩病毒的检测
目前病毒检测常用的方法主要是通过免疫学方法检测其蛋白质或通过分子生物学方法检测其特定核酸。dPCR作为**的分子生物学检测技术,检测时无需建立标准曲线且不受基质效应的影响,适用于病毒分子定量检测尤其是低拷贝病毒的定量检测。
⏩基因突变的检测
基因突变的检测方法主要是PCR或Sanger测序法,但这两种方法对低含量的基因突变检测灵敏度低,且难以满足早期突变筛查的需要。dPCR**次被阐述正是用于基因突变的检测,结果显示dPCR对基因突变的分析灵敏度高,且可以对复杂组织进行检测。
⏩甲基化DNA的检测
有研究表明,启动子高甲基化与一些关键肿瘤抑制基因的沉默有关,并且这种甲基化通常发生在癌变的早期阶段,所以甲基化DNA检测被认为是癌症检测和诊断的重要手段。目前,甲基化DNA的检测方法己有大量文献报道,其中基于限制性核酸内切酶的一类方法通常与PCR技术联合使用,而dPCR作为**的PCR技术在甲基化DNA的检测中也得到了广泛应用。
⏩细胞及基因治疗方向的应用
数字PCR在细胞及基因治疗方向的应用包括病毒载体滴度(例如:被用于定量制品中慢病毒载体滴度、AAV载体滴度、腺病毒载体滴度等),基因转导检测(例如:用于测量整合到诱导多能干(iPS)细胞、CD34 +造血干细胞、T细胞中的逆转录病毒、慢病毒载体的拷贝数)及基因治疗制品中污染物检测等。
⏩转基因作物及食品掺假成分的检测
近年来,转基因食品饱受争议,准确灵敏的检测方法对转基因食品的监控尤为重要。GB/T19495系列标准将qPCR作为检测转基因作物的金标准,但是qPCR在检测转基因成分基质复杂的作物时会造成偏差,使检测的结果不准确,而且还容易对低浓度的转基因样品造成漏检。而dPCR作为第三代PCR技术,由于其在低丰度检测和强耐受抑制剂方面的优势,应用dPCR对转基因作物进行检测也受到了广泛的关注。

思纳福医疗科技有限公司(Sniper)成立于2018年4月,以微液滴技术为根基,专注于下一代精细化分析医疗仪器的研发。团队来自于北京大学,北京航空航天大学等知名高校和企业,曾从事高端科研设备的定制化服务,客户覆盖航天、核能、医疗、新材料等领域,积累了丰富的新技术工程化和量产化经验。团队开发了具有全球化自主知识产权的微滴生成方法——振动注射技术(Vibrant Injection)

Sniper DQ-24 技术优势:
- 操作简单,全自动化一体机
- 检测速度快,1.5-2h检测时长
- 6色荧光通道
- 样本有效利用率高,>85%液滴有效率
- 耗材成本低
原文地址:https://zhuanlan.zhihu.com/p/678236666 |
|
 /3
/3 