金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
在经历了几十年挫折和失败的尝试后,科学家们终于有望开发出在糖尿病、狼疮和多发性硬化症等疾病中恢复免疫“耐受性”的疗法。
抗原呈递细胞(图示,右)有时可以训练T细胞(左)不要进行攻击。来源:Juan Gaertner/ Science Photo Library
早在2001年,免疫学家Pere Santamaria就在探索一种糖尿病研究的新方法。他和他的合作者开发了一种方法,使用氧化铁纳米颗粒来追踪小鼠体内参与该疾病的关键免疫细胞。
但随后,Santamaria(就职于加拿大卡尔加里大学)想出了一个大胆的主意。也许他可以用这些颗粒作为一种治疗方法,靶向并抑制甚至杀死导致疾病的细胞(它们破坏胰腺中产生胰岛素的胰岛细胞)。这似乎是一个不着边际的想法,但他决定尝试一下。“我不停地做一个又一个实验。”他说。现在,二十多年过去了,Santamaria开发的疗法即将在人体上进行试验。
这种疗法并非孤例。50多年来,研究人员一直试图去控制导致1型糖尿病、狼疮和多发性硬化症等自身免疫性疾病的细胞。此类疾病大多数已获批的疗法都是通过抑制整个免疫反应来发挥治疗作用的。这些疗法通常能够缓解症状,但会使患者面临更高的感染和癌症风险。
但几十年来,免疫学家一直希望恢复所谓的耐受性——即免疫系统忽略体内来源的抗原,同时恰当地攻击不属于体内的抗原的能力。在某些情况下,这意味着管控无赖细胞(rogue cell)所攻击的特定抗原,这种策略可以使细胞去编程并抑制自身免疫反应。其他研究人员正在尝试选择性地清除有问题的细胞,或引入经过改造的抑制性免疫细胞来攻击有问题的细胞。一种依赖工程化免疫细胞的方法被用于治疗15名患有狼疮或其他免疫疾病的患者,取得了惊人的成功[1]。其中一名参与者已有两年半未再出现症状。
约翰斯·霍普金斯大学的风湿病学家Maximilian Konig专门从事自身免疫性疾病的研究,他说,如果有更多的人体试验得到积极结果,这种疗法可能会改变人们的生活。“这些疾病现有的治疗方法非常糟糕。”他说。现有的治疗方法并不总是能起效,即使起效,改善程度往往也有限。Konig说,谈论可以治愈自身免疫性疾病的疗法“几乎是亵渎”。现在,随着一些试验结果的出现,治愈似乎是可能实现的。“唯一的问题是,哪个办法最好?”Konig说。
知觉自我
众所周知,免疫系统在攻击病原体方面发挥着重要作用。但它还有另一项同样重要的工作:知道什么时候应该停止工作。如果免疫细胞将自身组织视为威胁,就会对人体造成伤害。
淋巴细胞是免疫系统中参与靶向攻击的分支之一,分化形成T细胞和B细胞,T细胞通常识别并攻击外来或病变细胞,B细胞产生抗体并以其他方式支持免疫系统。在它们发育的早期,这些细胞会经历一个过程,以淘汰其中自身反应性的细胞。但这种被称为中枢耐受(central tolerance)的过程是“有漏洞的”,伊利诺伊州芝加哥大学的化学工程师Jeffrey Hubbell说。有些细胞会蒙混过关。
人体还有一个备用系统,一种被称为外周耐受(peripheral tolerance)的机制。这种机制可以消除不听话的细胞或使其失活,或将其转化为所谓的调节性T细胞,通过阻止其他细胞攻击来抑制免疫反应。
在自身免疫性疾病中,中枢耐受和外周耐受都会崩溃,原因尚不完全清楚,免疫系统开始攻击人体自身细胞和组织上的抗原。在多发性硬化症中,身体会攻击包裹神经的髓鞘。在乳糜泻中,麸质会触发免疫系统攻击肠道内壁。
如果科学家能够平息或消除这些功能失调的细胞,从而恢复对特定抗原的耐受性,他们就可以在不妨碍免疫系统应对真正威胁的情况下治疗这种疾病。早期的研究工作集中在给予大量有问题的抗原,试图耗尽识别问题抗原的免疫细胞或使之失活。许多研究团队都尝试过这种脱敏疗法,并取得了不同程度的成功。加利福尼亚州南旧金山Sonoma Biotheraputics公司的免疫学家兼首席执行官兼联合创始人Jeffrey Bluestone表示,抗原的引入方式必须恰到好处,才能提高耐受性而非激活免疫,“这就是抗原特异性治疗的整个领域。”
拨动开关
选择正确的抗原很不容易。有些自身免疫性疾病是由对一种抗原的反应而引起的。但还有许多疾病,如多发性硬化症、糖尿病和类风湿性关节炎,由于表位扩展(epitope spreading)现象的存在,人体会产生针对几种抗原的免疫反应。Bluestone说,研究人员可以尝试找出所有涉及的抗原。但这是一个很高的要求,尤其是因为这个清单可能因人而异。另一种可能性是寻找一个总开关,当它被扳动时,可以关闭自身免疫反应,同时保持免疫系统的完整性。
Santamaria认为他已经找到了这样一种机制。他们团队的纳米颗粒——他称之为navacims——具有蛋白质修饰,这些蛋白质被称作主要组织相容性复合体,它们像刺一样突出于颗粒表面。这些刺是为了模仿抗原呈递细胞(一种免疫调节细胞)上的棘突,抗原呈递细胞清除全身的抗原,然后将它们带到T细胞,告知T细胞是攻击还是忽略这些抗原(见“耐受途径”)。Santamaria把它们比作T细胞诱饵。
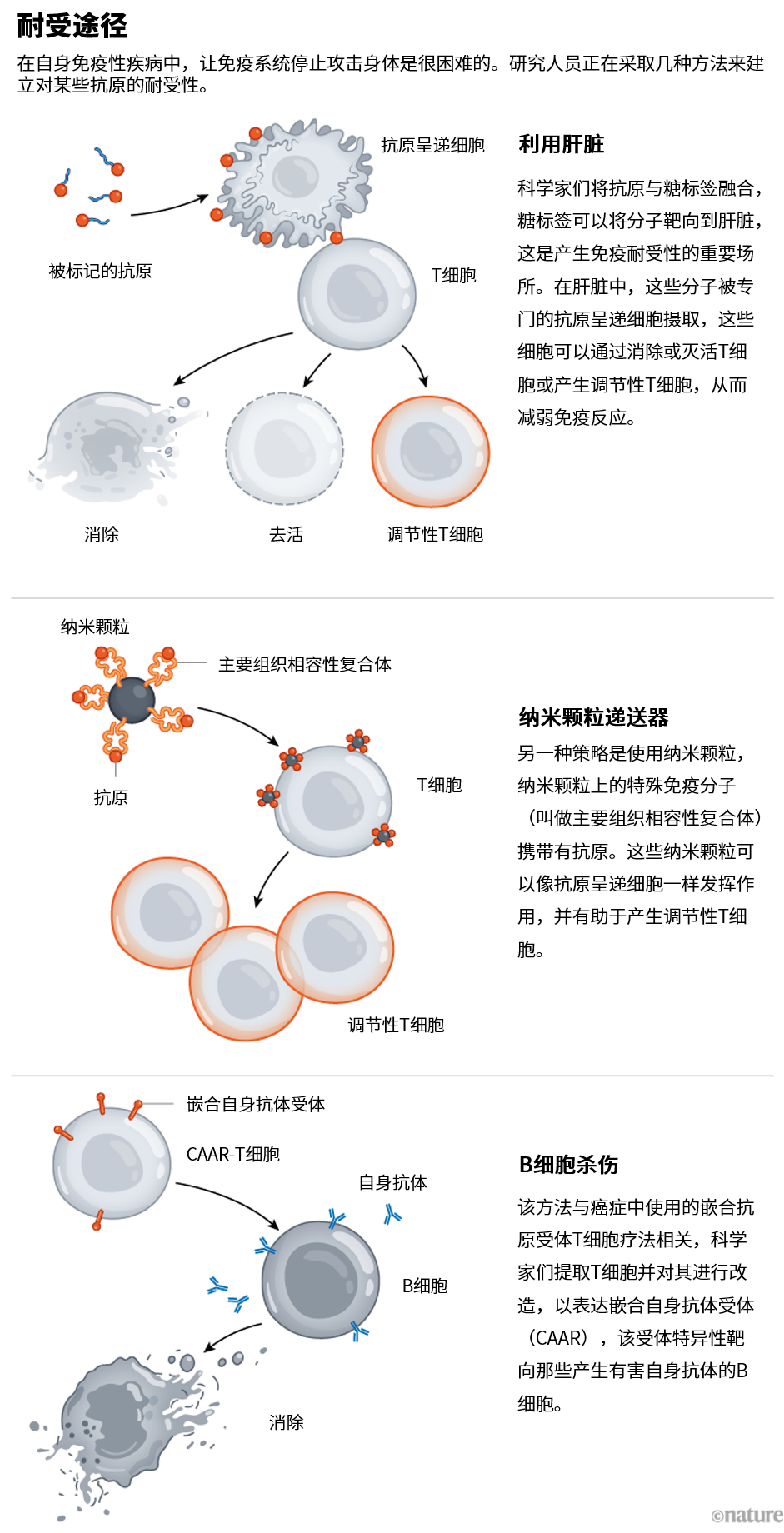
来源:Liver: Ref. 4; Nanoparticles: Y. Yang & P. Santamaria Adv. Drug Deliv. Rev. 176, 113898 (2021); CAAR: Ref. 6
在发现如何使用纳米颗粒navacims追踪T细胞后,Santamaria开始研究如何将其用作治疗方法。他怀疑纳米颗粒或可导致细胞死亡或休眠。
当时,Santamaria正在研究1型糖尿病的小鼠模型,人们已知糖尿病会发生表位扩展。因此,他开发了一种携带八种不同抗原片段或表位的颗粒混合物。作为对照,他使用了一种携带单一表位的纳米颗粒,并推测这种纳米颗粒不会有任何作用,因为T细胞在糖尿病中能识别数千个表位。然而,令人惊讶的是,对照组和实验组的纳米颗粒都逆转了糖尿病症状。“这完全没有道理。”Santamaria说。
他花了好几年时间探索发生了什么,但他现在觉得搞明白了[2,3]。纳米颗粒促使T细胞增殖并变形为调节性T细胞,并到达炎症部位。在那里,它们结合并使抗原呈递细胞失活,而抗原呈递细胞不仅携带这些细胞识别的抗原,还携带其他数千种糖尿病的重要抗原。因此,这些抗原呈递细胞细胞就不能再激活助长疾病的免疫细胞。从某种意义上讲,纳米颗粒融合抗原起到了总开关的作用。Santamaria说:“有时候这听起来好到不像真的。”
前路确实未定。这种策略还没有进行临床试验。Santamaria在南旧金山成立了一家名为Parvus Therapeutics的公司,该公司将于今年开始第一次人体试验,从一种影响肝脏的自身免疫性疾病开始。
肝脏中的钥匙
肝脏是过滤所有从肠道携带外来抗原的血液的地方,也是细胞和组织死亡后留下的所有细胞碎片的归宿地。因此,肝脏在建立免疫耐受性方面具有重要作用。Hubbell和他的同事发现,细胞碎片携带一种特殊的糖标签,会将其引导到肝脏。他们意识到,通过将这种糖标签添加到其他蛋白质中,他们几乎可以将任何他们想要的分子靶向到肝脏,包括抗原,例如在多发性硬化症中激活免疫系统的髓鞘蛋白。在2023年发表的研究中,他们表明这种策略可以逆转小鼠多发性硬化症样疾病的症状[4]。
Hubbell说,这篇论文最令人兴奋之处在于,这些动物处在病程的晚期,这意味着它们的免疫系统可能已对多种抗原产生了反应。然而,仅用一种抗原治疗就可以逆转瘫痪。
马萨诸塞州剑桥市一家名为Anokion的公司也在研究类似的治疗策略,Hubbell与他人共同创立了这家公司。该公司已在多发性硬化症患者中对这种疗法进行了I期试验,以评估其安全性,目前正在招募受试者参加II期试验,并将开始评估疗效。该公司首席执行官Deborah Geraghty不愿透露抗原进入肝脏后,这种疗法究竟是如何发挥作用的。“我们还没有公开披露太多这方面的信息,”她说,但她补充道,“我们相信我们正在推动一种强大的T细胞调节性组分。”
Bluestone决定另辟蹊径。他和Sonoma Biotheraputics的同事从患者的血液中提取T细胞,再提取调节性T细胞,并改造它们使其表达一种抗原,这种抗原能在调节性T细胞被重新注射回体内时将其引导到疾病部位。届时,这种改造后的细胞应该能够平息附近所有失控的T细胞,而不仅仅是那些识别它们所携带的特定抗原的T细胞。
Sonoma公司已经在临床试验中测试了调节性T细胞,但尚未测试那些经改造后表达特定抗原的细胞。该公司计划在2024年初为一位类风湿性关节炎患者注射第一剂。
Bluestone认为,与给患者注射抗原相比,这种方法风险更小,因为抗原可能进一步加剧自身免疫。并且调节性T细胞能产生组织修复因子,这可能有助于逆转疾病造成的一些损伤。但细胞疗法也面临挑战,包括高昂的成本和潜在的副作用。“这些都是活细胞药物。”Bluestone说。一旦注射后,这些细胞就会开始在体内复制,如何确定细胞的注射剂量?“还有很多东西等待我们去了解。”
聚焦B细胞
在Bluestone和Hubbell等研究人员努力推进免疫系统产生耐受性的同时,其他研究者正在开发直接杀死致病免疫细胞的疗法。
德国的一个团队正在尝试一种常用于治疗血癌的方法,为T细胞配备所谓嵌合抗原受体(CAR)。临床医生从患者体内提取T细胞,并对其进行改造,使其表面表达这种特殊的合成受体。他们可以创造一种与CD-19结合的CAR,CD-19是一种存在于所有B细胞上的蛋白质。然后,临床医生将CAR T细胞注入体内,CAR T细胞就会开始攻击B细胞。
到目前为止,研究人员共计公布了对15例患者的研究结果:8例狼疮;4例系统性硬化症(此病影响结缔组织);3例为特发性炎症性肌炎(此病可引起肌肉炎症和虚弱)。受试者的症状显著改善。但最令人惊讶的是,即使在受试者开始产生新的B细胞后,他们的病情仍在缓解。仿佛消灭B细胞对免疫系统进行了重置[5]。
斯坦福大学的神经免疫学家Lawrence Steinman被许多人称为抗原特异性疗法之父,他说:“这项研究的结果令人惊奇、难以置信,且非常出色。”该研究的第一位参与者患有狼疮,在12月度过了1000天的里程碑,没有任何发病迹象。Konig同意这一结果是“令人难以置信的”:“大多数人都没有预料到这项研究的持久程度。”但是,他补充道:“我认为,我们不能指望每位患者的疾病都能永远消失。”驱动狼疮发病的T细胞仍然存在。
CAR-T疗法靶向并杀死所有B细胞,因此将其视为恢复耐受性的方法可能有些牵强。但对于大多数自身免疫性疾病来说,捣蛋的B细胞只有一小部分。哥伦比亚大学瓦格洛斯内外科医学院的皮肤科医生Aimee Payne希望找到一种只针对这些细胞的方法。她研究的是一种名为粘膜寻常型天疱疮的罕见皮肤病。在这种疾病的患者体内,免疫系统会对皮肤中一种名为桥粒芯蛋白3(desmoglein 3)的蛋白质产生抗体。“这种蛋白主要负责将上皮细胞固定在一起,”她说。“细胞四分五裂,整个粘膜[和]皮肤上都会起水疱。”
天疱疮的标准疗法是一种单克隆抗体,其作用是破坏B细胞。随着B细胞的消失,抗桥粒芯蛋白3的抗体消失,患者的病情随之缓解。Payne说:“我们现有的治疗方法是个很粗钝的武器。”
Payne意识到,通过对CAR-T疗法稍作改进,她可能能够开发出一种更精锐的武器。她并没有设计能与所有B细胞结合的T细胞受体,而是将T细胞改造后表达桥粒芯蛋白3,它与只粘附在无赖B细胞表面的桥粒芯蛋白3抗体结合[6]。这种疗法被称为CAAR(嵌合自身抗体受体)T细胞。“这种疗法就像一束激光。”她说,“靶向引起疾病的自身反应性B细胞,但不折腾健康的B细胞。”
Payne在宾夕法尼亚州费城成立了一家名为Cabaletta Bio的公司,目前正在天疱疮和重症肌无力(另一种自身免疫性疾病,会导致肌肉无力)患者身上测试这些细胞。
Payne说,B细胞正在成为许多自身免疫性疾病的一个颇有前景的靶点。在一些最常见的疾病中,B细胞起着复杂的作用。它们不仅产生抗体,还会产生信号引发炎症,并向T细胞呈递抗原,给自身免疫性疾病的病程发展煽风点火。Payne说,在免疫学中,“每个人都关注T细胞,因为它们是聪明的细胞,而B细胞就像个‘穷亲戚’。”但她说,“也许B细胞才是关键”。
Steinman很谨慎,不敢过于乐观。几十年来,他一直致力于免疫耐受的研究。他说:“包括我自己的一些研究成果在内,每次这些疗法所开展的临床试验,都没能获得药物批准。”在这一点上,他补充道,“保险起见,我想多面下注。”
Santamaria认为,过去的许多失败都源于对潜在机制的理解不足。他说:“我认为,以前的试验之所以失败,因为在我们真正知道自己在做什么之前,那些疗法就进入了临床测试。”现在,在对纳米颗粒navacims进行了18年的研究后,他认为他的团队有很大的把握取得成功。
Konig赞同B细胞耗竭的方法。这正是他的团队目前在研究的策略,所以他承认自己可能有点偏心。“美妙之处在于,我们最终会从数据中了解到什么是正确的方法。”
参考文献:
1.Mueller, F. et al.Blood 142, 220 (2023).
2.Tsai, S. et al. Immunity 32, 568–580 (2010).
3.Solé, P. et al. Cell. Mol. Immunol. 20, 489–511 (2023).
4.Tremain, A. C. et al. Nature Biomed. Eng. 7, 1142–1155 (2023).
5.Mackensen, A. Nature Med. 28, 2124–2132 (2022).
6.Ellebrecht, C. T. et al. Science 353, 179–184 (2016). 原文以Can autoimmune diseases be cured? Scientists see hope at last标题发表在2024年1月23日《自然》的新闻特写版块上
原文作者:Cassandra Willyard
Can autoimmune diseases be cured? Scientists see hope at last© nature
doi:10.1038/d41586-024-00169-7
<hr/>版权声明:
本文由施普林格·自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转载我们的文章到知乎专栏,如需转载文章到问答,请私信我们您的问答格式和用途。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
© 2024 Springer Nature Limited. All Rights Reserved. |
|
 /3
/3 