金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
一、肺癌流行病学
肺癌,是中国年发病率最高的癌症,约73万(2015年数据),在全球范围内,每年有近160万人死于肺癌(男性110万,女性近50万,2012年数据)。在中国,肺癌年死亡人数占全部癌症死亡人数的21%,约61万(2015年数据)。近年来,随着手术及药物治疗的完善,肺癌全球5年生存率仍在10%-20%之间。
肺癌发病率的变化和烟草的使用关系密切。比如,烟草使用量已经达到顶峰的国家(美国,英国,丹麦等),肺癌的发病率正在下降,男性的发病率在男女发病占比中也趋于稳定,并且有些国家(比如西班牙,匈牙利,烟草的使用量也已经达到峰值),肺癌在男性中发病率呈下降趋势,反而妇女的发病人数正在增加。在烟草使用量正在上升的国家中(中国,印尼等),肺癌的发病率仍在上升。在吸烟者中,慢性阻塞性肺疾病(COPD)是肺癌发病的最大风险因素。烟草烟雾激活了引起COPD和肺癌的共通的信号通路,突变经过成年累月的积累,最终引发了癌症。
影响肺癌发病的最大风险因素是吸烟,但是只有10%的烟民最终发展成肺癌。这表明,其他因素也影响肺癌的发生。除吸烟外,暴露于空气中其他成分(如建筑材料)等也是引起肺癌的主要原因。此外,室内空气污染,如烹饪烟气,煤炭燃烧,二手烟,石棉,各种金属,辐射污染物,有机化学物质,部分饮食因素,职业相关性疾病(如橡胶制造,室内装修,油漆等都和肺癌的发病相关。另外,人乳头病毒感染,结核病也会增加罹患肺癌的风险。亚洲女性也是受肺癌困扰的一大类人群,但她们无吸烟史,患肺腺癌的发病率较高,通常情况下伴有EGFR突变或ALK融合。
流行病学数据表明,影响肺癌发生的关键因素可总结为肺部吸入空气的质量,烟草烟雾,橡胶,建筑材料,油烟气等扮演者重要角色;病毒和细菌感染也对肺癌的发生有影响。亚洲女性患肺腺癌较高的概率也说明肺癌的发生有人群的特异性。
二、肺癌的遗传性与易感性
即使在相同的环境中,患者个体间基因的差异也可能导致在多年后是否患癌。癌症的发生取决于基因与环境的相互作用。大多数肺癌的致病原因可归结于吸烟,暴露于呼吸道和肺实质中的自由基,芳香胺,多环芳香烃,亚硝胺等是强致癌物。但大约15%的男性肺癌和50%的女性肺癌与吸烟无关。未吸烟罹患肺癌的年轻女性的总预后要比因吸烟罹患肺癌的总预后要好。宿主对肺癌的易感性是因个体而差异的,如吸烟患者患癌,吸烟患者不患癌,不吸烟患者患癌等。因此,大规模的数据研究是必要的,探究遗传因素在肺癌发病过程中的作用。
肺癌的发病,在个体层次之上,表现为家族聚集性,这其中,DNA修复基因的多态性,代谢酶的遗传多态性,是家族聚集性肺癌发病的主要因素。生物体在代谢,毒素等外来物质的过程中,如药物,外源物质会通过多种方法诱导代谢酶的表达,而很多时候,代谢酶可以将外源物,代谢成成活性物质或者致癌物等中间产物(这也从另一个角度说明了化疗药物是致癌药物还是治癌药物),比如参与物质代谢的细胞色素P450系列,是重要的I期代谢酶,谷胱甘肽-S-转移酶(GST)是重要的II期代谢酶,III期转运蛋白,包括P-糖蛋白,多重耐药相关蛋白(MRP)等与药物的生物转运和排泄相关。
细胞色素CYP代谢酶具有多样性,如CYP1A1,CYP1A2,CYP1B1,CYP2A6,CYP2E1和CYP3A4等都可以代谢烟雾中的致癌物,CYP1A1和CYP1B1参与烟雾中多环芳烃的代谢,CYP2A6和CYP2E1参与烟雾中亚硝胺的代谢。CYP代谢酶可将Benzo(a)pyrene(一种多环芳烃)代谢为BPDE(一种致癌物),BPDE可以和DNA共价结合从而破坏DNA结构,比如和TP53基因的157,248,273位的G碱基结合,从而导致TP53的热点突变。
CYP的多态性和肺癌的发生具有一定的关联,如CYP1A1 m1等位基因,可增加酶的活性,m2等位基因也可增加酶的活性,通过代谢烟草致癌物形成中间体,进而和DNA共价结合而引起变异,m3等位基因则属于非洲裔美国人。
除细胞色素CYP代谢酶外,其他代谢酶,如GST,NQO1,不同的多态性,都在代谢一些有毒物质过程中形成致癌物,进而引起癌症的发生。除代谢酶外,DNA修复相关基因,如XPC,XRCC1,ERCC2等,其多态性也都和肺癌发生相关。
基因的多态性位点是因人群而有差异的,目前有多种SNPs研究开展,而有些多态性在代谢一些物质时,在体内产生了有致癌性的中间物质,进而促进了肺癌的发生。Drug--->SNPs--->carcinogen。在这个线性关系中,Drug,SNPs,carcinogen的全面阐释有助于我们降低肺癌的发病率。
三、肺癌发生的干细胞理论
传统上,用于解释癌症发生的理论为“克隆进化论”,认为,肿瘤内的每个肿瘤细胞都具有相同的致癌潜力。癌症干细胞理论认为:在癌细胞中,有一小部分具有干细胞的功能,其具有自我更新能力,可分化为其他细胞,并形成新的肿瘤,癌症干细胞能够抵抗化学治疗和放射治疗,导致肿瘤的复发,患者的预后也比较差。癌症干细胞理论有效的解释了癌症为什么会复发,化疗效果差。
四、肺部肿瘤分类
WHO 在2015年对肺部肿瘤在组织学上做了新的分型,其中大类如下:
- 上皮细胞肿瘤(Epithelial tumors)
- 间充质细胞肿瘤(Mesenchymal tumors)
- 淋巴组织细胞瘤(Lymphohistiocytic tumors)
- 异位起源肿瘤(Tumors of ectopic origin)
- 肺部转移瘤(Metastatic tumors)
在这其中,占比最大的是上皮细胞肿瘤(Epithelial tumors),临床药物最多,分子分型最明确。其中细分如下:
- 腺癌
- Lepidic adenocarcinoma
- Acinar adenocarcinoma
- Papillary adenocarcinoma
- 等
- 鳞状细胞癌
- Keratinizing squamous cell carcinoma
- Basaloid squamous cell carcinoma
- 等
- 神经内分泌瘤
- 大细胞癌
- 腺鳞状癌
- 梭形细胞癌
- 等...不再列举()
基于发生机理,治疗方案,预后,可将其分为两大类:非小细胞肺癌(NSCLC,约80%左右,分为鳞癌和非鳞癌两类),小细胞肺癌(SCLC,约20%左右)。在NSCLC中,占比最高的,为非鳞癌中的腺癌,分子分型明确,测序意义明确,非抽烟患者,药物靶点多(会在下文提到),预后较好。
五、肺癌的分子病理学
在以肺癌组织结构为基础的众多亚型中,分子病理发展最明确的是非小细胞肺癌,其中的Driver基因包含KRAS,EGFR,BRAF,ALK,MET,ERBB2,ROS1,RET,NTRK等,但不同驱动基因的占比会在人群中有所差异,比如亚洲人群中,EGFR的占比较高。此外,随着技术的不断进步,还有很多Driver基因等待被发现。
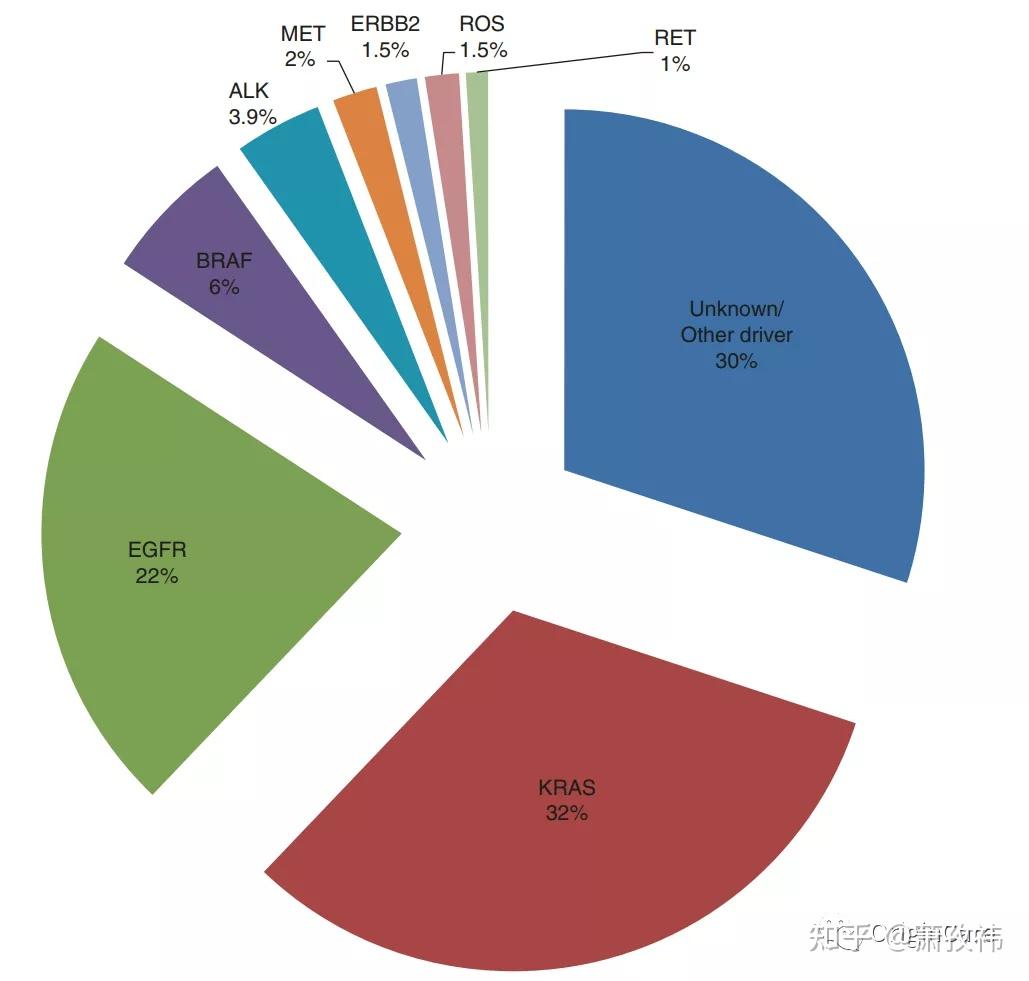
另外,对小细胞肺癌而言,目前并无明确的分子病理概念提出,药物治疗上也是主要以化疗药物治疗为主,但现在有一些免疫治疗药物在临床试验中。
故在谈肺癌的NGS检测,靶向治疗时,要避免诱导陷入误区,NGS检测会被发放大为基因检测,非小细胞肺癌的基因检测会被放大为肺癌的基因检测。在临床上,有用的是有限的。目前来看,基因检测,能涵盖的是肺癌\肺部肿瘤的一部分;NGS检测,能兼顾的,更是其中的一小部分。
六、详解肺癌分子标记物
1、非小细胞肺癌
非小细胞肺癌NCCN指南,提到了NGS,RNA-based NGS,PCR,Sanger Sequencing,SNaPshot,MassARRAY,FISH,IHC等检测方法。并且,指南提出,单一的NGS panel 检测并不能完全覆盖多种类型的突变,故在临床实际应用中,要明确常见的基因及其变异类型,是否能够使用,是否适合使用NGS检测,如果NGS panel无法检测所有的变异类型,应考虑多种检测方法的联合,比如用RNA-NGS检测融合基因变异,FISH检测拷贝数扩增,结构变异等,IHC用来检测蛋白高表达。
NCCN指南2020版,对非小细胞肺癌(Non Small Cell Lung Cancer, NSCLC, 肺腺癌,肺鳞癌,大细胞癌为主),常见的靶点,突变类型,及药物信息如下:
NCCN指南提到的用于治疗或有参考意义的分子标记物:
- EGFR
- 变异类型:突变 | Exon 19插入缺失,L858R,L861Q,G719X,S768I突变,T790M突变,exon 20插入。
- 检测方法:首推NGS突变检测,panel设计可涵盖EGFR全部位点。如果选择Real-Time PCR, Sanger Sequencing, 因为灵敏度较差,需要对肿瘤组织做富集,使突变检出概率变大,T790M的检测可采用数字PCR的方法。
- 药物举例:Osimertinib, Erlotinib, Afatinib, Gefitinib, Dacomitinib | Ramucirumab, Bevacizumab,在药物联合使用过程中,会涉及到多种其他靶点药物,如何VEGF/VEGFR靶点相关的Bevacizumab会用于多种肿瘤的临床治疗。
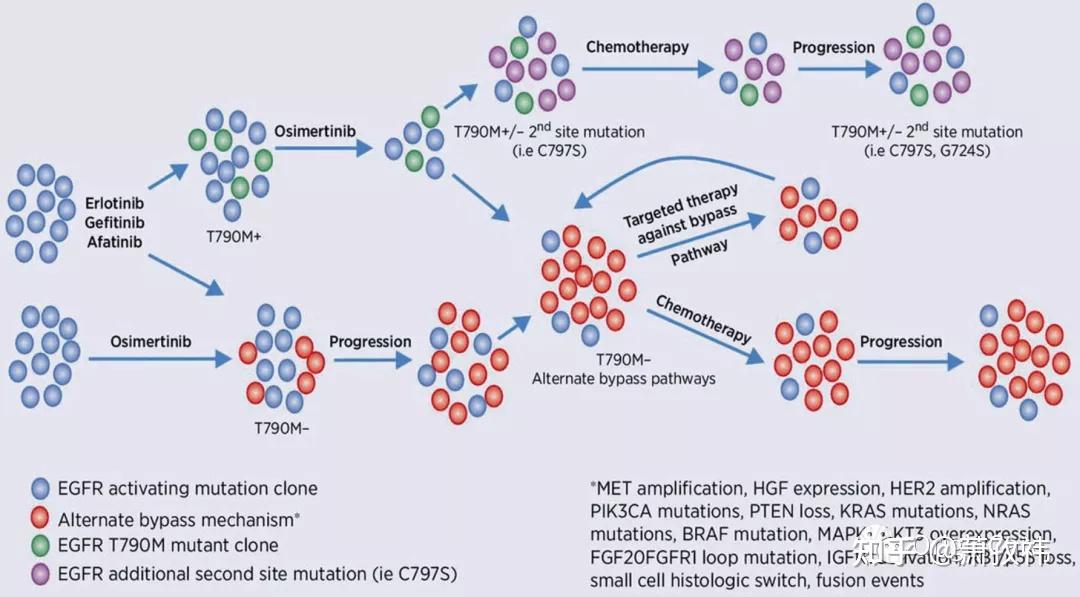
- 耐药性:EGFR一线药物治疗之后,耐药是临床面临的最大问题,目前,已经阐明了许多耐药Biomarkers,比如T790M引起的二级突变,met扩增,NSCLC向SCLC的转化,EMT,PTEN缺失,KRAS突变,CRKL的过表达,MicroRNA变异等。
- ALK
- 变异类型:融合 | EML4-ALK融合,其他形式融合,如KIF5B-ALK,TFG-ALK。
- 检测方法:对EML4-ALK融合检测,首推FISH和IHC,其中FDA批准的ALK[D5F3] CDx Assay可单独使用,不需要FISH验证。NGS可以使用,也可用来检测多种类型ALK融合。
- 药物举例:Alectinib, Brigatinib, Ceritinib, Crizotinib
- 耐药性:ALK融合应对一代药物出现的耐药主要表现在ALK自身突变,ALK扩增引起的信号放大,EGFR的激活,KRAS突变,c-KIT突变,IGF-1R突变等。
- ROS1
- 变异类型:融合 | 融合partner,CD74,SLC34A2,CCDC6,FIG。
- 检测方法:FISH, IHC (特异性较差), NGS, Real-Time PCR
- 药物举例:Crizotinib, Entrectinib, Ceritinib
- BRAF
- 变异类型:突变 | BRAF V600E
- 检测方法:Real-time PCR, Sanger Sequencing, NGS,BRAF突变在肺癌中常见的为V600E位点突变,在其他肿瘤中也是,如结直肠癌,黑色素瘤等,其中在结直肠癌和肺癌中,V600E也常常是EGFR耐药出现的下游信号通路突变。其检测可用来判断耐药并匹配相应的靶向药物。
- 药物举例:Dabrafenib, Vemurafenib | Trametinib
- KRAS
- 变异类型:突变 | G12。除G12突变常见外,仍有G13,A146等位点突变有临床意义。KRAS突变与EGFR耐药相关。
- 检测方法:Real-time PCR, Sanger Sequencing, NGS。
- 患者预后较差,EGFR用药性耐药。目前,针对KRAS基因并无临床上市药物,虽从信号通路考虑下游药物的可能性,但其效果不佳。
- NTRK
- 变异类型:融合 | NTRK1\2\3和其他基因,为FDA批准的非适应症靶向位点,针对有NTRK融合的各种癌症的检测和治疗,肺癌中NTRK突变量较少。
- 检测方法:FISH(至少三个探针),IHC,PCR,NGS,如需检测NTRK1、3的融合,则需要RNA-Based NGS。
- 药物举例:Larotrectinib, Entrectinib
- MET
- 变异类型:扩增,Exon 14跳跃突变
- 检测方法:NGS
- 药物举例:Crizotinib
- ERBB2
- 变异类型:扩增,突变。在肺癌中,ERBB2的变异主要以20插入为主,扩增较少。为EGFR耐药相关基因突变。
- 检测方法:FISH,IHC,NGS,PCR,Sanger Sequencing
- 药物举例:Ado-trastuzumab emtansine
- RET
- 变异类型:融合
- 检测方法:FISH,ICH,NGS
- 药物举例:Cabozantinib, Vandetanib
- TMB
- 变异类型:突变
- 检测方法:NGS | 目前,行业内没有评估TMB的专家共识。TMB与免疫治疗的疗效是因免疫治疗药物而又差异,还是一概而论,也是值得临床深入研究的话题。
- 药物举例:Nivolumab | iplilimumab
- PD-L1 expression positive (>=%50) & EGFR, ALK, ROS1, BRAF Negative
- 变异类型:蛋白高表达
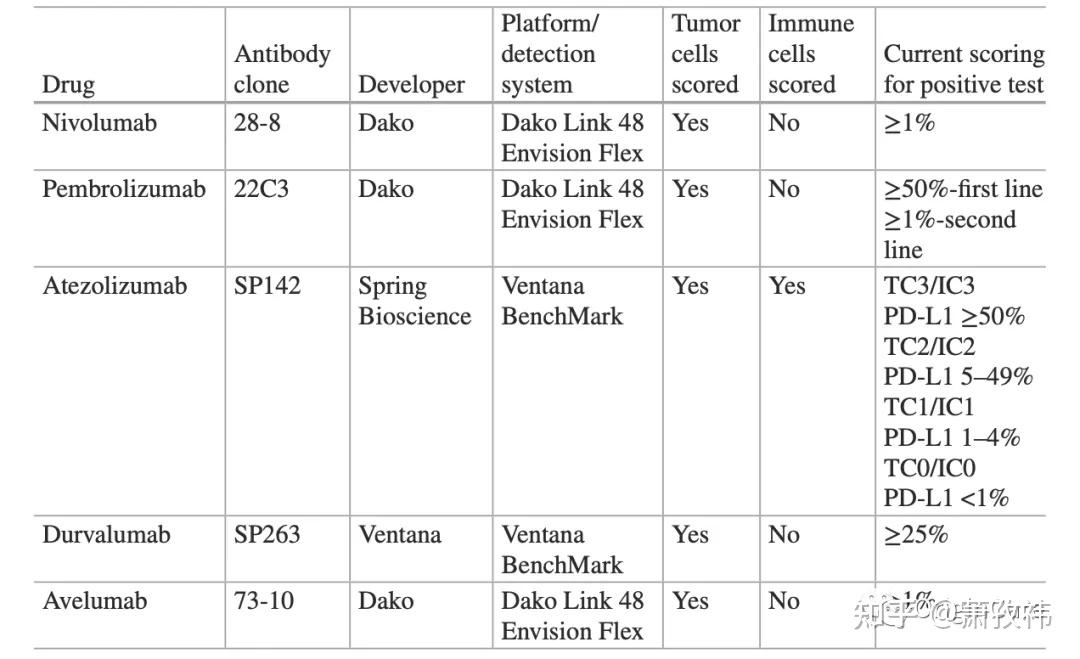
- 检测方法:IHC,因为检测的是蛋白表达水平,故只有此一种方法,但检测试剂多种多样,详见下图。相比于TMB,他的优势是价格便宜,但IHC的劣势是结果判断主管因素大,而TMB则更加数据化。如果PD-L1表达对免疫治疗预测的优势大于TMB,则其在临床上的竞争优势会更加明显。且目前来看,PD-L1的优势是大于TMB的。
- 药物举例:Pembrolizumab, Nivolumab | Ipillimumab, Carboplatin, Cisplatin, Pacilitaxel
其他分子标记物:
- FGFR1/2/3
- 变异类型:扩增,鳞癌较多
- 目前有多个靶点药物处于临床试验中,虽是靶点,但靶向性较差。
- PIK3CA
- 变异类型:突变,E542,E545突变较多。
- 为PI3K-mTOR-AKT信号通路的关键基因的亚蛋白,和KRAS等多种基因一样,广泛存在于各种细胞中,其作为药物靶点存在,毒性相必较大,如果选择下游mTOR作为靶点,专一性较差。
- PTEN
- 变异类型:缺失,鳞癌较多。
- 抑癌基因带给我的感觉是,预后差,无靶向药物(化学小分子药物),从原理上来说,难以实现,所以TP53等基因的药物开发转向了蛋白方向,或者针对表达的RNA进行药物开发。
- DDR2
- TP53,STK11等
- 变异类型:点突变,缺失。
- TP53基因普遍存在于许多肿瘤中,并且在正常细胞中扮演者重要的作用。在癌细胞中,有几个显著类型的突变,因为是抑癌基因,预后差,无靶点,且因为蛋白较小,KRAS蛋白也小,难以折叠成较为复杂的空间结构,预示着他和小分子的作用转一性较差。
目前,随着测序技术的发展,越来越多的突变基因及突变类型被发现,但多数仍无针对性的靶向药物或者基因的临床意义并未明确,比如突变引发的恶性程度,预后状况等,故目前,临床上仍无针对性的检测方案,多数基因检测公司都通过NGS判断突变,但映射到临床上,如何判断用药,指导预后,仍需很多工作。比如,如何有效的指导FGFR/1/2/3患者参与临床试验,根据信号通路给出的靶向PIK3CA下游的药物为何有理论上的有效性,是否真有临床有效性。一系列的临床研究工作仍需开展。
2、小细胞肺癌
NCCN指南在2020版中为列出Biomarkers。
一般而言,SCLC和NSCLC在基因突变类型上,无明显的相关性,几乎所有SCLC都伴有Rb基因的失活突变,并且TP53的突变频率较高。除此之外,一些染色体区域,比如染色体1,3q,5p,6p,12,14,17q,18,19,20拷贝数增加,3p,4,5q,10,13,16q,17p拷贝数降低,端粒酶活性也增加,预示着预后较差。另外,很多研究表明,c-kit,IGFR1,MYC,FGFR1,NOTCH家族,Hedgehog信号通路,EP300,FHIT,p16INK4,DNA修复基因等靶点的存在,鉴于临床对SCLC中此类靶点认知较为浅显,基因检测所能带来的帮助也是有限的。
SCLC的突变基因较多,突变类型多样化,并且多数突变基因为抑癌基因,如突变频率最大的Rb1和TP53,SCLC目前并无靶向药物,但BCl-2,MCL1,PMAIP1等与细胞凋亡相关的靶点未来可能会有靶向药物。

目前,针对血管生成相关信号通路,有一些研究在SCLC中开展临床试验,多为已经获批的其他癌症药物。如VEGFA靶点的药物贝伐单抗,VEGFR,BRAF等多靶点抑制剂索拉非尼等。但血管生成相关靶点药物,使用前,无需判断靶点状态,即无需通过PCR,NGS等方法的检测。
七、检测技术方法
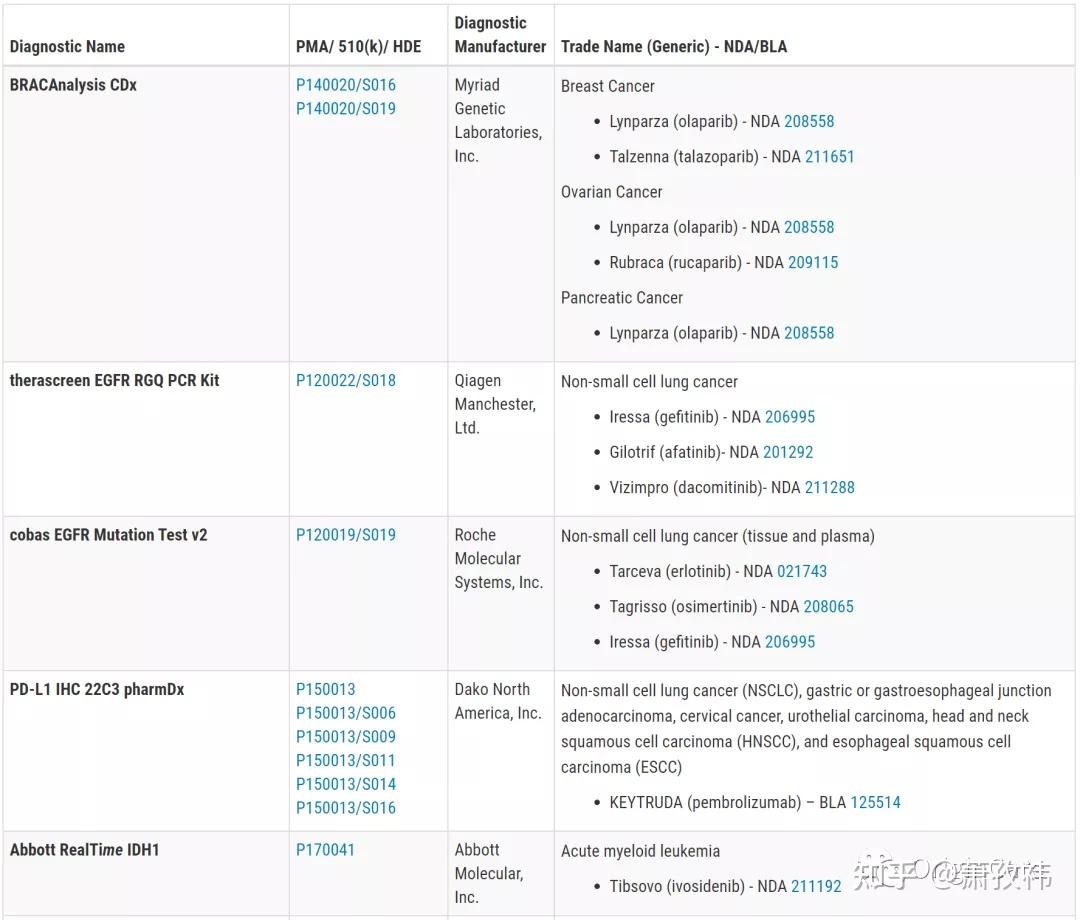
在实际临床应用中,NSCLC的基因检测,应根据检测样本类型(组织样本or血液样本or其他),DNA,RNA或者蛋白等条件,综合评估可以选择的检测方法。目前,临床应用较为广泛的仍是:基于PCR的方法,基于FISH的方法,基于IHC的方法(蛋白检测),基于NGS的检测方法。下表列出了FDA批准的针对肿瘤靶点的应用于临床的检测方法(囊括了以上四种,引自FDA)。
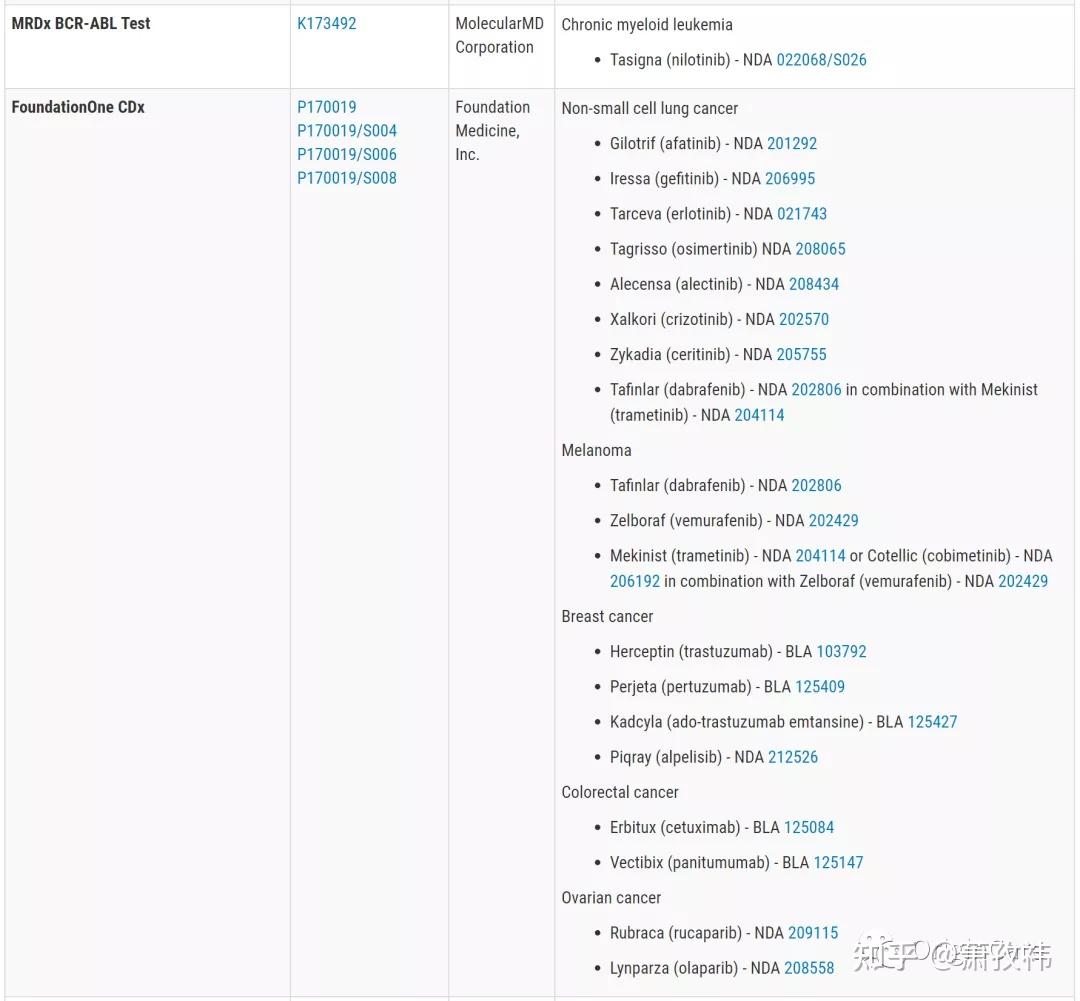
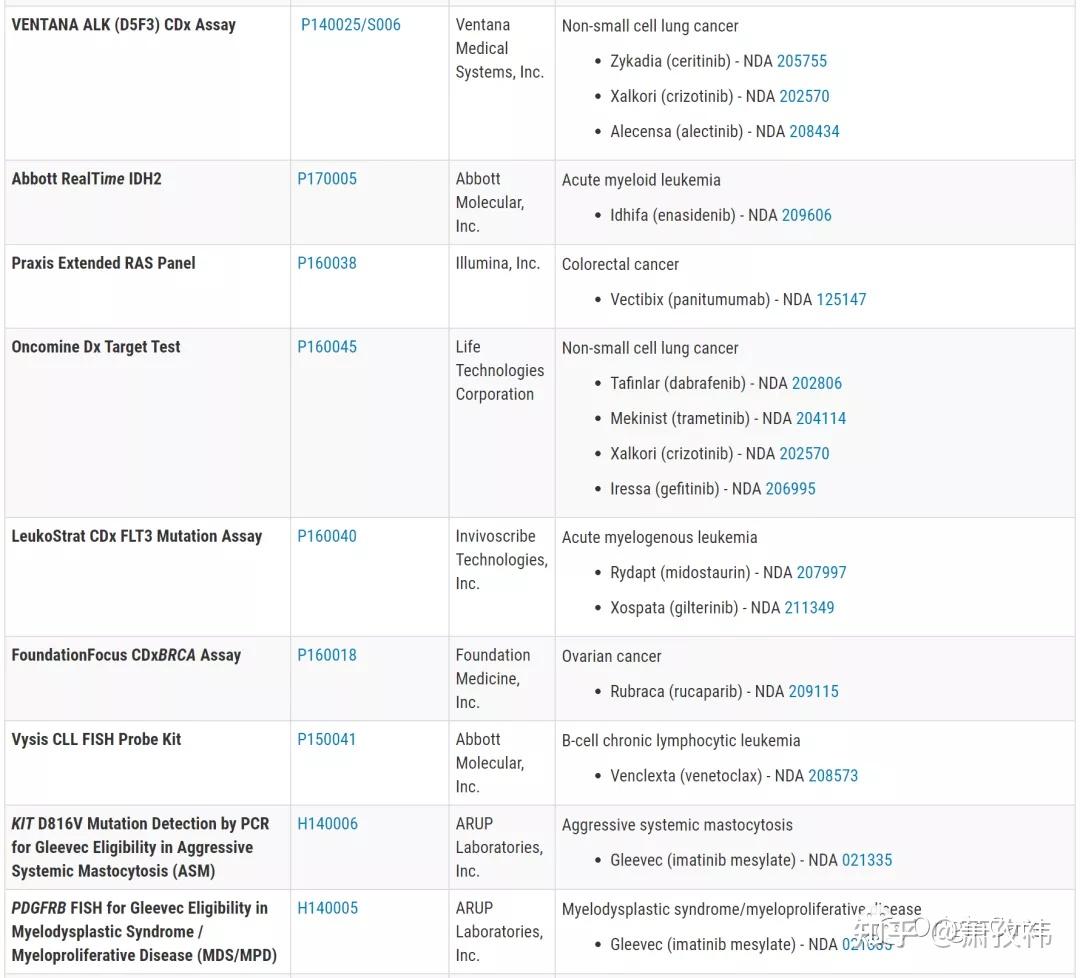
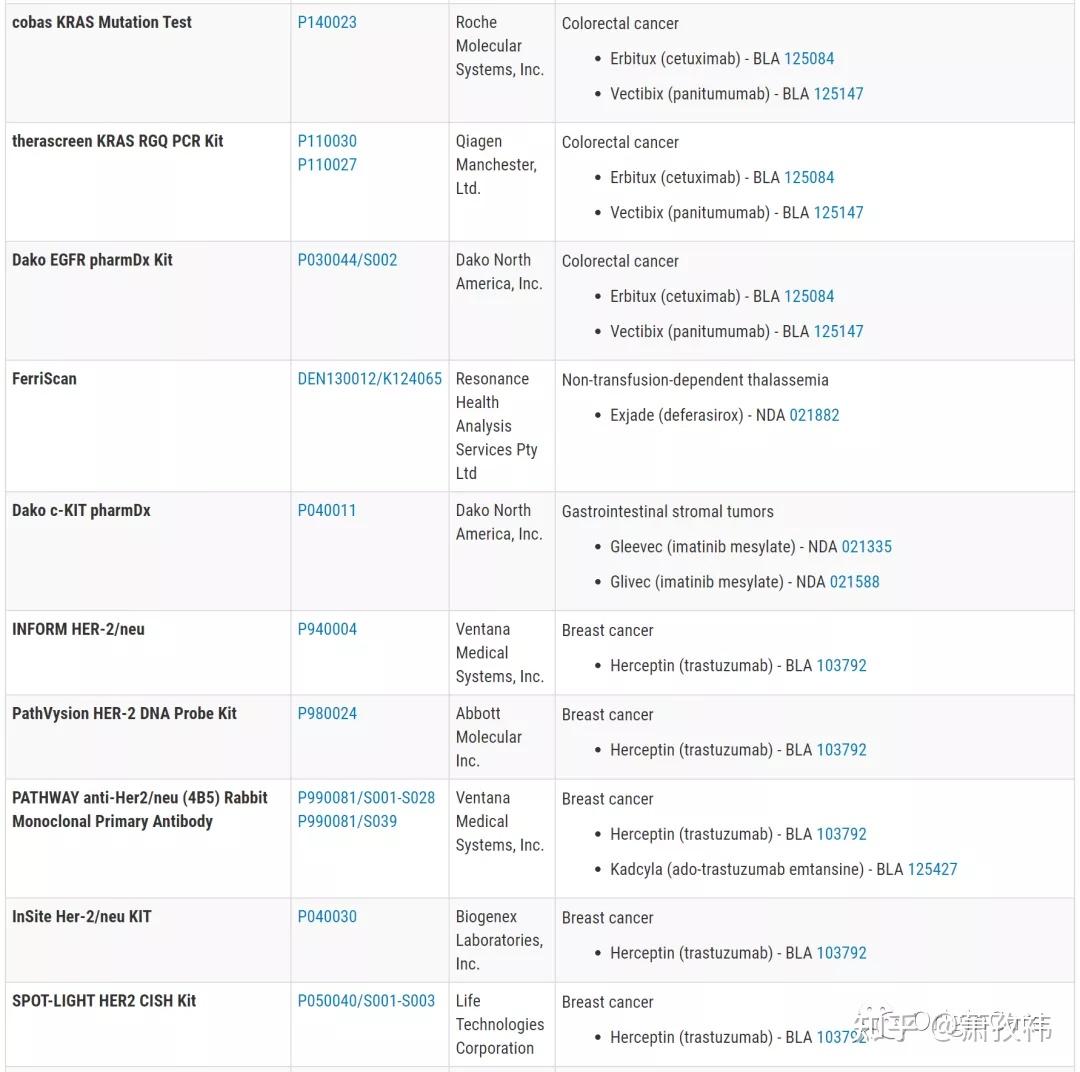
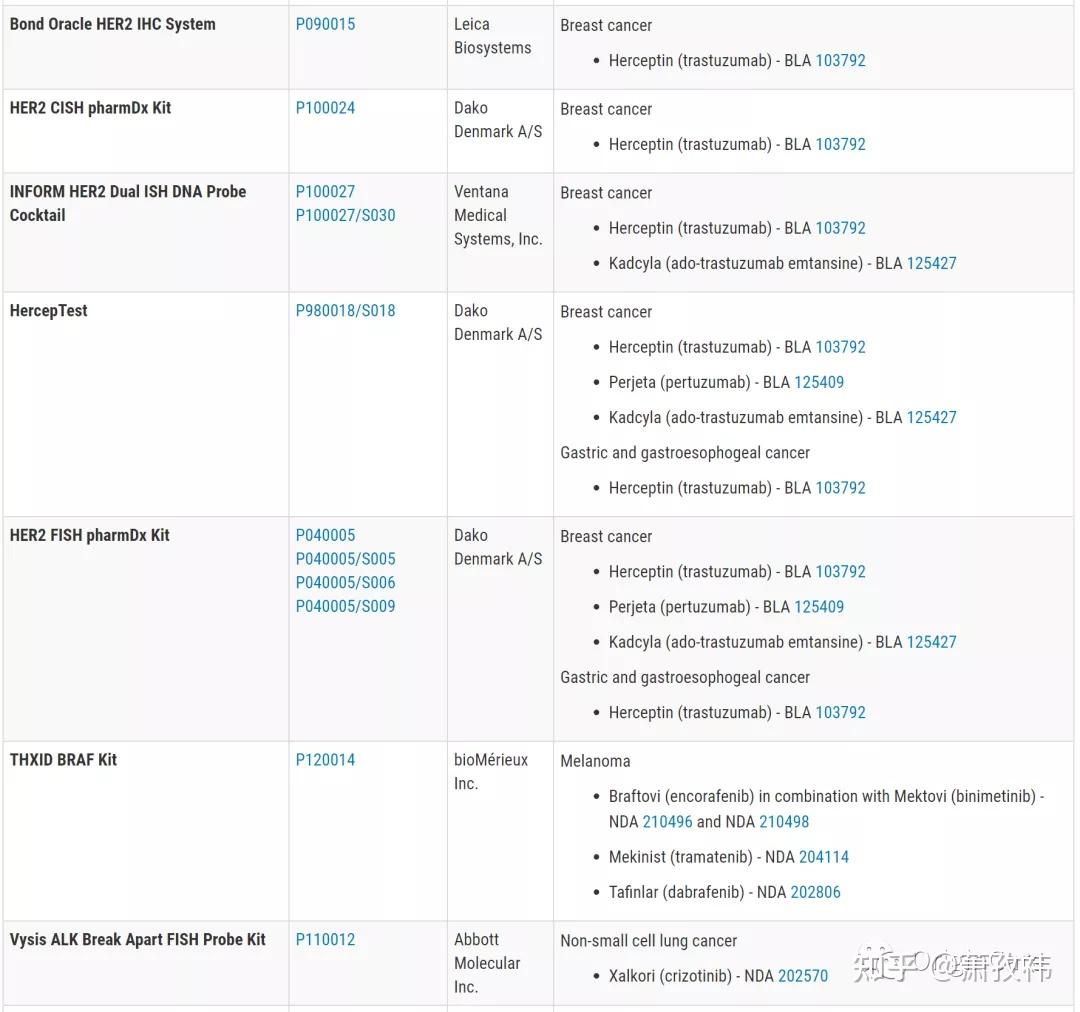
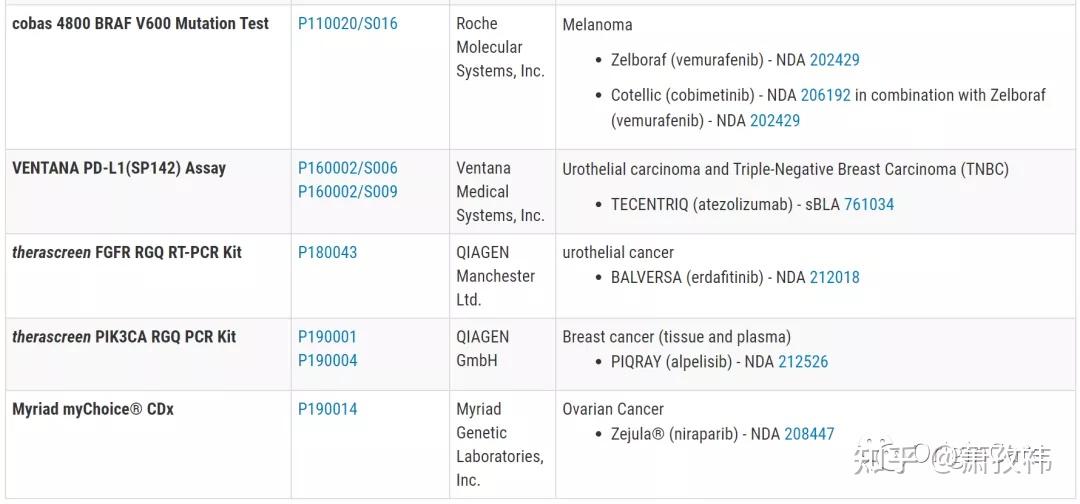
1、基于PCR的检测方法
对于明确的检测位点,可以选择PCR的检测方法,比如罗氏cobas EGFR mutation test,检测EGFR 19 exon缺失,L858R突变,用于指导erlotinib一线治疗转移性NSCLC。其优点是检测特异性较高,缺点是只能检测试剂盒设计的41个已知EGFR变异,无法检测未知变异位点。此类试剂盒还有Therascreen EGFR assay,以及ARMS-PCR等都是基于PCR技术的延伸。在国内,获批的试剂盒也较多,有单点的,也有多点的。下表列出了不同的PCR技术与之相对应的敏感性。数字PCR检测灵敏度较高,可用于血液中ctDNA单点突变的检测,如EGFR T790M耐药位点的检出和监测。
目前,基于PCR的检测方法,仍是许多检测手段的验证方法,比如NGS测序中的低频位点,仍需通过PCR的方法进行验证。
在NSCLC的基因图谱中,EGFR,KRAS,BRAF,ERBB2等常发生点突变和插入缺失的基因,可以选择用传统PCR的方法进行检测,目前,无论是FDA,还是NMPA,在EGFR检测上,都批准了很多用于突变检测的基于PCR技术的检测试剂盒。
2、基于FISH的检测方法
拷贝数扩增,基因融合仍采用FISH检测的方法,NGS为新技术,但FISH为金标准,NGS检测的位点仍需FISH验证。
FISH技术利用杂交的原理,用荧光染料标记探针DNA,变性成单链后与变性后的染色体或者细胞核特定的靶DNA序列杂交,通过荧光显微镜观测荧光信号位置,大小,数量,来判断序列,缺失,扩增及融合的情况。比如用于EML4-ALK融合的基因检测:分别设计两个探针,一个用来检测染色体2p23位点的ALK基因,另一个用来检测染色体2p21位点的EML4基因,可用来判断这两个基因发生融合的情况。如上表中Abbot的检测试剂盒。除ALK之外,ROS1的基因融合也会用FISH检测。贵。

3、基于IHC的检测方法
免疫组化是对蛋白的检测。可以用来检测EML4-ALK融合蛋白,HER2蛋白()等,但其灵敏性较差,即若EML4-ALK融合蛋白表达量低,即使提高IHC检测的灵敏性,也未必能检出融合蛋白。IHC的最大优点是便宜快速。目前,对PD-L1蛋白的检测,采用免疫组化的方法,FDA已经批准了多种抗体(见第五部分PD-L1药物与抗体检测表),因PD-L1基因和蛋白的不相关性,对PD-L1蛋白的检测,无替代性。若TMB被证实预测免疫治疗有效性更好,则灭掉PD-L1 IHC检测的,是“跨界”。
4、基于NGS的检测方法
NGS用于肺癌临床检测过程中,出现过很多模棱两可,夸大事实的产品推广。NGS检测项目的目的应当和临床更加明确的结合。比如,如果检测的目的是用来判断靶向药物的使用,那么检测结果该明确靶点靶点变异信息和对应的靶向药物治疗方案。在实际操作中,应明确列入肺癌检测项目的基因list,并明确临床意义,是用于靶向治疗,分子分型,疗效预测还是预后判断。因为NGS检测设计多种基因,并且同一基因的不用突变形式都可能被覆盖到,比如SNV,indel,SV,CNV等。对基因进行分类,比如引起肿瘤发生,转移,耐药的驱动基因,特异靶点上下游的关键突变基因。
基因数量的增加,引起了数据信息量的增加,进而增加了去伪存真的过程,比如无用信息的舍弃,有效信息的甄别等。在实际肺癌检测应用中,检测基因的数量的增加不应以增加检测的成本和检测后面临的负担。要明确不同基因在肺癌中所扮演的不同意义,有大有小,有的暂时无意义。
八、肺癌免疫治疗
在前面已有简单阐述,更详细内容,可参考文章:
以小见大 || 关于肿瘤免疫治疗,还有很多...
九、液体活检
循环肿瘤DNA(ctDNA)是从肿瘤细胞脱落进入机体循环系统的cfDNA,DNA可能通过从活的肿瘤细胞中以游离DNA的形式分泌到血液中,也可能存在于细胞衍生的囊泡中,被称为外泌体,或者肿瘤细胞坏死或者凋亡后会进入血液循环系统。进入血液循环系统中的DNA在血液中存在的时间较短,半衰期大约2小时,序列长度大概在180-200bp之间,因为肿瘤细胞的ctDNA中含有体细胞突变,故比较容易和cfDNA区分开,但即使恶性程度较高的肿瘤,释放了较多的ctDNA到血液中,其在cfDNA中的占比也大约只有1%左右。故不同患者的ctDNA差异较大。
在实际检测中,因为从患者血液样本中提取DNA进行检测分析,相比传统上的组织检测,具有无创的特点,并且更多的研究表明,肺癌组织中的基因突变和ctDNA之间存在关联性,因此,ctDNA作为组织检测的补充而更加具有优势,并且ctDNA也越来越在肺癌与研究中作为诊断和预后判断的工具。比如,他可以弥补肿瘤在时间和空间上的特异性,可以试试的监控患者的突变负荷。
因为ctDNA在血液中含量少的缘故,检测技术必须具有更高的灵敏性,常规的检测方法是NGS和数字PCR,数字PCR的灵敏度约为万分之一,并且准确性较高。但在临床端,目前,EGFR T790M位点的检测,国家已经批准了数字PCR平台做血液检测;但对于采用NGS方法检测血液样本,特别是检测基因数量为几百个时,其中的科研意义肯定是巨大的,但临床意义,现阶段,能解决的问题还是有限的。
液体活检何时【C位】出道
最后,梳理一个逻辑:
肺癌基因检测说的是,肺癌中非小细胞肺癌的基因检测,说的是非小细胞肺癌中几个Driver基因的基因检测;说的是非小细胞肺癌中几个Driver基因基于不同检测方法的基因检测。
肺癌基因检测 (宣传)> NSCLC基因检测 > NSCLC中Driver基因检测 > NSCLC中Driver基因不同检测方法的基因检测(现实)。
更多信息关注【基因APP】 |
|
 /3
/3 