登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
今天分享的文献是2024年3月发表在Science Advances(IF=11.7)杂志,题为”Modeling mechanical activation of macrophages during pulmonary fibrogenesis for targeted anti-fibrosis therapy”。这篇文章极具创新性,建立共培养的人巨噬细胞和成纤维细胞的纤维化微组织模型,研究吡非尼酮在使用预防性治疗、治疗性治疗和预处理三种不同的处理方式对巨噬细胞和机械活化的影响并阐明其机制。

一研究背景在纤维化肺组织中,由于收缩性肌成纤维细胞活跃的细胞外基质(ECM)重塑,过度积累的纤维性胶原经常排列成致密束。这种病理上的组织微环境也为嵌入细胞提供了地形线索,导至细胞功能的变化,如它们的形态和排列。为了简单起见,在体外产生的CD206阳性巨噬细胞通常被称为M2表型。吡非尼酮(PFD)是美国食品和药物管理局(FDA)批准的抗纤维化药物,作用于多种纤维化途径。PFD减少成纤维细胞增殖,抑制转化生长因子-β(TGF-β)途径。最近的研究表明,PFD还可以调节巨噬细胞的极化和纤维化活性,但由于这些研究是在动物模型中进行的,因此尚不清楚这些发现是否适用于人类。缺乏与人类相关的、模拟疾病的研究模型一直是抗纤维化药物开发的主要障碍之一。 二研究思路通过对人纤维化肺样本的组织学和单细胞测序分析,我们发现纤维化巨噬细胞在纤维化肺微环境中被机械激活。我们用共培养的人巨噬细胞和肺成纤维细胞的模拟巨噬细胞的纤维化微组织模型,原纤维化巨噬细胞被植入到这个组织中被机械激活,它们与胶原纤维和成纤维细胞的广泛共排列促进了肺微组织中广泛的纤维形成。PFD治疗破坏了M2巨噬细胞的极化和机械活化,导至纤维化抑制。我们发现PFD通过抑制整合素αMβ2(CD11b/CD18)和Rhoassociated kinase 2(ROCK2)来抑制巨噬细胞的机械激活,这是PFD的一个未知的作用机制。总之,这些结果揭示了一种以前未确定的机制,通过这种机制,机械激活的巨噬细胞在组织水平上促进肺纤维化。异质细胞力传感显微组织模型是研究免疫-基质细胞复杂相互作用和抗纤维化药物作用机制的有力工具。 三结果
1. 巨噬细胞对地形控制的组织重塑有机械反应 为了解巨噬细胞如何对纤维化肺组织中所见的重塑组织结构做出反应,研究人员创建具有控制形态和细胞与ECM对齐的工程微组织。将正常人肺成纤维细胞(NHLFs)与I型胶原混合,并将其植入微孔中,微孔中含有一组按拓扑模式排列的微柱。图案设计包括螺旋图案(图2A)、菱形图案(图2B)和方形图案(图2C),以模拟肺组织中的各种几何形状,如高度弯曲的肺泡壁。成纤维细胞产生收缩力,使胶原ECM紧贴微柱。作为成纤维细胞介导的ECM重塑的结果,形态学控制的微组织按照微柱阵列模式模板形成。微组织中的NHLF和胶原纤维沿着微柱边界条件定义的张力线强烈共排列。因此,控制细胞和ECM纤维排列提供一个机会来观察到组织地形的反应。接下来,将来自人外周血的单核细胞用白细胞介素-4(IL-4)和IL-13进行预极化,然后将其植入NHLF重建的显微组织中。这些M2巨噬细胞在48小时内粘附在显微组织表面,呈与胶原纤维和NHLF对齐的细长纺锤形形态(图2D至F、J、K)。共聚焦成像显示,巨噬细胞至少部分穿透微组织,并与周围的胶原纤维和NHLF在三维上相互作用,如胶原纤维和巨噬细胞重叠所示(图2G-I)。在沿螺旋形微组织高度弯曲边缘排列的细长巨噬细胞中检测到强表达整合素β2(CD18),提示巨噬细胞与周围胶原纤维和NHLFs之间的相互作用涉及机械转导。这些发现表明,M2巨噬细胞在纤维化样组织微环境中具有感知地形信号的能力,并根据这些信号动态调整其机械转导途径。
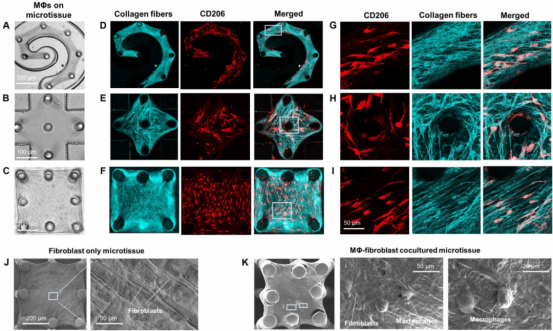
图2 巨噬细胞机械激活响应地形控制组织重塑 2. 巨噬细胞和成纤维细胞之间的广泛共排列促进了工程微组织中广泛的纤维化反应 接下来,研究人员试图探究在巨噬细胞-NHLF共培养的微组织中,纤维化巨噬细胞如何促进纤维化的形成。将纤维化的M2巨噬细胞引入到NHLF填充的微组织表面(图3A)。共培养3天后,在微组织中观察到α-SMA的高表达,表明NHLF激活到肌成纤维细胞(图3B)。M2巨噬细胞共培养的微组织中α-SMA的表达水平明显高于仅NHLF的微组织(4.7倍),但略低于TGF-β1处理的阳性对照(图3B-C)。由于分化的肌成纤维细胞已显示出产生高收缩力,研究人员使用原位微柱力传感器测量单培养和共培养微组织中产生的收缩力。与NHLF单独培养的微组织相比,M2巨噬细胞与NHLF共培养的微组织产生的收缩力高5.7倍(图3D)。当单核细胞或巨噬细胞单独接种胶原基质时,它们不能致密化胶原并形成微组织,这表明这些细胞缺乏收缩力的产生。与收缩力测量类似,巨噬细胞-成纤维细胞共培养的微组织上清中活性TGF-β水平高于NHLF单培养的微组织(图3E),提示旁分泌TGF-β信号在巨噬细胞介导的组织纤维化中的潜在作用。由于早期研究表明巨噬细胞对成纤维细胞的激活主要发生在近距离,因此我们在共培养的微组织中检测两种细胞的作用情况。在高显微镜分辨率下可观察到单个巨噬细胞接近和/或直接接触肌成纤维细胞(图3F)。TGF-β免疫染色显示TGF-β信号与CD206共定位,而与α-SMA不共定位,提示这些TGF-β由巨噬细胞分泌并沉积到ECM中(图3G)。
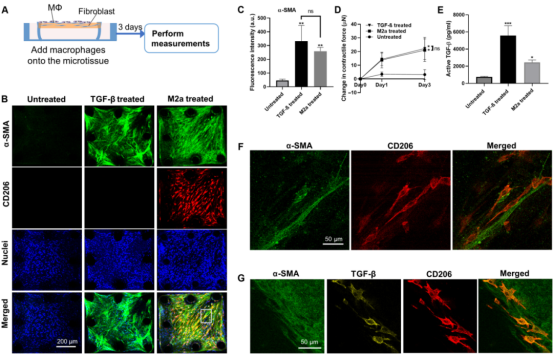
图3 巨噬细胞和成纤维细胞之间广泛的共排列促进了微组织中广泛的纤维化反应 3. PFD抗纤维化治疗对巨噬细胞诱导的纤维化有作用 PFD和尼达尼布是FDA批准的治疗肺纤维化的唯一药物,两者在纤维化组织中的作用模式和细胞靶点都不明确。研究人员构建的巨噬细胞-NHLF共培养微组织(MaFiCo)是研究抗纤维化药物作用的一个很好的纤维化模型。作为一种范例药物,研究人员将PFD应用于我们的显微组织模型,使用(i)预防性治疗,(ii)治疗性治疗和(iii)预处理。这些不同方案的目的是研究PFD在没有预先存在的纤维化状况(预防性治疗)或预先存在的纤维化状况(治疗性治疗)下的作用。在预防性治疗中,将PFD与巨噬细胞一起引入到NHLF填充的微组织中,并在共培养中维持3天(图4A)。与未处理的对照组相比,在浓度为10和1000 μg/ml时,预防性PFD治疗显著降低粘附的巨噬细胞数量(图4B-C),NHLFs中α-SMA表达量分别降低80%和95%(图4B和D),微组织收缩力分别降低90%和144%(图4E)。10 μg/ml的PFD对培养上清中的活性TGF-β没有明显抑制作用,但在1000 μg/ml的浓度下,活性TGF-β水平降低62%(图4F)。这些结果表明,在临床相关浓度(10 μg/ml)下,预防性PFD治疗已能有效抑制几种促纤维化因子。在最高浓度为1000 μg/ml时,PFD几乎完全消除巨噬细胞对微组织表面的粘附、NHLF中α-SMA的表达(图4B)、ECM中沉积的TGF-β和微组织中纤维连接蛋白的表达。在这种情况下,少数剩余的巨噬细胞表现出超细长的形状,这与未经治疗的对照组的纺锤体形状明显不同(图4B)。由于在预防性治疗中,微组织不具有预先存在的纤维化特征,这些结果表明,破坏巨噬细胞对微组织的粘附抑制纤维化的发展。
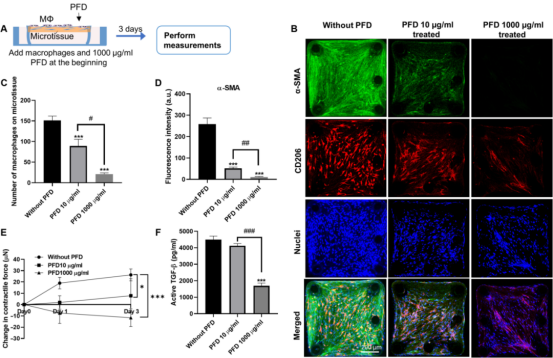
图4 预防性抗纤维化治疗对共培养微组织的影响 在治疗方案中,巨噬细胞与NHLF共培养3天形成纤维化微组织,然后再引入PFD 3天(图5A)。与未处理的对照显微组织相比,PFD治疗仅适度减少附着的巨噬细胞数量(40%)(图5B-C),NHLFs中α-SMA表达(47.5%)(图5B和D),以及上清中活性TGF-β水平(图5F)。PFD处理下显微组织收缩力的变化不显著(图5E)。此外,PFD处理导至粘附的巨噬细胞形态从纺锤形到丝状,发生显著变化(图5B),这在预防性治疗中可以看到。然而,与预防治疗相比(图4C),治疗治疗中更多的巨噬细胞仍然粘附(图5C)。
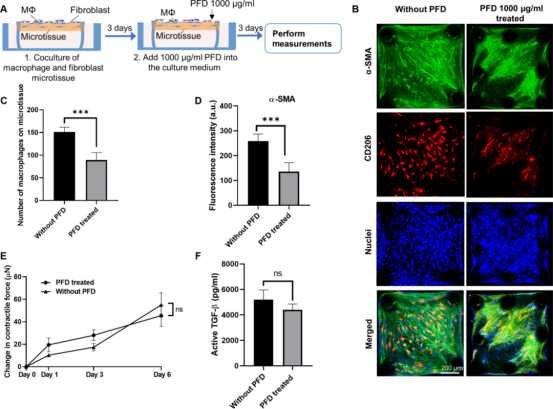
图5 治疗性抗纤维化治疗对共培养微组织的影响 由于PFD治疗同时影响巨噬细胞和NHLF,研究人员接下来用PFD预处理巨噬细胞,以消除其对这两种细胞类型的影响。首先用巨噬细胞集落刺激因子(M-CSF)处理人外周血源性单核细胞,然后加入PFD处理24小时,再用IL-4/IL-13诱导M2极化24小时(图6A)。在诱导的M2极化过程中加入PFD可以抑制CD206的表达,并以剂量依赖的方式降低巨噬细胞单培养上清中的活性TGF-β水平,而不影响细胞活力或塑料培养皿上的粘附。然后将这些预处理的巨噬细胞接种到NHLF填充的微组织中,并在不进一步添加PFD的情况下维持。共培养3天后,在10和1000 μg/ml的PFD预处理下,粘附的巨噬细胞数量分别减少59%和72%(图6B-C),NHLFs中α-SMA的表达分别减少80%和93%(图6,B和D),显微组织收缩力分别减少100%(图6E),活性TGF-β水平分别减少了35%和50%(图6F)。综上所述,这些结果表明PFD既抑制巨噬细胞诱导的M2极化,也抑制巨噬细胞粘附于NHLF填充的显微组织的能力。由于这两种功能都与巨噬细胞介导的纤维化有关,PFD可能作用于巨噬细胞,影响它们对纤维化过程的贡献。
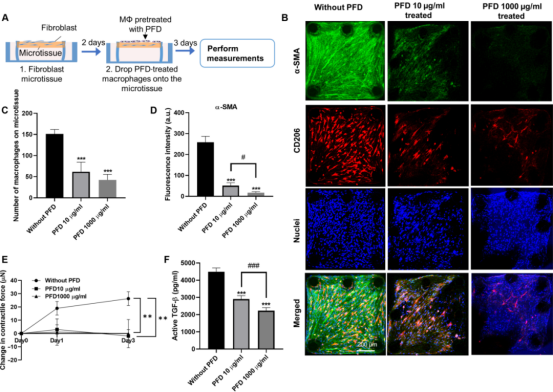
图6 抗纤维化预处理对共培养微组织的影响 4. PFD通过抑制ROCK2和整合素αMβ2抑制巨噬细胞的机械活化 PFD治疗降低巨噬细胞在显微组织上附着、排列和扩散的能力,这些都是依赖于细胞粘附的细胞功能。反过来,M2极化已被证明需要强粘附和细胞内细胞骨架重组。同时,研究人员在已发表的IPF患者肺巨噬细胞scRNA-seq数据集中发现与机械转导过程相关的上调基因,如细胞-基质粘附、整合素介导的信号传导和细胞运动(图1)。在这些基因中,RAS同源家族成员A(RHOA),ITGAM和高度上调的基因都与细胞-基质粘附和整合素介导的信号传导密切相关。因此,一研究人员将重点放在RhoA相关通路、αM整合素和β2整合素上,以研究PFD是否通过作用于巨噬细胞的机械感知和激活来抑制纤维形成。Rho相关激酶ROCK1和ROCK2是RhoA的主要下游效应物,ROCK2在抗纤维化药物KD025的临床试验中被用作治疗靶点。共培养微组织中ROCK2免疫染色显示,ROCK2主要在M2巨噬细胞中表达。在预防和治疗两种治疗方案中,PFD治疗导至ROCK2表达分别降低65%和74%(图7A-C)。接下来,用ROCK2特异性抑制剂KD025处理共培养的微组织,以确定对巨噬细胞机械激活的抑制是否是ROCK2特异性的。结果显示,KD025在预防性和治疗性治疗中分别导至ROCK2表达降低39%和21%(图7A-C),同时粘附的巨噬细胞数量显著减少(预防性75%,治疗性67%)(图7D-E),巨噬细胞形态从纺锤形转变为丝状,活性TGF-β显著降低(预防组62%,治疗组15%)(图7F-G)。为确定上述作用是否对巨噬细胞具有特异性,研究人员在硅胶基质(刚度为4 MPa)上对单培养M2巨噬细胞进行PFD和KD025处理。如附属图所示,PFD处理和KD025处理显著降低ROCK2的表达,同时巨噬细胞数量减少,活性TGF-β减少40%和35%,表明ROCK2途径的抑制是M2巨噬细胞特异性的。接下来,研究人员检测αM和β2整合素在共培养显微组织中的表达。免疫染色显示这些整合素仅在M2巨噬细胞中表达。在预防和预处理方案中,PFD治疗导至αM和β2整合素亚基的表达分别减少64%和83%(图7H-I)。为确定这种作用是否对巨噬细胞具有特异性,对单培养的M2巨噬细胞进行PFD治疗。在单一栽培中,PFD处理也显著降低αM和β2整合素的表达。由于RhoA/ROCK信号通路影响整合素的表达,研究人员也使用KD025处理M2巨噬细胞单培养。KD025抑制ROCK2显著降低αM和β2整合素的表达。综上所述,PFD对巨噬细胞包括ROCK2、αM和β2整合素在内的机械转导通路具有抑制作用,其作用与ROCK2选择性抑制剂KD025相似。
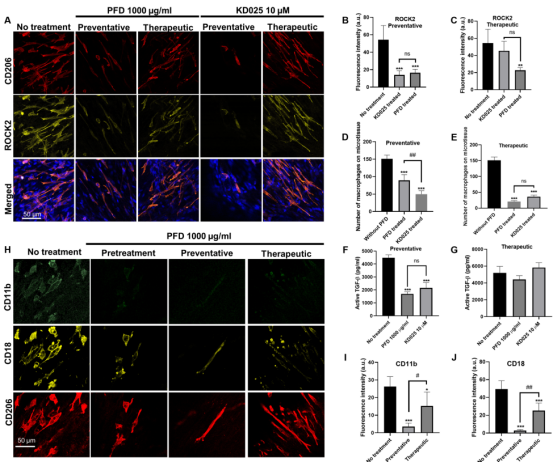
图7 PFD通过抑制ROCK2和整合素αMβ2抑制巨噬细胞的机械活化
|  /3
/3 