金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
肝脏在代谢、内源性和外源性底物的生物转化以及外源性微生物的解毒中发挥着核心作用。解剖学上,肝脏内主要有四种类型的细胞:肝窦内皮细胞(LSEC)、库普弗细胞(KC)、肝星状细胞(HSC)和肝实质细胞(HC)。2015年,来自德国Jena University Hospital的研究人员报道了一种嵌入微流体支持的生物芯片中的三维肝脏类器官的建立。研究人员使用新鲜分离的人脐静脉内皮细胞代替肝窦内皮细胞,利用单核细胞来源的巨噬细胞模拟库普弗细胞的功能,永生化的人类星状细胞系LX-2作为主要的星状细胞替代物。在生物芯片的培养过程中,HepaRG细胞持续分化为表现出干细胞表型的细胞和具有胆管上皮细胞的表型,这些细胞自组织成肝细胞层,在肝细胞样细胞间具有功能性胆管。相关研究成果以《A microfluidically perfused three dimensional human liver model》为题发表在Biomaterials杂志上。
如图所示,研究者在芯片上模拟了人体肝窦结构,在膜两侧分别模拟血管和肝细胞层并种植对应细胞,膜用作两个细胞层的基质,将它们彼此分离的同时模仿Disse空间(SD)。
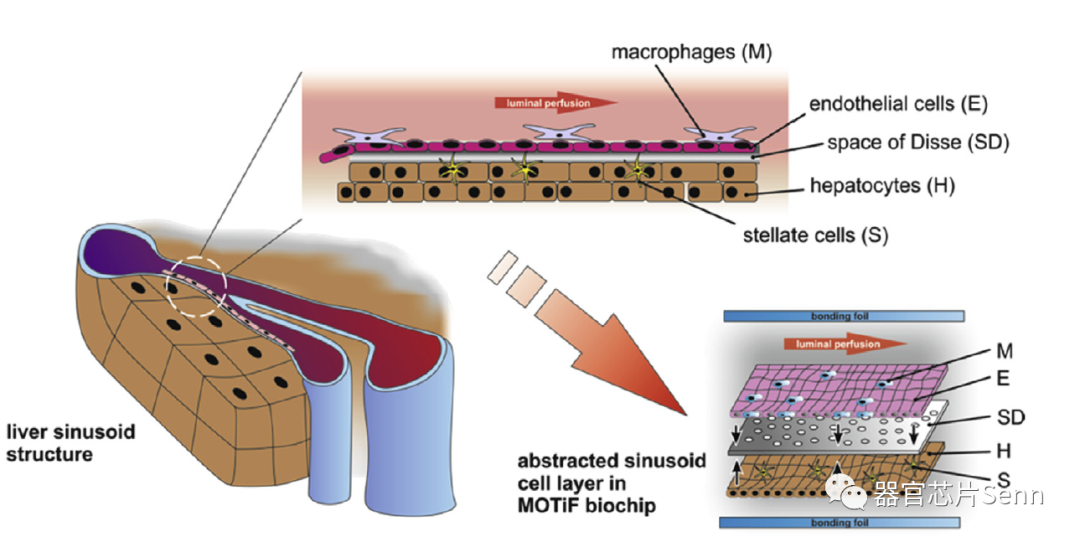
多层肝类器官中人肝窦的体内形态的适应
在血管细胞层,HUVEC与巨噬细胞共培养。在肝细胞层,由分化的HepaRG肝细胞样细胞和LX-2星状细胞共培养。在共培养的条件下,细胞色素P450酶的表达情况有所改善。
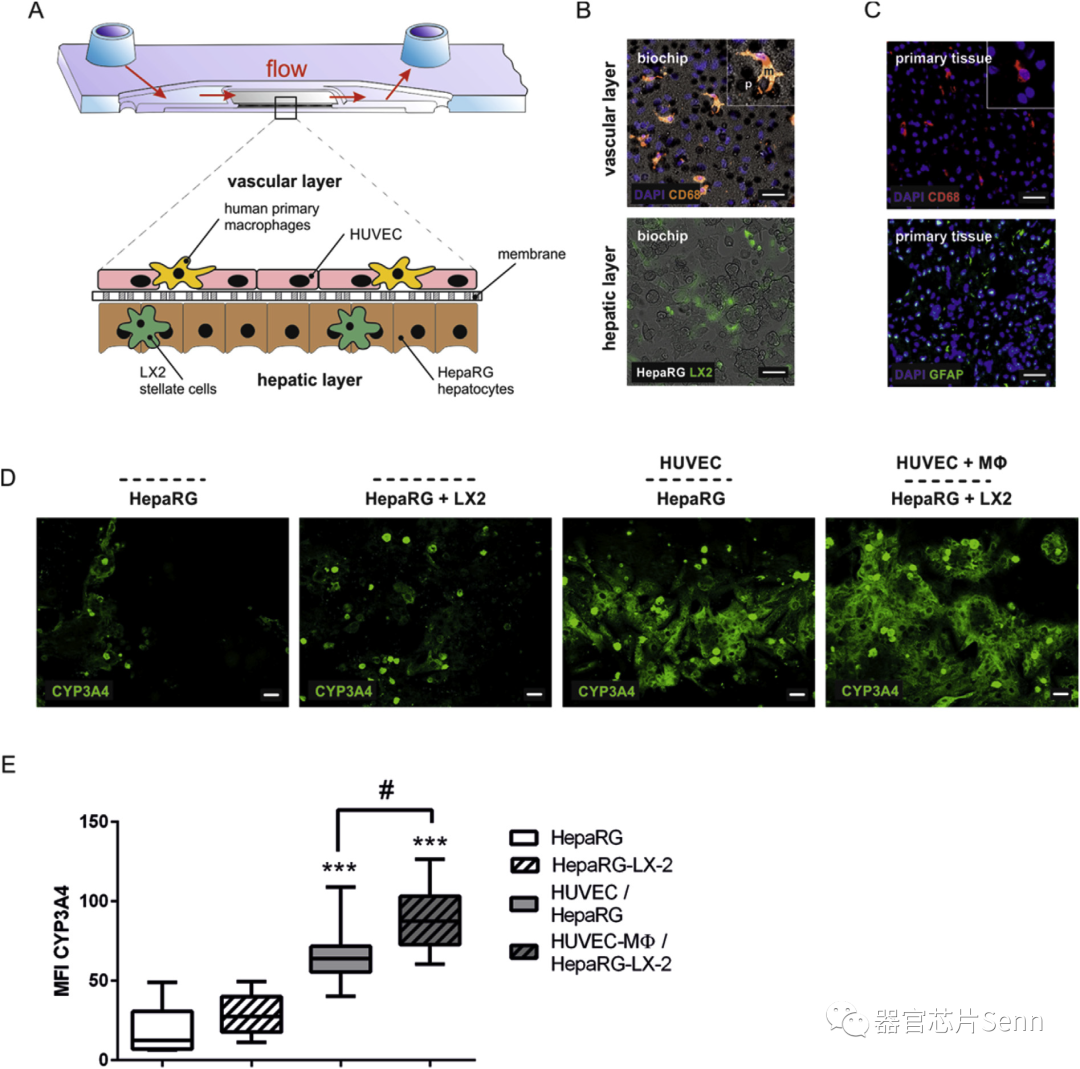
在微流控生物芯片中建立三维肝脏模型
培养基的氧饱和度作为调节肝细胞代谢能力的关键参数,为了对细胞培养过程中氧水平进行非接触式实时测量,研究者将基于发光的传感器点集成到生物芯片的入口和出口处。
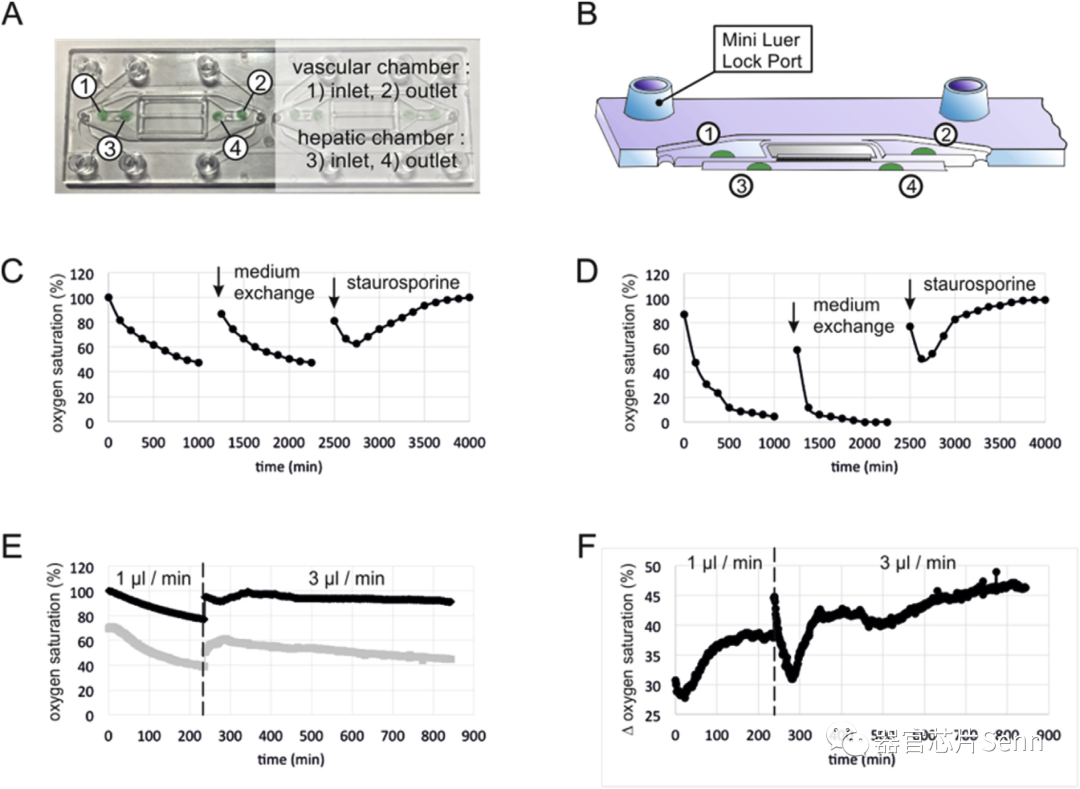
通过荧光发射传感器点测量细胞培养基中的氧饱和度
此外,研究者通过测量HepaRG细胞的细胞内ATP和ADP含量,解决了含氧量正常和缺氧条件下培养基灌注对细胞能量水平的影响。在肝脏类器官的静态和灌注培养物中,发现ATP水平在缺氧条件下显著降低。
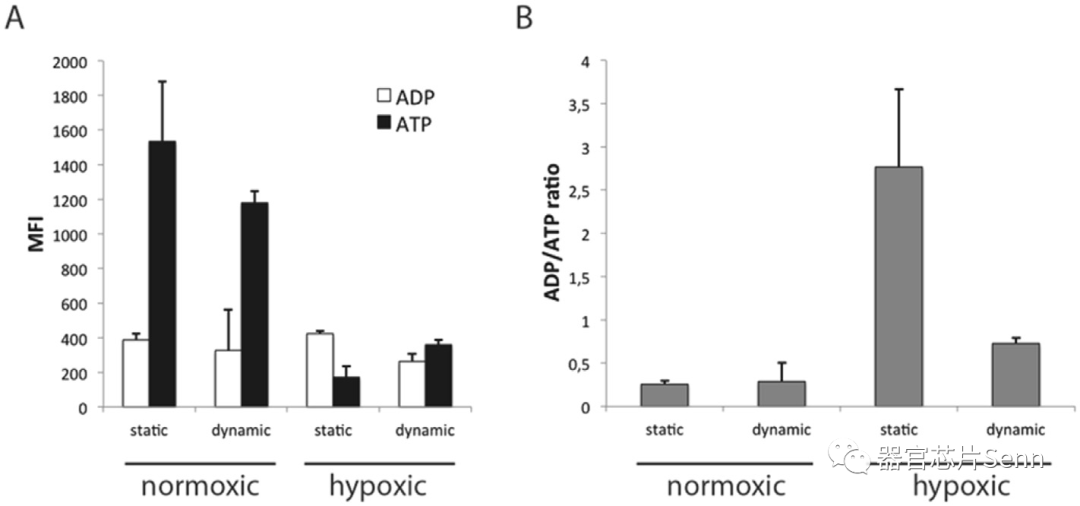
在静态和动态培养条件下,在 MOTiF 生物芯片内膜的相对侧与 HUVEC 细胞层共培养 4 天的 HepaRG 细胞层的细胞 ADP 和 ATP 含量
肝细胞的适当极化是功能活跃的肝胆小管形成的先决条件,代表了HepaRG细胞系的一个重要特征。因此研究者对各种肝分化和极化标记蛋白的表达和定位进行了染色,如ASGPR-1、ZO-1、MRP-2、CDF等。
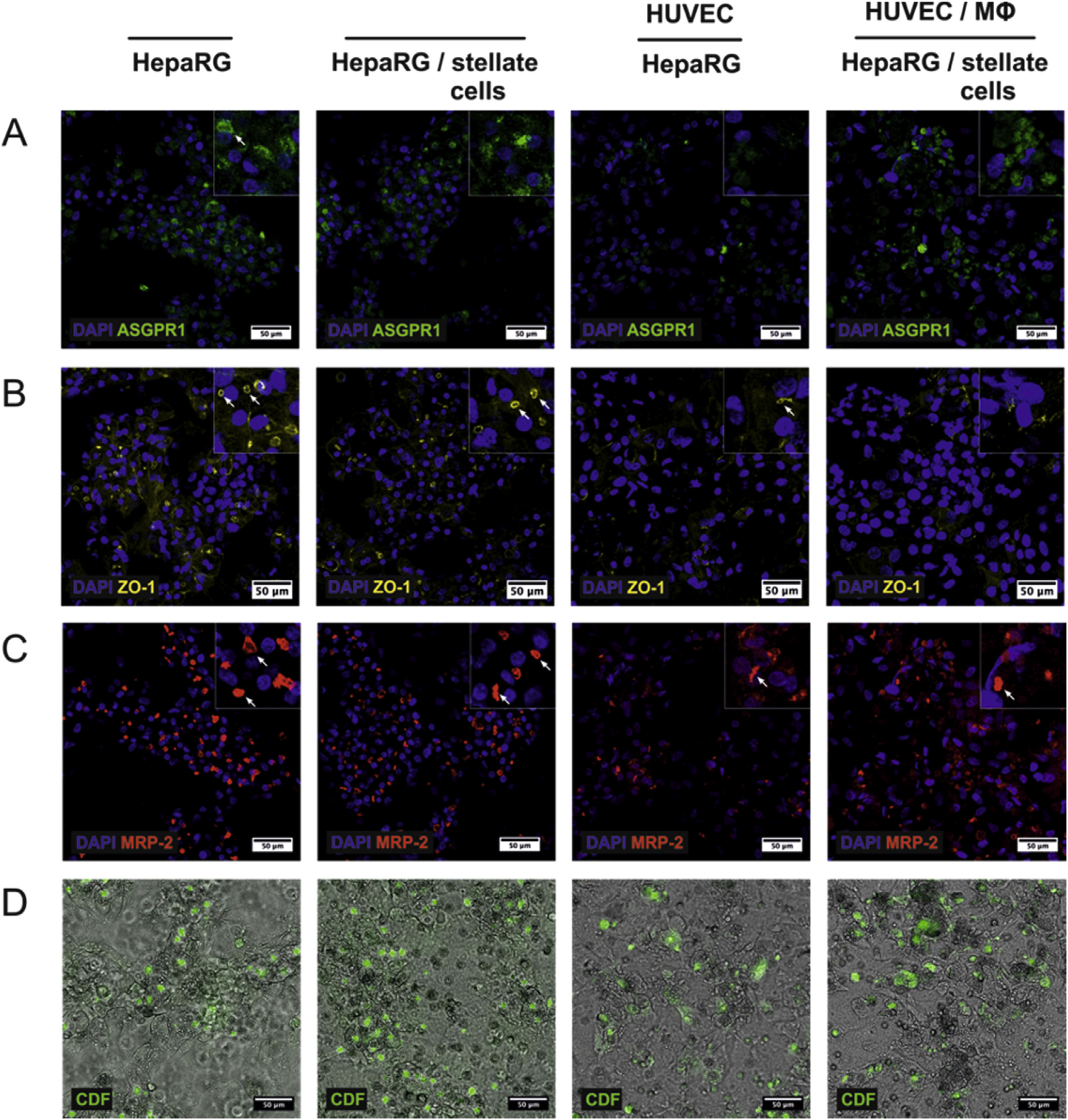
在肝脏类器官的逐步组装过程中,HepaRG细胞层中特定标记物的免疫染色
随后,研究者观察了在静态和灌注培养下动态灌注对肝脏类器官血管层中EC极化的改善,并且比较了动态和静态培养条件下相关蛋白表达水平的变化。

MRP-2位于肝细胞的微绒毛上,当通过扫描电子显微镜将灌注的肝脏类器官与静态组织培养物进行比较时,灌注培养下的HepaRG细胞表现出更高的可塑性和更高的微绒毛密度。接下来,研究者讨论了血管灌注过程中整个肝脏类器官的细胞耗氧量。与观察到氧饱和度快速下降的静态培养相反,50 ml/min的血管灌注足以为肝脏类器官的血管细胞层提供稳定的氧气供应。
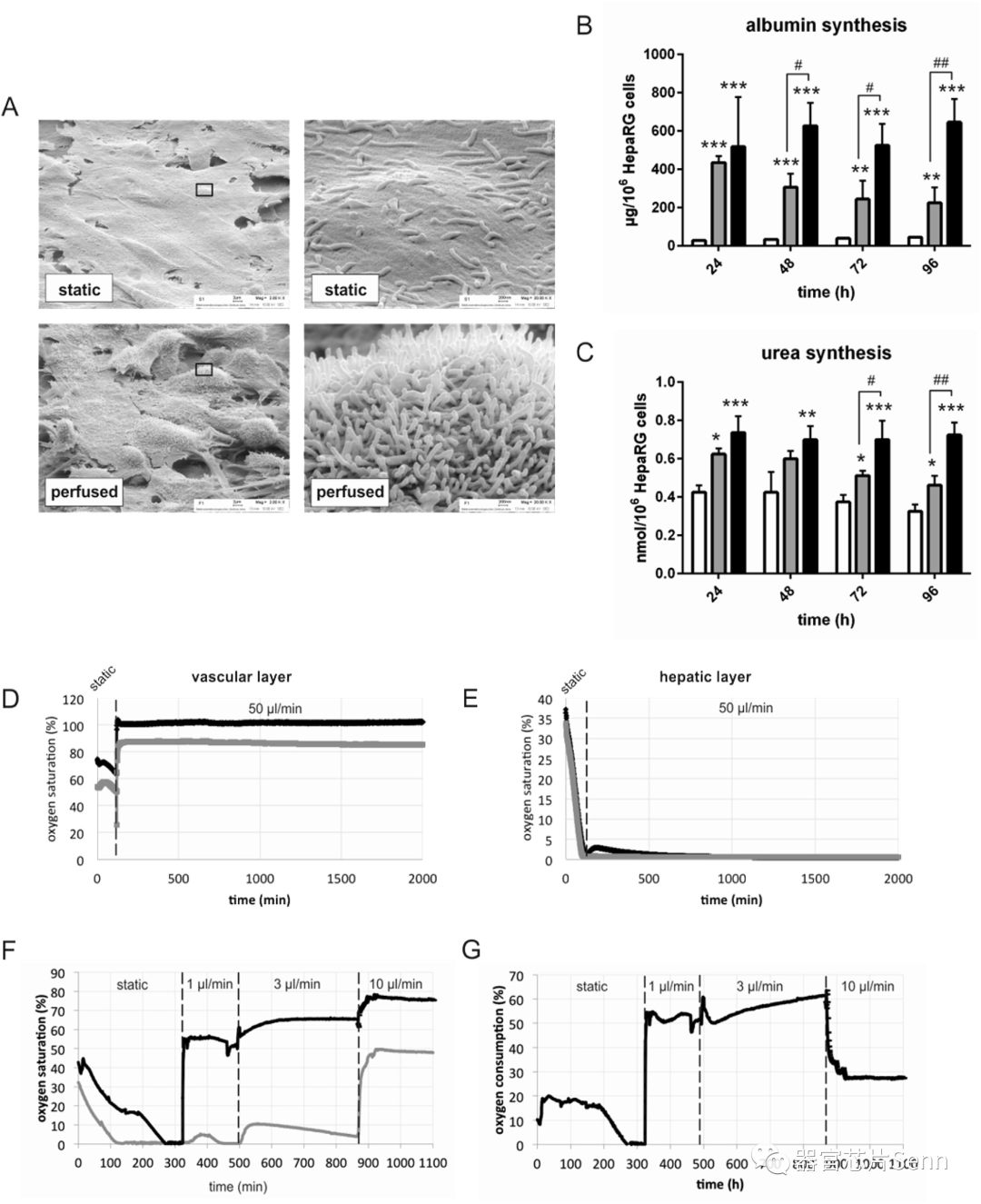
静态和动态培养条件下肝脏类器官微观结构和耗氧量的比较
本研究建立了包含所有主要肝细胞类型的功能性肝脏类器官,肝脏模型显示出明显的分化和结构重组,与体外原代人肝组织非常相似。这种肝脏模型为在细胞水平上研究肝脏生理学、新陈代谢和潜在分子过程提供了宝贵工具,为毒理学和药理学筛选奠定了基础,另外,此模型也非常适合研究特定基因和蛋白质在肝功能中的作用。
参考文献:
Rennert K, Steinborn S, Gröger M, Ungerböck B, Jank AM, Ehgartner J, Nietzsche S, Dinger J, Kiehntopf M, Funke H, Peters FT, Lupp A, Gärtner C, Mayr T, Bauer M, Huber O, Mosig AS. A microfluidically perfused three dimensional human liver model. Biomaterials. 2015 Dec;71:119-131. doi: 10.1016/j.biomaterials.2015.08.043. Epub 2015 Aug 25. PMID: 26322723. |
|
 /3
/3 