金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
一、实验目的
1. 检测生物样品中抗体、抗原、蛋白质和糖蛋白等物质的含量。
2. 药物药效学评价、筛选。
二、ELISA实验原理
酶联免疫吸附测定(Enzyme-Linked Immunosorbnent Assay,ELISA)是免疫学和分子生物学中广泛使用的实验室技术,由Eva Engvall和 Peter Perlmann 于1971年首次描述。该测定依赖于抗原-抗体相互作用的原理,并利用酶和比色检测来量化目标分子,主要用于检测和量化生物样品中特定蛋白质、肽、抗体或抗原的存在。ELISA测定通常应用于各个领域,包括临床诊断、药物研究和生命科学基础研究。
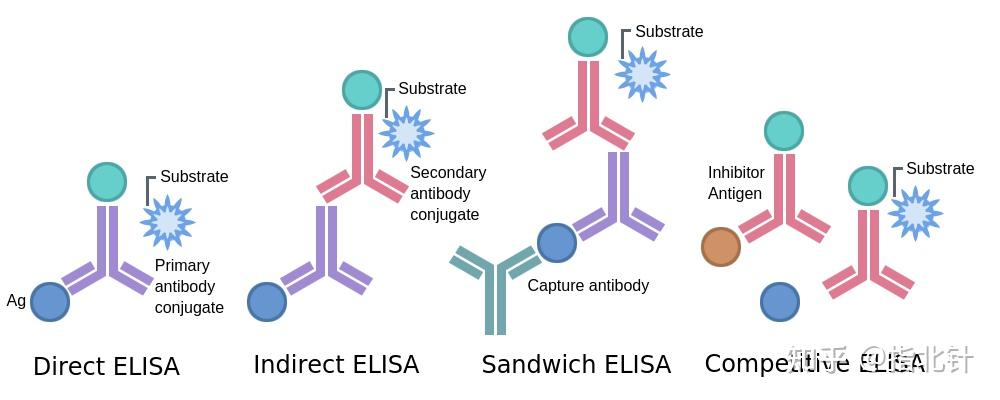
图1 ELISA原理图及分类 源自Excedr官网
在实际应用中,通过不同的设计,具体的方法步骤可有多种:
直接ELISA:抗原通过一段时间的孵育被动地附着在塑料固相载体上,经过简单的洗涤后,通过添加与酶共价连接的抗体来检测抗原。孵育和洗涤后,通过添加色原/底物使酶活性产生颜色变化来显色。在规定的时间后通过化学手段终止酶活性后读取显色情况。在分光光度计中读取颜色。该方法相对简单,但它在灵敏度方面可能存在局限性,特别是当抗体-抗原相互作用相对较弱时。
间接ELISA:间接ELISA是在直接ELISA的基础上添加酶标二抗进行检测。抗原通过孵育被动附着到孔上,洗涤后,将抗原特异性抗体(一抗)与抗原一起孵育。 清洗孔并通过添加与酶共价连接的抗物种抗体(二抗)来检测结合的抗体。二抗对于产生所添加的第一抗体的物种具有特异性。
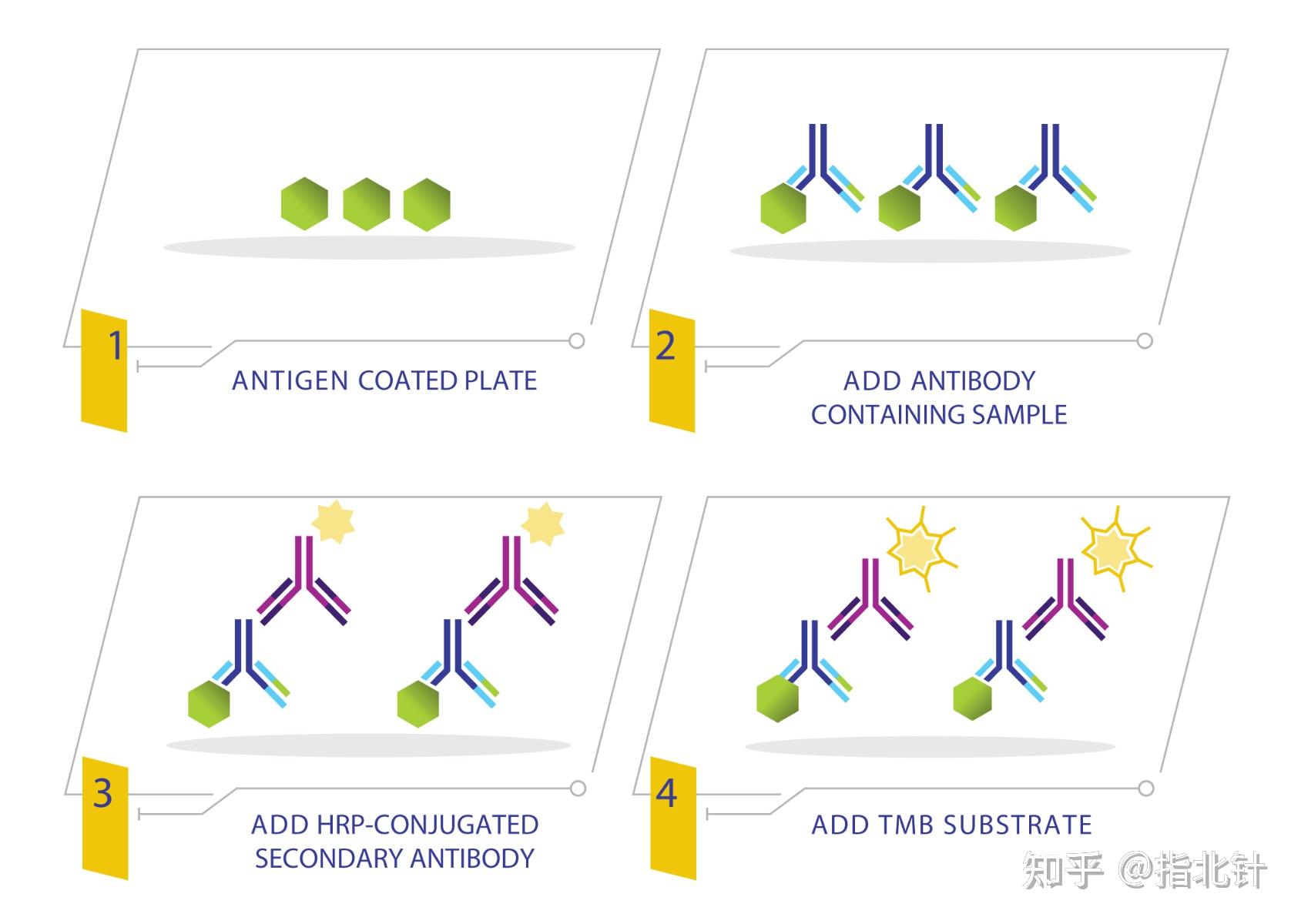
图2 间接ELISA步骤 源自RayBiotech官网
夹心ELISA:将捕获抗原的抗体(捕获抗体)附着在固相载体上,洗掉多余的未结合抗体后,添加抗原并被特异性捕获,通过直接ELISA或间接ELISA的形式检测抗原。这种组合进一步提高了检测的灵敏度和特异性,是最常见的ELISA实验形式。
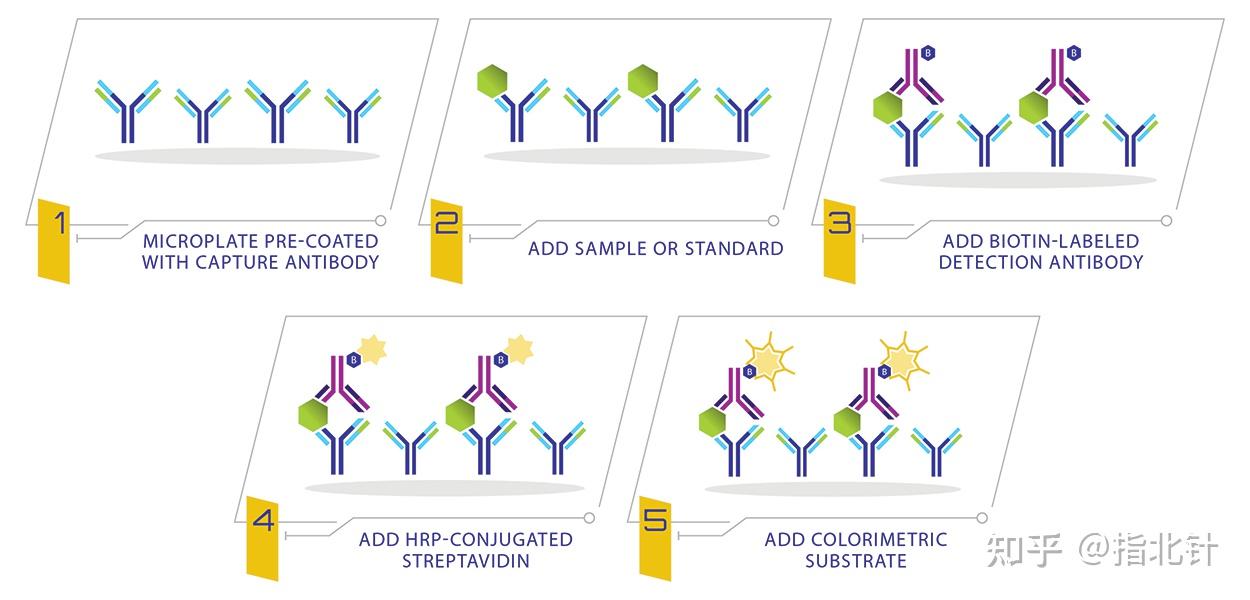
图3 夹心ELISA步骤 源自RayBiotech官网
竞争性ELISA:在竞争性ELISA中,固定量的标记抗原与样品抗原(样本)竞争与固定化抗体的结合。信号与样品中抗原的浓度成反比。
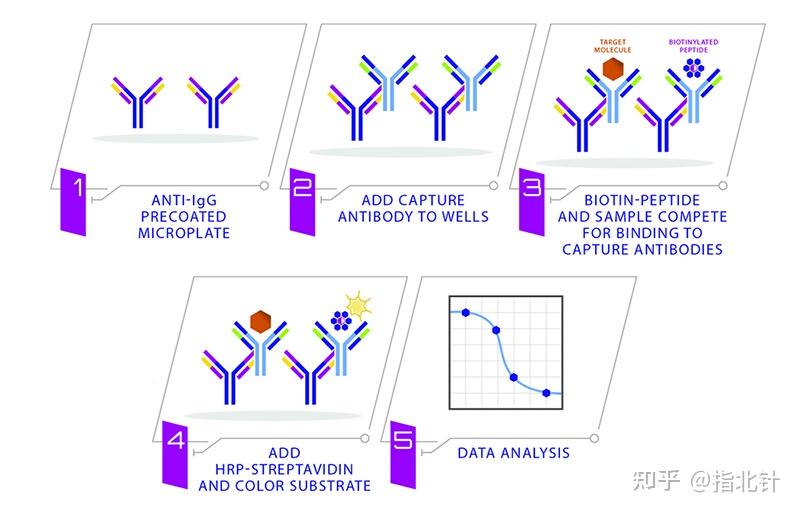
图4 竞争ELISA分类及步骤 源自RayBiotech官网
三、仪器和试剂
ELISA试剂盒(本文以人IL-2作为检测对象举例说明)、细胞培养瓶、细胞计数仪、台式离心机、CO2培养箱、倒置显微镜、移液器、多通道移液器、移液管移液器、10μL-1000μL移液器吸头、酶标仪、去离子水。
若无试剂盒则还需要:微孔板条、IL-2抗体(捕获抗体)、偶联生物素的抗人IL-2抗体(检测抗体)、链霉亲和素-HRP(HPR,辣根过氧化物酶)、包被缓冲液、洗涤缓冲液、样品稀释液、四甲基苄啶溶液(TMB,显色液)、硫酸溶液(终止液)、人IL-2蛋白标准品、PBS、吐温-20、牛血清蛋白(BSA)、透气封板膜。
四、实验步骤
1. 样品准备
a. 细胞上清样品,需将培养瓶内的细胞消化离心取上清即可(如800g,5分钟)。
b. 血清样品,将全血收集至不含抗凝剂的试管内,在室温下放置1小时,待全血自然凝固并析出血清后,4℃约1500g离心10分钟,取黄色上清即得血清。
c. 血浆样品,将全血收集至含抗凝剂的试管内,混匀后置冰上,4℃约1500g离心10分钟,取黄色或淡黄色上清即得血浆。
2. 确定样品测试组、标准品和空白组组所需的微孔条数量,每个浓度做两个平行重复,从支架上取出对应数量的微孔条,剩余储存在箔袋中,密封后在4℃储存。
3. 配制对应浓度的捕获抗体溶液、检测抗体溶液、包被液、洗涤液、样品稀释液、显色液、终止液、链霉亲和素-HRP(若使用试剂盒则没有此步骤或按试剂盒要求配制)。
4. 每孔加入100μL 捕获抗体溶液,用封板膜覆盖,4℃孵育过夜,过夜后舍弃舍板内溶液。
5. 每孔加入300-400μL洗涤液清洗五次,且最后一次置于厚吸水纸上拍干(若使用试剂盒则没有步骤4和5)。
6. 用样品稀释液按照1:5, 1:10, 1:50, 1:100, 1:1000, 1:2000稀释样品,以此确定样品IL-2的最佳检测浓度。
7. 配制梯度浓度的IL-2蛋白标准品,将工作浓度设置为1200pg/mL, 600pg/mL, 300pg/mL, 150pg/mL, 75pg/mL, 37.5pg/mL, 18.75pg/mL,9.38pg/mL,以此浓度来绘制标准曲线。
8. 分别将样品、标准品、样品稀释液按照100μL/孔加入相应孔中作为标测试组、标准品组、空白组。
9. 将偶联生物素的抗人IL-2抗体按照50μL/孔加入所有孔中,用封板膜覆盖,室温避光孵育2小时。
10. 每孔加入300-400μL洗涤液洗板五次,且最后一次置于厚吸水纸上拍干。
11. 在所有孔加入100μL稀释后的链霉亲和素-HRP,用封板膜覆盖,室温避光孵育1小时。
12. 每孔加入300-400μL洗涤液洗板五次,且最后一次置于厚吸水纸上拍干。
13. 在所有孔中加入100μL TMB显色液。用封板膜覆盖,室温避光孵育30min。
14. 在所有孔中加入终止液50μL,混匀后立即测量A450值。
15. 计算每一组重复的标准品和样品的平均吸光度值。重复次数应在平均值的20%以内。
16. 绘制IL-2标准品标准曲线。以标准品浓度为横坐标,A450值为纵坐标,以平滑线连接各标准品的坐标点。通过样品的吸光度值和标准曲线计算出样品的相应浓度。
17. 结果示例图:
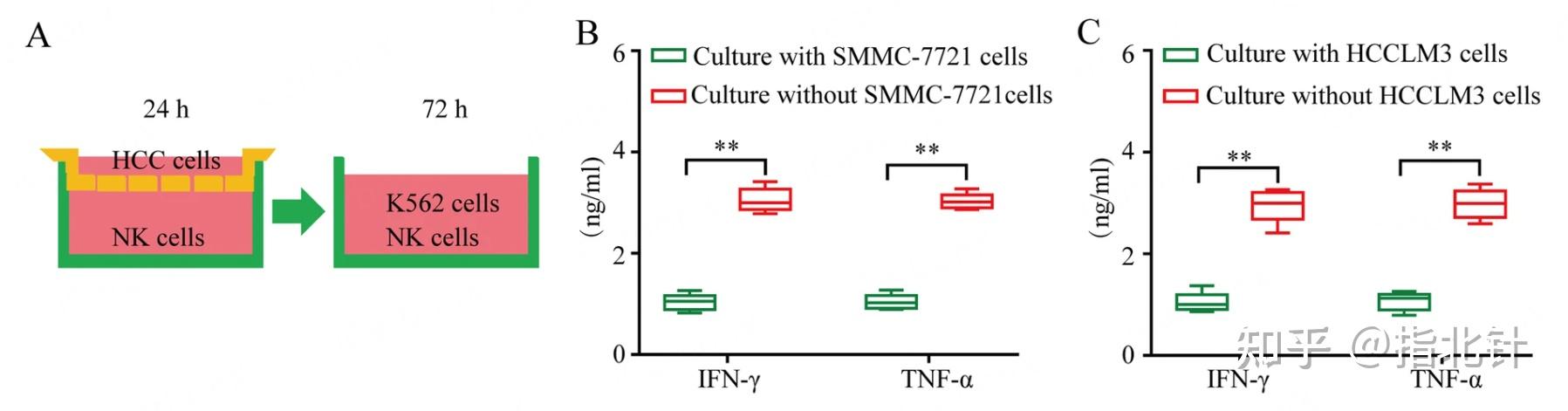
图5 不同实验条件处理后的NK细胞产生的IFN-γ和TNF-α含量对比[1] Zhang PF, Mol Cancer. 2020;19(1):110. Published 2020 Jun 27. doi:10.1186/s12943-020-01222-5
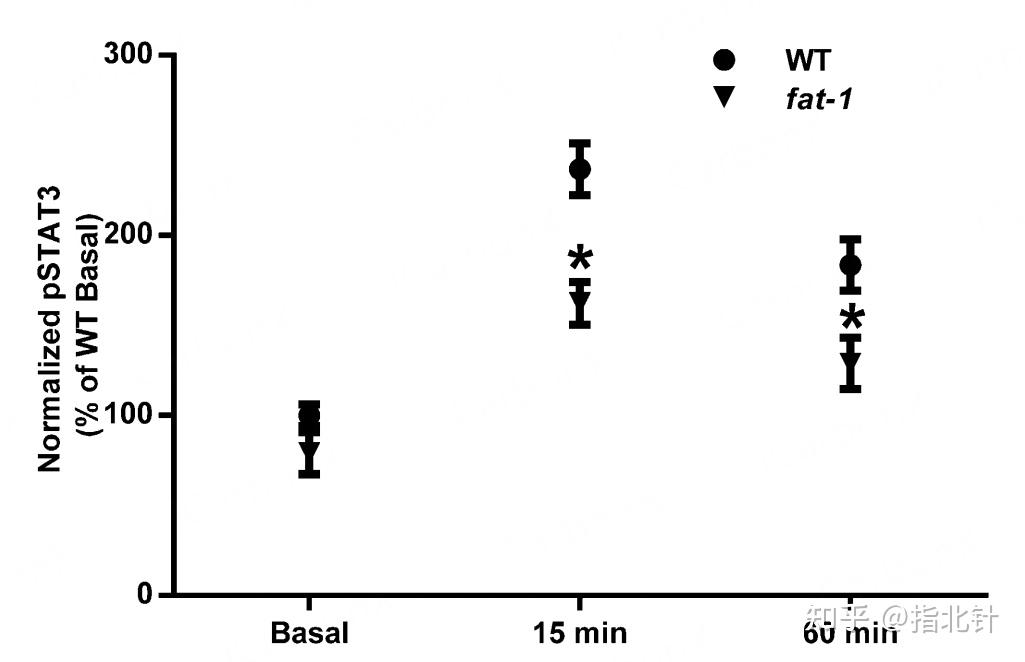
图6 不同模型小鼠体内在不同时间的磷酸化STAT3的表达水平[2] Allen MJ, J Nutr. 2014;144(8):1306-1313. doi:10.3945/jn.114.194407

图7 左图为免疫小鼠血清中抗sFGL1抗体的滴度,右图为小鼠腹水中2D7和4G7的抗体滴度[3] Zhang X, Front Immunol. 2021;12:670626. Published 2021 Apr 23. doi:10.3389/fimmu.2021.670626
五、注意事项
1. 对于血清样本不要剧烈摇晃以免溶血,且不能添加任何防腐剂或抗凝剂。在吸取时注意不要吸取白色或淡黄色沉淀,制备好的血清需置于冰上待用。
2. 若待测样品不能及时检测,样品制备后请分装,冻存于-20℃或-80℃,并注意避免反复冻融。所有样品应清澈透明,检测前样品中如有悬浮物应通过离心去除。不能使用溶血、高血脂或污染的样品检测,否则结果将不准确。
3. 对于血清或血浆样品,可以加入50μL样品分析缓冲液后加50μL样品;如稀释比例大,将样品与样品分析缓冲液等量加入,不足部分用标准品稀释液补充至100μL。请注意记录好样品的稀释倍数。
4. 请先查阅相关文献确定样品中待检测蛋白的大致浓度,如果该浓度大于或者小于检测限,请适当稀释或浓缩后再进行检测。
5. 如果是手洗板,注意洗涤液不要溢出孔外,以免污染相邻的孔,特别是每次洗板的前两遍,若高浓度的孔污染了低浓度的孔或空白孔,会造成背景值增高。
6. 特别注意:设计实验的时候要考虑实验孔的位置,保证甩掉洗涤液时,空白孔、低浓度孔或阴性对照组在上面或一侧或分开最好。同时注意甩掉洗液的动作翻转(从正上方旋转120-150度)要迅速、干脆。甩板不要手腕左右摇摆、旋转来甩液体!甩出后以直线方式补2-3次甩出液体。
7. 拍干最好用干净的吸水纸、滤纸或无尘布,不要用卫生纸,因为细小粉尘或者碎屑容易吸附到孔底,导致洗板不干净,结果偏高或偏低,重复孔的数值也会相差很大
8. 复孔的吸光值通常在20%的差异范围内结果才有效,复孔平均值可作为测量值。
9. 每个标准品或样品的吸光度值应减去本底校正孔的吸光度值(如果没有做校正孔,则不需要减去)。
10. 实测数据会因试剂盒供应商、试剂供应商、实验条件、检测仪器等的不同而存在差异,因此每次实验都要重做标准曲线,供应商给提供的标曲用作辅助参考(如图9)。

图8 三家不同供应商IL-2 ELISA试剂盒提供的IL-2蛋白标准曲线
11. 若样品OD值高于标准曲线上限,应适当稀释后重新测定,计算浓度时需注意乘以样品的稀释倍数。
12. ELISA结果图有多种展现形式,不拘泥于一种,选择合适的风格即可。
六、参考文献
[1] Zhang PF, Gao C, Huang XY, et al. Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma. Mol Cancer. 2020;19(1):110. Published 2020 Jun 27. doi:10.1186/s12943-020-01222-5
[2] Allen MJ, Fan YY, Monk JM, et al. n-3 PUFAs reduce T-helper 17 cell differentiation by decreasing responsiveness to interleukin-6 in isolated mouse splenic CD4⁺ T cells. J Nutr. 2014;144(8):1306-1313. doi:10.3945/jn.114.194407
[3] Zhang X, Zhu H, Zheng X, et al. A Double-Antibody Sandwich ELISA for Sensitive and Specific Detection of Swine Fibrinogen-Like Protein 1. Front Immunol. 2021;12:670626. Published 2021 Apr 23. doi:10.3389/fimmu.2021.670626
声明:本文章重在分享科研方法、资讯、传播知识。如有错漏之处,还请同仁指正。文章不构成任何投资建议,也非临床预防、诊断、治疗建议。未经许可严禁商业性转载,非商业性转载请注明出处。
原文地址:https://zhuanlan.zhihu.com/p/670961506 |
|
 /3
/3 