金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
在研究细胞和细胞器的复杂结构以及研究细胞生物过程时,电子显微镜是必不可少的。胶体金及其各种衍生物一直是生物电子显微镜中应用最广泛的抗原标记物。这些颗粒可以附着在包括抗体、凝集素、超抗原、聚糖、核酸和受体等许多传统的生物探针上。由于大小不同,这些颗粒在电子显微镜下很容易区分,从而允许同时进行多次标记实验。1971年,胶体金作为一种特殊的标记物首次被引入透射电子显微镜(TEM)。然后在1975年,Horisberger和他的同事开发了用于扫描电子显微镜(SEM)的胶体金法,并于1979年用于荧光显微镜。1979年报道了用X射线绘制金粒子图。
在SEM中,胶体金法已被用于标记许多细胞,包括酵母、红细胞、血小板、肝细胞和乳脂球。SEM的一个优点是人们可以观察到相对较大的区域的细节(图 1)。与其他传统的SEM标记不同,金标记是二次电子的良好发射器,这使得观察者能够在没有金属涂层的细胞表面定位金颗粒。目前最方便的金标记物尺寸约为50 nm,不过也发现了小到Au22的颗粒。
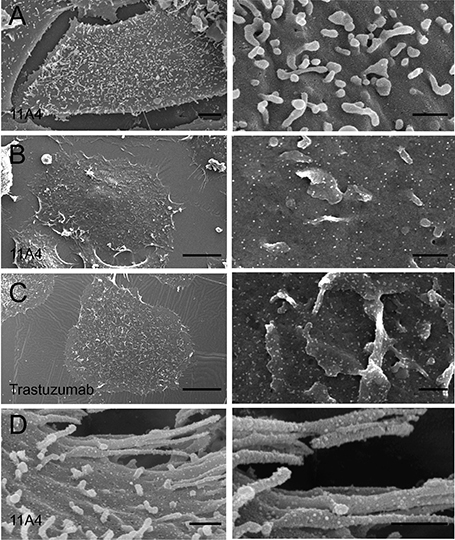
图 1 :SKBR3细胞中HER2纳米免疫金标的预包埋SEM。无论(A)是否与抗HER2纳米体(B, D)或抗HER2抗体曲妥珠单抗(C)一起孵育,SKBR3细胞都被固定。在冷鱼明胶和乙酰化牛血清白蛋白的混合物中进行免疫标记。随后,用二抗和15 nm的蛋白A偶联金颗粒孵育细胞。按照材料和方法中描述的方法,对样品进行临界点干燥和电子显微镜检查。刻度:左图:A:1µm,B, C:0.5µm,D:0.2µm;右面板:A:250 nm,B-D:100 nm。
在TEM中,由于它们对电子的不透明性和它们的特征形状,可以很容易地识别金标记物。此外,粒径的选择取决于所使用的放大倍率和考虑结合位点的位阻不可达性。Au5和 Au20颗粒是最常用于标记病毒、细菌、酵母、植物细胞和各种动物细胞的颗粒(图 2)。
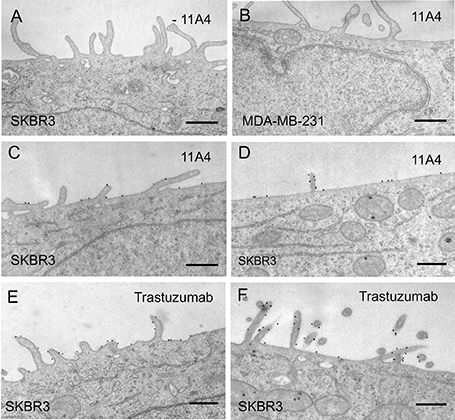
图 2:SKBR3细胞中HER2免疫金标的预包埋纳米体TEM。SKBR3或MDA- MB-231细胞用4%(w/v)甲醛固定,并进行免疫标记处理。作为阴性对照,省略一抗(A)或使用缺乏HER2表达的MDA-MB-231细胞(B)。SKBR3细胞在(C, E)或(D, F)甲醛固定后与抗HER2纳米体11A4(VHH)(C, D)或曲妥珠单抗(mAb)(E, F)孵育。尺度= 500 nm。
免疫电子显微镜是检测和定位细胞和组织中蛋白质的最佳方法之一。这种方法几乎可以应用于每一种单细胞和多细胞生物,通常可以在结构和功能的关联之间提供意想不到的见解。结合金颗粒的一抗的应用允许对细胞上和细胞内的多种抗原进行高分辨率的检测和定位。但免疫电镜的成功应用是由以下因素决定的:1)蛋白质抗原性的保存;2)抗体浸润整个细胞的能力;3)抗原和一抗之间识别的特异性。此外,需要对生物样品进行适当的处理,例如固定,这涉及到适当选择包埋树脂和针对目标分子的特异性抗体。
虽然传统的电子显微镜不能提供关于特定分子的信息,但免疫金标记可以在可见结构与特定的原位定位和分子分布之间建立高分辨率的联系。如此看来,毫无疑问,胶体金颗粒的应用代表了免疫化学方法改进中的一个重大事件。在将胶体金引入免疫细胞化学的过程中,开发了许多方案。一般来说,它们是基于TEM的, 包括在树脂包埋后的免疫标记或在此过程之前的免疫染色。
虽然胶体金在组织化学中有几种用途,但它的主要应用是在细胞化学中使用扫描电镜和透射电镜。这种方法很常见,它依赖于各种各样的大分子,这些大分子可以附着在金颗粒上。此外,金标记物可以快速廉价地制备,同时几乎没有非特异性吸附,并且可以通过各种方法对其进行量化。它们也是多次标记实验的理想选择。最后,通过在电子显微镜下使用胶体金,可以清楚地识别细胞内抗原。
参考文献
1. Horisberger, M. (1981). Colloidal gold as a cytochemical marker in electron microscopy. Gold Bulletin, 14(3), 90-94.https://link.springer.com/article/10.1007/BF03216735
2. De Paul, A. L., Mukdsi, J. H., Petiti, J. P., Gutiérrez, S., Quintar, A. A., Maldonado, C. A., & Torres, A. I. (2012). Immunoelectron microscopy: a reliable tool for the analysis of cellular processes. In Applications of Immunocytochemistry. IntechOpen. https://sc.panda321.com/#google_vignette
3. Horisberger, M., Rosset, J., & Bauer, H. (1975). Colloidal gold granules as markers for cell surface receptors in the scanning electron microscope. Experientia, 31(10), 1147-1149. https://link.springer.com/article/10.1007/BF02326761
4. Kijanka, M., van Donselaar, E. G., Müller, W. H., Dorresteijn, B., Popov-Čeleketić, D., El Khattabi, M., & Post, J. A. (2017). A novel immuno-gold labeling protocol for nanobody-based detection of HER2 in breast cancer cells using immuno-electron microscopy. Journal of structural biology, 199(1), 1-11.https://doi.org/10.1016/j.jsb.2017.05.008
原文链接:阿拉丁试剂:https://www.aladdin-e.com/zh_cn/faq/technical-articles/application_of_colloidal_gold_in_electron_microscope/ |
|
 /3
/3 