登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
基因研究中常需要通过上调靶基因的表达来观察表型变化。过表达 (Over-Expression,OE) 是上调基因表达最常用的方法,其基本原理是将目的基因构建到质粒或病毒载体中,导入细胞内使基因的表达量增加。 使用质粒法过表达外源基因具有简便、成本低和实验体系成熟等优点,因此大多数实验室会偏向于使用质粒法。 今天我们就来聊聊质粒提取那些事儿~ 质粒:一个小型环状双链 DNA 分子,存在于细菌染色体外,能独立复制并稳定遗传。
质粒分子小 (0.2-10 KD),因此便于分离和提取,可以携带目的基因进入细菌、动物细胞或植物体内进行扩增与表达。
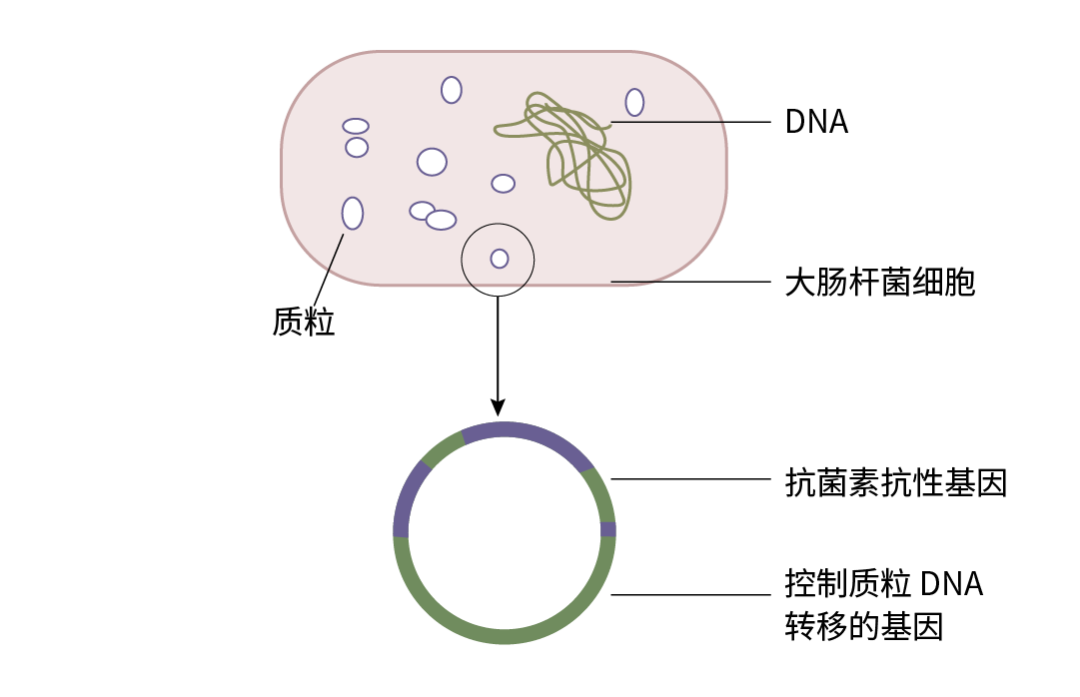
图 1. 大肠杆菌质粒分子结构示意图。

接下来,我们以“ Parkin 基因过表达质粒和细胞模型的构建”为例详细展开[1]! 知识链接:
Parkin 是帕金森病的遗传易感基因之一,其突变和蛋白功能缺陷可导至 PD。早期的研究发现,Parkin 蛋白在中脑的黑质和蓝斑处的神经元表达丰富,而帕金森病人黑质的 Parkin 含量明显降低。
So,上调一哈,上调一哈……
1 构建 ▐ 带有 GFP 标记的 Parkin 过表达质粒 质粒的构建可经公司购买得到,一般同时提供阴性对照菌液及质粒。 利用限制性内切酶消化获得线性化载体,PCR 扩增制备 Parkin 基因片段,所用扩增引物需在其 5' 端添加同源重组序列,使用该引物扩增基因片段,扩增产物 5' 和 3' 最末端的序列分别与线性化载体两末端序列完全一致。以线性化载体和基因扩增产物配制反应体系,进行重组反应,实现体外环化。 图 2. 构建的 Parkin 过表达质粒载体结构图[1]。
GV146:载 体 编 号 ;CMV-MCS-IRES-EGFP-SV40-Neomycin:元件顺序;EGFP:荧光标记;Kanr:青霉素抗性;MCS:多克隆位点 (Parkin)。 2 转化扩增
(1)配置 LB 肉汤培养基及含 AGAR 的培养液 (含琼脂,用于配制LB固体培养基),倒平板,接种阴性对照菌液和 Parkin 过表达菌液于固体培养皿中,并倒置于 37 ℃ 培养箱中孵育 16 h 左右;
(2)然后各挑取一个独立的、圆形且大小适中的菌落,接种于 5 mL 含抗生素的LB 培养液中,37 ℃,250 rpm,摇菌 10 h;
(3)从两种 5 mL 的菌液中各取 1 mL 分别加入至 LB 培养液中,37 ℃,250 rpm,摇菌 14 h。 3 抽提和鉴定
扩增结束后可按照质粒抽提试剂盒对质粒进行提取。提取的 Parkin 过表达质粒和阴性对照质粒,进行测序 (一般可交由公司完成测序)。将测序结果与目的基因序列进行比对分析,后续进行质粒转染。
质粒抽提怎么选?
质粒提取的目的是去除 RNA,将质粒与细菌基因组 DNA 分开,随后去除蛋白质及其它杂质,以得到相对纯净的质粒。按得到质粒 DNA 的量可将质粒抽提方法和试剂盒分为小提,中提,大提。 表 1. 不同质粒抽提的比较。 质粒提取最常使用的是碱裂解法。即在强碱性条件下,使质粒 DNA 和基因组 DNA 同时从细胞中释放出来,并发生变性而便于纯化出来。市售的大多数试剂盒都是基于碱裂解法原理。碱法抽提适用于小量制备 15 kb 以下的质粒 DNA (大于 15 kb 的 DNA 在碱法提取过程中很容易断裂)。 图 3. 质粒提取过程。 利用离子去污剂 (如 SDS) 裂解宿主细胞(细菌);利用蛋白酶和 RNase 等,从细胞中释放 DNA,去除蛋白等杂质;从层析液中吸收、释放 DNA。如,利用乙醇或者异丙醇沉淀 DNA 去除盐离子。 碱裂解法制备质粒的关键是把握好 SDS-NaOH 处理菌体的时间。如果质粒长时间处于碱性环境,就有可能出现不可逆的变性反应,使质粒变性,无法进行正常的酶切反应等实验,降低终产物品质和可用性。
小 M 为大家整理了抽提的主要试剂及注意事项,可自行点赞收藏喔~
表 2. 提取主要试剂、原理与注意事项。

 1 细胞培养
小M已做过细胞培养相关推文 (详见往期推文:实验操作 | 小白第一课!基础细胞培养方法及步骤)大家可作为参考,并根据自己的细胞常用培养方法开展实验。
此处以人神经母细胞瘤细胞 SH-SY5Y 细胞株为例[1]:
(1) 用 25 cm2 细胞透气培养瓶,含有 10% 胎牛血清和 1% 青链霉素的 DMEM 完全培养基培养 SH-SY5Y 细胞 (培养条件为:37 ℃、5% CO2)。
(2) 每 1~2 天进行换液,细胞长至 80 %~90 % 时传代:
① 用吸管吸出旧的培养基,PBS 清洗 2 次,每次 5 mL,每瓶加入 0.5 mL 胰酶,消化 30~60s。显微镜下观察大部分细胞收缩、变圆,有少许细胞开始掉落时,立即用吸管吸出胰酶,加入 5 mL 培养基吹打终止消化,使细胞从瓶壁上全部脱落,悬浮在培养基中。
② 将细胞悬液转移至 15 mL 离心管中,4 ℃,1000 rpm,离心 5 min。
③ 弃上清,新鲜培养液重悬细胞并轻轻混匀,根据细胞生长密度选择传代瓶数。一周传代 2~3 次。 (3) 细胞冻存时,冻存液成分:70% 培养基,20% 胎牛血清,10% DMSO;冻存密度为 1~2×106 个 /管,液氮保存。 图 4. 传代流程图。 2 分组
(1) 正常对照组 (C):正常培养 SH-SY5Y 细胞。
(2) 阴性对照组 (NC):SH-SY5Y 细胞转染阴性对照质粒。
(3) 过表达组 (PC):SH-SY5Y 细胞转染过表达质粒。
3 转染
细胞铺板 24 h 后,按照 Lipofectamine 说明书用其进行转染。转染 48 h 后,荧光显微镜下观察其 GFP 的表达情况及统计其转染效率 (对明场及暗场荧光细胞计数,得:转染效率 = 暗场荧光细胞个数 / 明场细胞个数;也可通过流式等观察统计其转染情况)。
结果显示,阴性对照组和 Parkin 过表达组细胞内可观察到较多的绿色荧光蛋白表达,而正常组细胞没有观察到,则质粒成功转染至细胞内。
图 5. 转染后荧光显微镜下观察绿色荧光蛋白的表达[1]。 A. 正常对照组 (明场);B. 正常对照组 (暗场);C. 阴性对照组 (明场);D. 阴性对照 (暗场);E. 过表达组 (明场);F. 过表达组 (暗场)。
1 RT-PCR
▐ 实时荧光定量 PCR(RT-PCR)检测 EGFP-Parkin mRNA 的表达水平
大家可根据购买的试剂盒进行操作,小 M 在下方为大家整理了文献中的操作步骤,供大家参考[1]。
(1) 提取 RNA 及将 RNA 逆转录为 cDNA: 实验分组及处理同上,TRIzol 提取细胞后每管加入 200 µL 氯仿,离心 15 min 后吸取 400 µL 上层水相至新的管中;每管加入 400 µL 异 丙醇,离心 10 min,弃上清;加入 l mL 75 % 的乙醇悬浮沉淀后 离心 5 min,弃上清后晾置并加入 50 µL DEPC 水,吹打混匀, 稀释后用紫外分光光度计测定 RNA 的浓度。 各组取 2 µg RNA 与 1 µL 的 Oligo (dT) 及 DEPC 水混合均匀,放置于逆转录仪中 变性,65 ℃,5 min;配制反应混合物 (每管:5× Reaction Buffer: 4 µL, RiboLock RNase Inhibitor: 1 µL, 10 nM dNTP Mix: 2 µL, RevetAid M-Mulv RT: 1 µL) 每管加入 8 µL 混合物;置于逆转录仪中反应,反应条件为 42 ℃,60 min → 70 ℃,5 min → 4 ℃, -20 ℃ 保存备用。
(2)PCR 反应检测 EGFP-Parkin mRNA 表达水平:
转染后 SH-SY5Y 细胞内 Parkin mRNA 表达情况:
RT-PCR 结果显示,Parkin 过表达质粒转染后,正常对照组与阴性对照组的 Parkin-mRNA 水平没有明显差异 (P>0.05);而与正常对照组和阴性对照组相比,Parkin 对照组的 mRNA 表达量有明显提高 (P<0.01)。
另外,RT-PCR 的溶解曲线 (Melt Curve) 分析结果显示,扩增产物的特异性良好,40 个扩增循环中没有引物二聚体的产生,溶解峰为 79.16 ℃ (图 6)。
图 6. 过表达质粒转染后 SH-SY5Y 细胞 Parkin-mRNA 的相对表达情况[1]。 A.RT-PCR 的扩增曲线 B. 溶解曲线 C. 采用 2 -Δ ΔCT 法分析各组 mRNA 的相对表达量,与正常对照组比较,*P<0.05;与阴性对照组比较,#P<0.05
2 Western Blot
▐ Western Blot 检测 Parkin 蛋白的表达水平
有关 Western Blot 的实验操作,往期小 M 已为大家做过解读 (详见往期推文:Western Blot 实验步骤 + 不可忽视的小细节),大家可根据自己的目的蛋白进行实验参数的调整。 文献参考步骤[1]:
(1) 蛋白提取、定量及变性: BCA 蛋白定量试剂盒提取蛋白并检测蛋白浓度。提取的蛋白样品加入 5× loading buffer 和 RIPA 蛋白裂解液进行定量配平,并将配平的蛋白样品置于 100 ℃ 沸水浴中煮 5 min。
(2)免疫印迹:
① 配胶、灌胶:配制 10 mL 10 % 的分离胶和 5 mL 5 % 的浓缩胶,先后灌入,先配分离胶,再配制浓缩胶,然后 插入 10 孔梳子,待浓缩胶凝固后,将梳子拔出,置于电泳槽中。(或自行购买预制胶板,进行后续操作)
② 上样:每孔 30 µg,20 µL,上样后 100 V 电压,电泳约 120 min。
③ 转膜:制作 " 三明治 " 夹板并将其放入电转 槽中并加满电转液;电转槽置于冰上开始电转,100 V 电压,电转 80 min。
④ 封闭:电转后将膜取出,室温下置于摇床上封闭 1 h。
⑤ 一抗孵育:用一抗稀释液将一抗稀释至适当浓度 (1:1000);室温下, 摇床上孵育 1 h 后,置于 4 ℃ 冰箱里孵育过夜。
⑥ 二抗孵育:摇床上用 TBST 将膜漂洗 15 min× 3 次。用 0.5 % 脱脂牛奶 -TBST 溶液稀释二抗至适当的浓度 (1:1000) 置于摇床上慢速摇动孵育 1 h。
⑦ 显影:将膜取出,置于摇床上用 TBST 漂洗 15 min × 3 次。显影,采用软件进行分析。
Western Blot 结果显示,正常对照组与阴性对照组的蛋白表达水平没有明显差异 (P>0.05);过表达组的 Parkin 蛋白水平较正常对照组和阴性对照组有显著提高 (P<0.01),提高了约 60 % (图 7)。 图 7. 过表达质粒转染后 SH-SY5Y 细胞内 Parkin 蛋白的相对表达情况[1]。 1 如何做好细菌培养?
2 低拷贝质粒如何增加产率?
3 如何提高杂质去除率? 4 如何提高获得的 DNA 浓度? 5 琼脂糖电泳鉴定结果说明 多数情况下会出现 3 条带。这三条带以电泳速度的快慢而排序,分别是超螺旋、开环和复制中间体 (没有复制完全而连在一起的质粒)。 注:碱法抽提得到质粒样品中不含线性 DNA。 有的结果中会有第 4 条带。这条带泳动得较慢,远离这三条带,是 20-100 kb 的大肠杆菌基因组 DNA 的片断。这是因为在抽提环节中,加入溶液 II 后过度振荡所致。 少数情况下会出现 7-10 条带。可能因为一些 DNA 序列特殊,而出现不同程度超螺旋 (超螺旋的圈数不同,而泳动速度不同) 所致。
[1] Ma Hao jie, et al. Construction of Overexpression Plasmid and the Cell Model. Progress in Modern Biomedicine Vol.18 NO.3 FEB.2018.
|  /3
/3 