登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
作为生命活动的主要承担者,蛋白质的功能一直是科研活动中备受关注的明星。蛋白质通常不是“单打独斗”的,绝大多数的功能蛋白质会与其他蛋白质相互作用,一起调控生命过程。那么,研究蛋白质互作的技术,你了解多少呢?
一、免疫共沉淀 免疫共沉淀(Co-Immunoprecipitation,COIP)技术是利用抗原抗体之间具有特异的免疫结合的原理,在细胞裂解液中加入特异性抗体,将抗原及与抗原结合的蛋白沉淀下来。免疫复合物可以通过Western Blot的方法验证抗原和其他蛋白之间的相互作用,也可以用质谱的方法,检测抗原的结合蛋白成员。 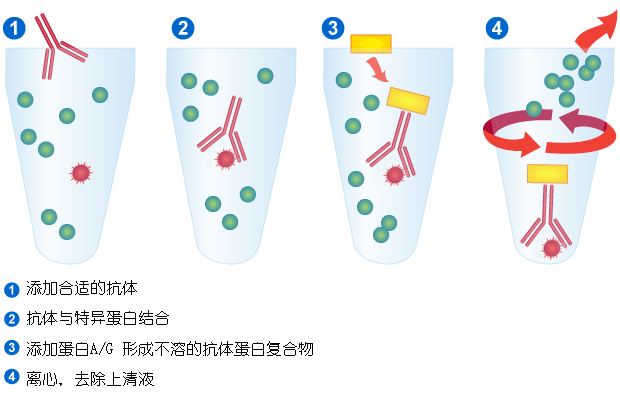
COIP技术的优缺点: 优点: (1)得到的互作蛋白是细胞内与诱饵蛋白天然互作的,符合体内真实生理情况; (2)实验条件温和,可避免人为的影响;(3)可分离得到天然状态的相互作用蛋白复合物。 缺点: (1)不适用于结合力弱或者瞬间结合的蛋白互作研究。 二、Pull Down Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外传路或翻译体系中检测出蛋白相互作用关系。COIP检测到的蛋白互作关系可能是第三个蛋白作为桥梁建立的,与之相比,pull down技术可用于检测蛋白之间的直接互作关系。但pull down需要先把诱饵蛋白原核表达纯化出来,再与目的蛋白溶液孵育,其无法像COIP一样模拟细胞内天然的互作环境。 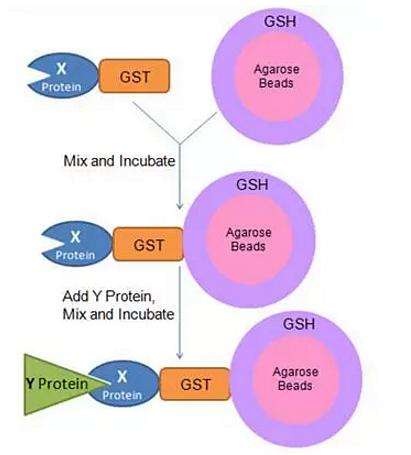
三、双分子荧光互补 双分子荧光互补技术是指荧光蛋白多肽链在某些不保守的氨基酸处切开,形成不发荧光的N-和C-末端2个多肽片段。将这2个荧光蛋白片段分别连接到1对能发生相互作用的目标蛋白上,在细胞内共表达或体外混合这2个融合蛋白时,由于目标蛋白质的相互作用,荧光蛋白的2个片段在空间上互相靠近互补,重新构建成完整的具有活性的荧光蛋白分子,从而产生荧光。可视化是 BiFC 技术最大的特点。 
四、酵母双杂交 酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。 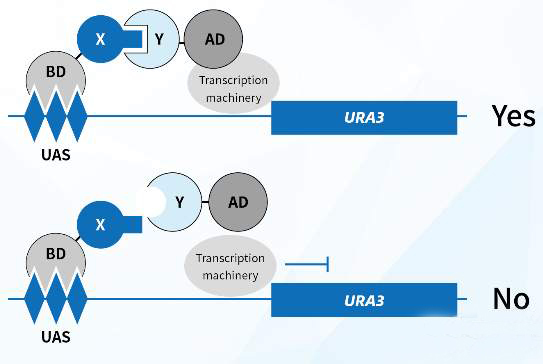
除此之外,研究蛋白质互作的方法还有噬茵体展示技术、等离子共振技术、抗体与蛋白质阵列技术等。选择合适的实验方案会让您的实验过程事半功倍,MDL,专业的技术平台为您的实验助力。
|  /3
/3 