登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
早期,人们就发现在细胞的生命活动中,DNA复制、mRNA转录与修饰以及病毒的感染等,都涉及基因-蛋白质相互作用,很多生理学家都探讨了这种现象的发生过程。
近年来,随着研究的深入,很多医学研究者已经将目光投向了基因-蛋白相互作用,期望在此水平上,另辟蹊径,深入分析癌症、心血管疾病、中央神经系统紊乱等疾病的主要代谢通路和发生机制。 ChIP 是一种在体内研究转录因子和靶基因启动子区域直接相互作用的方法,可以在体内直接确定它们之间相互作用方式的动态变化,能够得到转录因子结合位点的信息,确定其直接靶基因。它早期多被用于研究核小体上的 DNA 和组蛋白的相互作用以及组蛋白的修饰等方面。近年来,随着生物技术的迅速发展,ChIP 技术不断发展和完善,被广泛应用于体内转录调控因子与靶基因启动子上特异核苷酸序列结合方面的研究,并成为在染色质水平研究基因表达调控的有效方法。
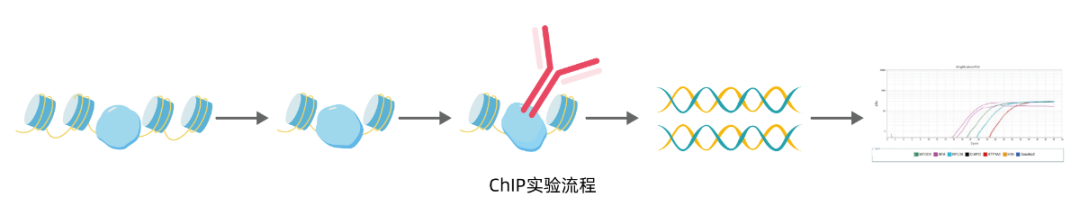
ChIP原理及应用方向 通过甲醛将染色质上的DNA和目的蛋白交联; 通过超声或酶解的方法将染色质片段化; 包含有目的蛋白的染色质片段通过抗体富集纯化; 通过加热解除DNA和目的蛋白的交联; 通过蛋白酶和RNA酶消化去除目的染色质的蛋白和RNA之后,将目的DNA纯化出来; 得到的DNA可以通过PCR检测目标区域的DNA是否被目的蛋白富集,或者通过DNA测序的方式检测目的蛋白在全基因组上的分布; ChIP原理看似简单,但要想做好ChIP ,得到高质量的数据却绝非易事。
 ChIP的应用方向:
ChIP实验步骤可分6步: 因ChIP试剂盒操作参差不齐,因此实验的具体步骤不再展开,大家只需要按照手头上的试剂盒操作说明严格操作即可,但是核心步骤基本符合。接下来的内容主要是注意事项。
注意事项 想要做好ChIP实验,必须要控制好6个方面,包括培养基内活细胞数量、交联时间长短、消化后的片段大小、抗体的种类和特异性、常规实验操作技术等多种因素影响 。想要控制这些过程,最核心的就是全面设置对照组。下面逐个做说明。 01 活细胞数量
 活细胞计数后,如果最终用于ChIP实验的细胞数量太高,将直接导至甲醛交联时间增加,间接导至细胞数量/微球菌核酸酶比例增大,这些均可造成裂解的DNA小片段过长(超过1000bp),实验处理过程中极易丢失这些片段,最终也会造成PCR检测困难或失败。最佳的DNA片段长度是150bp-300bp。相反,如果细胞数量太少,则导至细胞数量/微球菌核酸酶比例减小,最终得到的DNA片段极可能小于100bp。
总之,DNA-蛋白丰度直接决定了ChIP实验所需的细胞数量,没有固定的数量标准,这些都需要预实验充分摸索。 02 甲醛交联时间
1%终浓度的甲醛交联时间推荐5-6分钟。时间过久,会造成裂解的DNA小片段过长(超过1000bp)。时间太短,会导至交联不完全,实验过程中导至一部分的DNA-蛋白质复合物分离,最终分析的结果必然是不准确的。 03 设置对照组
ChIP实验内对照:染色质断裂后,须按一定比例留取部分染色质溶液,此Input DNA(断裂后的基因组DNA)作为ChIP实验的内对照。内对照不仅可以验证染色质断裂的效果。如果按照取样比例换算,还可以根据Input DNA中靶序列的含量和染色质沉淀中的靶序列含量,推算ChIP实验效率,所以Input内对照是必须要设置的。 阳性抗体对照:目的抗体沉淀DNA-蛋白复合物时,必须需设置阳性抗体对照组。阳性抗体通常选择与已知序列相结合的、各物种之间比较保守的蛋白抗体,常用组蛋白抗体。
抗体阴性对照:目的抗体沉淀蛋白DNA复合物时,必须需设置阴性抗体对照组。阴性对照所使用的抗体可以选择目的蛋白抗体宿主的血清蛋白。 04 目标蛋白抗体
ChIP实验中与一般的抗原-抗体免疫反应实验不太一样。 常规实验如western blot、蛋白质免疫共沉淀等,抗原上只要存在与抗体结合的位点,则二者的免疫反应基本不受到蛋白质空间结构影响。 ChIP实验中,染色质沉淀步骤时,蛋白和DNA处在交联状态,目标蛋白的结合位点形成空间阻碍,导至抗体无法与目标蛋白结合形成复合物。 因此,能力够做western blot、蛋白质免疫共沉淀实验的抗体不一定能够做ChIP实验,一定一定要使用已经过ChIP验证的抗体,否则实验必然失败。此外,抗体的浓度、孵育时间、孵育温度需要根据目标蛋白的丰度决定。目标蛋白丰度较低时,可能需要调整活细胞数量、过夜4℃孵育等。  05常规实验操作
ChIP实验过程较长,过程繁琐,需要反复的洗柱、离心、吸液、换管、孵育、震荡。操作说起来很简单,但是每一步都需要小心操作,非常考验基本功,希望大家多多注意。 06 实验结果分析
对于Input DNA组,采用1.8%琼脂糖凝胶电泳,结果应该是片段集中于150bp到350bp之间,这样长度的DNA片段才是符合要求的。如下: 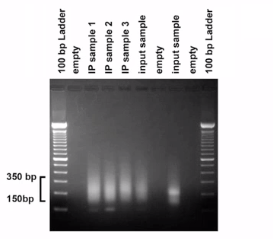 进一步,内对照组、阴性抗体对照组、阳性抗体对照组的纯化DNA先采用PCR扩增,随后通过1.8%琼脂糖凝胶电泳,得到的结果应该是这样的:空白对照组无条带、阴性抗体对照组条带弱或无、内对照组强条带、阳性对照组看到强条带。只有这样的结果才是成功的。后续才能进行RT-PCR实验。
|  /3
/3 