登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
前言 近年来,利用药物重新激活或增强免疫监测的免疫治疗成为一种新的、有希望的癌症治疗策略。2011年,CTLA-4的阻断性抗体ipilimumab被批准用于晚期黑色素瘤,开创了免疫治疗的新时代。一系列其他检查点,如PD-1、PD-L1和LAG-3等的抗体也被广泛开发并批准用于各种癌症治疗,这在一些临床实践中显著提高了晚期癌症患者的生存率。然而,以缺乏浸润性免疫细胞或免疫细胞耗竭为特征的“冷”肿瘤微环境(TME)损害了免疫检查点阻断疗法,因此需要开发改进的免疫治疗策略。 追溯到现代免疫疗法的起源,细菌早已被用作治疗癌症的药物。William Coley在十九世纪将热灭活链球菌和粘质沙雷氏菌(称为Coley毒素)注射到恶性肿瘤组织中,观察到了肿瘤的消退。因此,William Coley被誉为免疫治疗之父。细菌免疫治疗另一个成功的例子是卡介苗(BCG),它是一种减毒牛型结核分枝杆菌变异株,最初被设计为结核病疫苗,1990年被FDA批准用于治疗膀胱癌。 近年来,研究还证明了肿瘤内细菌的存在和微生物群的免疫调节作用,表明肿瘤组织是细菌与肿瘤细胞和宿主相互作用的复合体。细菌几乎涉及癌症的所有生物学方面,如今,随着对TME的深入了解以及微生物学、纳米技术和重组DNA技术的快速发展,重新编程细菌的实现使细菌治疗成为当前癌症研究和治疗的新热点。 细菌的天然优势 细菌具有肿瘤靶向性,其表面结构或代谢产物也能激活免疫系统发挥抗肿瘤作用。因此,细菌在肿瘤免疫治疗中具有作为治疗剂或载体的固有优势。 细菌的肿瘤靶向性 肿瘤组织中的脉管系统通常混乱且不规则,导至氧气和营养素的扩散不足。因此,肿瘤中心区域通常呈现为缺氧环境。研究发现,这一中心区域可以为一些专性兼性厌氧菌在系统给药后定植和增殖提供场所。据报道,在静脉注射鼠伤寒沙门菌3天后,小鼠肿瘤部位的细菌数与正常器官的比例超过10000:1。相反,仅依赖被动分布和有限渗透性的传统化疗药物,通过全身给药,很难进入这些血管稀疏的坏死区域,这通常导至肿瘤复发。因此,细菌能够在肿瘤核心定植,这是其他类型药物最难靶向的区域。 细菌的免疫激活特性 缺氧作为TME的标志,也会导至局部免疫细胞的功能抑制。随着肿瘤的进展,癌细胞不受控制的增殖剥夺了免疫细胞的氧气和营养。因此,免疫细胞往往会耗竭,通过分泌促癌细胞因子和趋化因子呈现抑制表型,并且无法对抗癌信号作出反应。然而,细菌衍生分子如肽聚糖、脂多糖(LPS)和脂磷壁酸可以提供强大的免疫刺激信号。它们主要与固有免疫细胞,如树突状细胞(DC)和巨噬细胞表达的模式识别受体(PRR)结合,以诱导免疫细胞的迁移,刺激免疫系统识别和杀死肿瘤细胞。 例如,沙门氏菌LPS可以增加IL-1β的表达,并通过炎症小体和Toll样受体4(TLR4)介导的信号通路发挥抗肿瘤作用。作为一些革兰氏阴性细菌的结构,鞭毛可以通过与树突状细胞上的Toll样受体5(TLR5)结合,促进各种促炎细胞因子、NO、H2O2和趋化因子的表达,增强CD8+T细胞介导的杀瘤作用,并下调Treg细胞的抑制功能。 此外,细菌的某些成分可以介导免疫细胞的表型转化。例如,鞭毛蛋白可以介导促肿瘤巨噬细胞向抗肿瘤巨噬细胞的转化,将免疫抑制微环境转化为免疫活性环境。研究发现,李斯特菌可以感染MDSCs,降低血液中MDSCs的含量,并促进剩余的MDSCs分泌IL-12,转变为免疫活性表型。在李斯特菌治疗的动物模型中观察到肿瘤生长减少,这表明李斯特菌可以通过作用于MDSCs抑制肿瘤。 工程化细菌 细菌在肿瘤部位的趋化定植及其免疫原性使其成为免疫治疗的理想候选者。据报道,在肿瘤组织内检测到几种细菌,肿瘤内输送益生菌可促进抗肿瘤免疫,为微生物在肿瘤治疗中的应用提供了理论基础。近年来,随着合成生物学、材料科学和基因编辑工具的发展,细菌工程已成为可能。通过不同的修饰和转化方式,可以进一步提高肿瘤的靶向性、治疗效果和安全性。
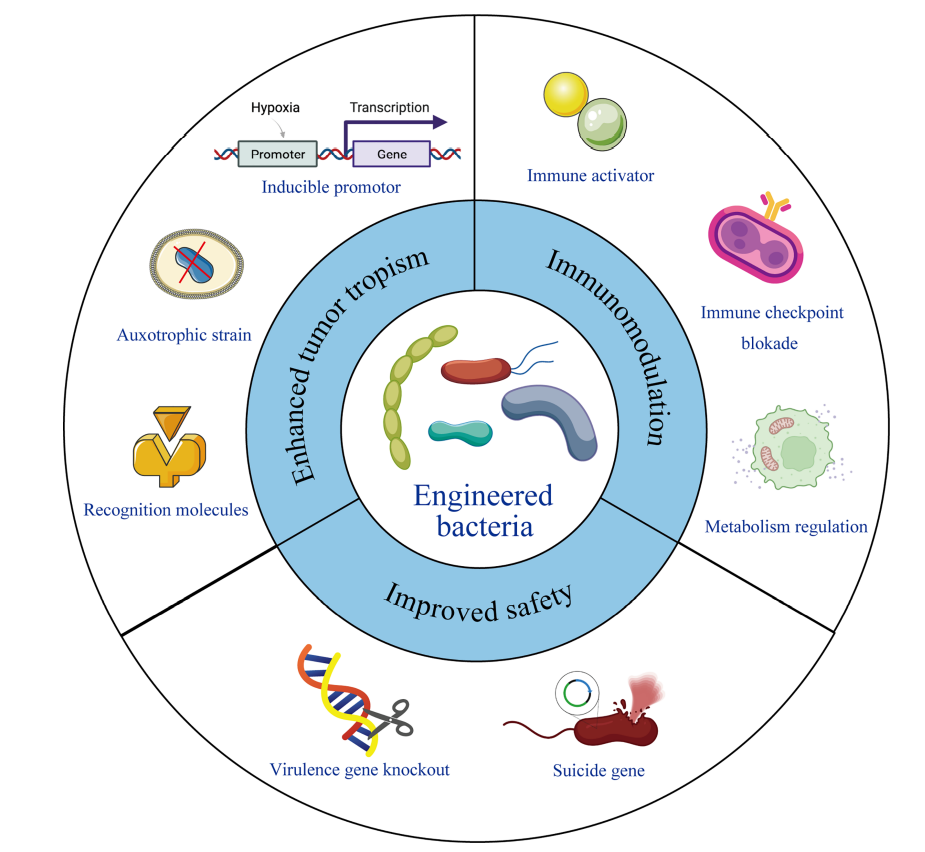
工程化改善肿瘤倾向性 营养缺陷型突变体的构建是提高细菌靶向性的策略。根据正常组织和肿瘤部位所含营养成分的差异,可以设计突变体,使其只能在肿瘤组织中定植和存活。其中,沙门氏菌A1和SF104是成功应用的例子。沙门氏菌A1是一种亮氨酸和精氨酸营养缺陷型菌株,而沙门氏菌SF104则表现出对芳香族氨基酸的需求,基因aroA发生突变,这两种突变都会使细菌无法在正常组织中富集,但可以在肿瘤部位特异性聚集。 此外,合成工程化粘附素,专门用于结合特定的癌症表达分子,如新抗原或癌细胞中丰富的其他分子,可以提高某些细菌对肿瘤的天然亲和力。Bereta等人通过在鼠伤寒沙门菌VNP20009上表达癌胚抗原(CEA)的特异性单链抗体片段,观察到肿瘤部位的细菌聚集增加。另一项研究中,通过将抗CD20抗体结合到沙门氏菌表面,增加了细菌对CD20+淋巴瘤的侵袭性,同时减少了非特异性聚集。 工程化调节免疫微环境 细菌的几种基本成分能够改变人体的免疫系统。然而,为了获得更大的免疫调节效果,可以设计工程菌来装载或表达外源性免疫治疗药物,以增强抗肿瘤疗效。 鉴于细菌优先定植于恶性区域并自然刺激固有免疫细胞,基于细菌的治疗可以提供肿瘤组织中免疫激活的基线水平。细胞因子具有促进免疫细胞活化和增殖的能力,通过工程菌传递细胞因子具有特异性高、副作用小的特点。一项研究通过使用减毒鼠伤寒沙门菌合成IL-18,通过增加肿瘤区域CD3+/CD4+T细胞和DX5+NK细胞的浸润,IL-1β、TNF-α、IFN-γ、GM-CSF等细胞因子的表达增加,并观察到抗肿瘤作用。 人乳头瘤病毒16型癌蛋白E7(HPV-16 E7)在宫颈癌的发病机制中起着关键作用,是宿主细胞免疫所必需的。据报道,口服表达HPV-16 E7蛋白的乳酸乳杆菌可导至表达E7的肿瘤生长显著延迟,E7特异性CD4+T辅助细胞和CD8+T细胞数量显著增加,表明这种基于细菌的疫苗对肿瘤细胞挑战具有深远的保护作用。该口服疫苗还进行了一期临床试验,以验证其安全性和免疫原性。 工程化提高安全性 虽然细菌具有良好的抗肿瘤特性,但其潜在毒性是其应用的主要障碍。另一方面,活菌制剂的安全性是其临床转化的关键。为了充分利用细菌对抗癌症,研究人员做出了巨大的努力来构建大量的减毒工程菌,以提高其安全性能。 细菌表面分子是细菌的主要毒力,对这些表面抗原的修饰(如基因敲除)是规避活病原体毒性的主要途径。例如,ppGpp(鸟苷5’-二磷酸-3’-二磷酸)是一种参与毒力基因表达的信号分子。通过敲除relA和spoT基因,ppGpp的合成被阻断,导至其LD50比野生菌株增加105-106倍。由于能够诱导促炎因子IL-1β、IL-18和TNF-α的分泌,ppGpp合成紊乱的细菌也表现出良好的抗肿瘤活性。 工程菌在肿瘤联合免疫治疗中的研究现状 研究表明,细菌可以作为免疫治疗剂,增强抗肿瘤免疫。由于联合治疗是一种广泛使用的提高总体疗效的策略,细菌免疫疗法也被作为化疗、放疗、光动力疗法和光热疗法联合治疗的一部分。 联合化疗 传统的化疗缺乏对恶性组织的特异性递送,导至显著的药物全身暴露,这通常会产生剂量限制性毒性。利用工程菌作为药物释放系统进行药物控制释放,以及利用其免疫原性进行免疫调节,已成为研究的热点。 Ektate等人将低温敏感脂质体附着在沙门氏菌膜上,在高强度聚焦超声(HIFU)加热的帮助下,介导结肠癌细胞内阿霉素的触发释放,从而在癌细胞的细胞质和细胞核中实现高效药物递送。此外,该菌株还使巨噬细胞极化为抗肿瘤M1表型,使Th1细胞群富含大量TNF-α,并降低IL-10的表达,从而在联合化疗-免疫治疗方式中显示出增强的治疗效果。 除了利用活细菌,细菌外膜囊泡(OMV)是在生长过程中由革兰氏阴性细菌膜自然产生的,最近已成为多种生物医学应用的免疫治疗剂。Chen等人将载药聚合物胶束封装到细菌外膜囊泡中,细菌成分可以激活免疫反应,而装载药物可以发挥化学治疗和免疫调节作用来清除癌细胞。 联合放疗 细菌辅助放射治疗是一种新的肿瘤治疗方法。在Jiang等人的一项研究中,研究了大肠杆菌与放射治疗相结合的治疗效果,表明在21 Gy的辐射和大肠杆菌产生细胞溶血素a的情况下,结肠肿瘤模型中的肿瘤显著缩小。与单独使用细菌治疗相比,携带细胞溶血素a的细菌联合放疗可导至更多的肿瘤缓解。 此外,放射治疗后,肿瘤释放大量肿瘤抗原,这些抗原可被树突状细胞吸收和呈递,导至特异性适应性免疫反应。然而,在免疫抑制性TME中,DC的数量通常较低,并且通常处于功能障碍状态。Wang等人将涂有抗原吸附阳离子聚合物纳米粒的沙门氏菌注射到肿瘤组织中,这种纳米粒可以捕获放疗后释放的抗原,并将其运出肿瘤核心,从而激活肿瘤边缘组织中周围的DC。研究观察到体外激活的DC大量增加,在多个肿瘤小鼠模型中存活时间延长,显示出增强的全身抗肿瘤作用。 联合光动力疗法和光热疗法 由于标准的肿瘤治疗具有非特异性杀伤作用和复杂的手术操作,光动力疗法和光热疗法因其非侵袭性、高度特异性和良好的时空控制性而成为新的治疗选择。最近,许多研究试图利用细菌作为载体来装载PDT和PTT的治疗剂,以利用细菌的肿瘤靶向性和免疫激活特性。 一项研究将光敏剂包覆的纳米粒子整合到光合细菌聚球藻表面。在660nm激光照射下,光合细菌继续产生氧气,保证了活性氧的产生,增强了光动力疗法的效果。聚球菌作为免疫原性细菌,也通过上调MHC II类分子和IL-12的表达来激活局部免疫。同时,这种治疗方法通过上调细胞表面钙网蛋白诱导免疫原性凋亡,并在三阴性乳腺癌模型中显示出良好的治疗效果。 小结 自第一次将卡介苗用作膀胱癌药物的试验以来,人们一直在进行不懈的实践,以研究卡介苗在膀胱癌以外的癌症治疗中的作用。除卡介苗外,其他细菌制剂,如改良的鼠伤寒沙门氏菌菌株,也处于临床前或临床试验阶段,以更好地验证其安全性和治疗效果。 由于细菌是一种复杂而可行的治疗药物,在其增殖过程中一些不可控的突变可能会带来潜在的毒性。它们固有的毒力也会导至免疫功能低下的癌症患者发生复杂的感染。然而,合成生物学的快速发展使得通过基因编辑来获得所需的细菌行为成为可能,依靠对工程菌靶向性的精确调控,可以实现药物在肿瘤部位的特异性释放,未来工程化细菌将成为肿瘤免疫治疗的有力支持,使更多的癌症患者获益。
参考文献: 1.Current Status and Future Directions of Bacteria-Based Immunotherapy. Front Immunol.2022; 13: 911783.
|  /3
/3 