登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
随着老龄化的加剧,全球神经退行性疾病的发病率也随之增加。“老年痴呆”、“帕金森”等神经退行性疾病更是和癌症一样,已成为流传在街头巷尾的“医学名词”。解析退行性疾病等神经疾病的致病机制一直是神经生物学的关键课题之一,但由于伦理、人脑和非人灵长类脑组织来源的限制,即使能获得少数患者组织,也只能反映疾病的终末阶段,无法解析疾病的发生发展过程。因此,对人脑发育疾病的认知和理解主要来源于对啮齿动物的研究。然而,人脑特有的复杂结构和功能分区,动物模型是无法完全再现的。干细胞技术的发展,特别是诱导多能干细胞的建立为解码神经发育疾病的发病机制提供了理想的人体细胞模型。
基于人干细胞培养技术,研究者们已在体外构建大脑类器官,用来研究人类大脑发育以及神经疾病。但是,研究进展比较缓慢,一方面,体外培养的大脑类器官不会发育产生血管,因此无法自行获取营养,意味着它们难以长期茁壮成长。另一方面,大脑类器官培养技术的发展使得研究人员只能对特定脑区的发育过程和功能进行研究,然而,已有的大脑类器官并没有产生行为输出的神经环路,限制了其在神经类疾病方面研究的发展。 针对类器官研究的窘况,2022年10月12日,斯坦福大学神经科学家Sergiu P. Pașca等在《Nature》发表文章(链接:https://www.nature.com/articles/s41586-022-05277-w),研究人员已经研发出一种研究人类神经元的新方法——将人类大脑样组织移植到只有几天大的大鼠体内,构建人鼠混合大脑类器官。 此项研究耗时七年,研究人员将来自于人的多能干细胞经诱导分化为大脑皮质类器官hCO,原位移植于3天—7天天龄无胸腺大鼠的体感皮层中,构建了人鼠混合大脑类器官——t-hCO。具体的体感皮层位于大鼠脑部S1区中(负责处理触觉信息的初级感觉区域称作体感带(S1区),位于顶叶前部),并在移植后2-3个月对大鼠脑部进行MRI成像,观察t-hCO的生长状态。结果表明,在体移植后的t-hCO在3个月内体积增加了9倍,而移植12个月后,移植动物存活率为74%,同时未检测到运动或记忆缺陷、神经胶质增生等中枢神经系统异常现象。 然后,研究者们通过免疫荧光鉴定了t-hCO内的共表达PPP1R17(皮质祖细胞)、NeuN(神经元)、SOX9 和 GFAP(神经胶质细胞)或 PDGFRα(少突胶质祖细胞)等标志的细胞以及血管内皮细胞的存在。实验结果表明了hCO的成功诱导分化。 进一步地,在t-hCOs诱导分化的第8个月,研究人员利用单细胞核转录组测序对t-hCOs内的细胞分群进行了单个细胞层面的分析。单细胞测序结果鉴定了t-hCOs存在的包括深层和表层谷氨酸能神经元、循环祖细胞、少突胶质细胞和星形胶质细胞等细胞。此外,研究人员发现体外培养的hCOs与体内移植生长的t-hCOs之间存在一定的差异性。 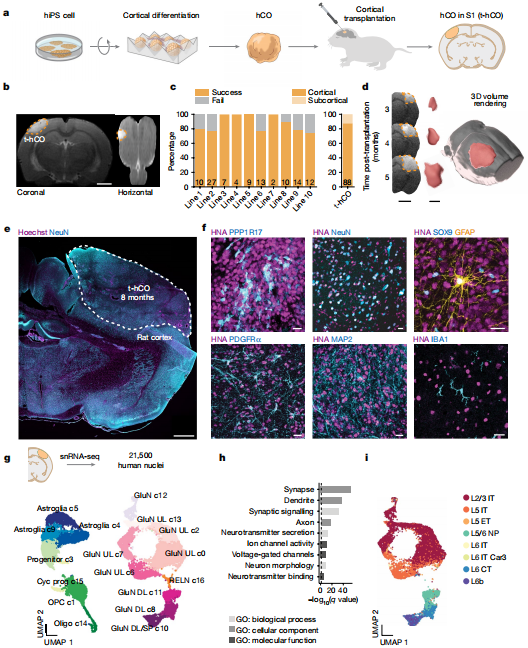 图1 Transplantation of human cortical organoids in the developing rat 研究者们进一步验证了前述单细胞测序结果的差异是否与体外 hCO 和体内 t-hCOs之间的形态差异有关。 此外,研究者们还利用前述单细胞测序数据与人类胎儿和成人大脑皮层细胞以及其发育过程中的基因表达数据进行了对比分析。结果表明hCO和t-hCO 在分化 7-8 个月时的整体转录组成熟状态与体内发育时间大致匹配,并且相当于于胎儿晚期;而在形态学上,t-hCOs与人类 L2/3 神经元的相似度更高。 最后,研究人员验证了t-hCO能否用于精神疾病模型的构建和研究。提摩西综合症(TS)是一种遗传性自闭症相关疾病。研究人员从三名TS患者体和三名正常患者内分离干细胞并诱导分化了hCO,移植后结果表明TS t-hCO 与对照组相比具有异常的树突分支模式,但在类似分化阶段的体外 TS hCO 中则不存在。进一步地,研究人员证明了t-hCO 在解剖学上可以整合到大鼠大脑中,从而能够被宿主大鼠组织激活,并进一步在体内环境中被感觉刺激激活,参与神经环路驱动的行为,实现对大鼠活动的调节功能。 “ 总结: 这项研究也存在以下两点不足:一由于不同物种之间神经元发育速度存在差异,导至人与大鼠等啮齿动物存在异种移植的排斥反应,“鼠身人脑”难以完全复刻正常人脑的结构和功能。二是移植类器官中影响神经环路连接的因素有哪些仍需要确定。文章中的研究方法或许会将相关研究引到新的平台,帮助我们破译人脑和神经疾病的奥秘。总而言之,Sergiu P. Pașca等研究者为人类神经疾病研究提供了新的研究模型,成功将人脑类器官移植到大鼠脑内,突破当前大脑类器官体外培养时所遇到的瓶颈。
|  /3
/3 