登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
【背景】本文分享基于江苏省二类IVD产品延续注册的大背景,仅供医疗器械从业者们参考,借鉴。作者公司产品注册证和注册标准在2014年9月份之前拿到江苏药监官方批准件。于2019年中旬即将到有效期。作者本人在延续注册过程中遇到的一些问题,本文既是对十几个IVD产品延续注册的总结,也希望能通过分享帮助遇到过相同问题的朋友,也希望与更多的医疗器械从业者们分享,交流。
在制定延续计划和补正的过程中遇到过一些问题,有些问题不同的审评老师意见也并不相同(*:下文,标*均为不同审评老师要求)。回顾工作过程遇到的这些问题并进行总结,也非常欢迎其它经验丰富的资深老师指导。
1、关于推荐标准:2014年9月-至今,有新的YY/T标准发布,延续注册时是否按照新的YY/T进行变更?
就这个问题咨询过国家药监局和省药监局,得到的回复基本一致: 延续注册正常进行延续,不进行任何变更。如果考虑到新的YY/T,单独进行变更注册。 不过一般来说,企业在实际操作过程中基本按照如下路线进行: ①如果产品的性能指标不能达到新的YY/T。 延续注册按照法规要求进行正常延续,接受市场监督检验。 ②如果产品的性能指标能达到新的YY/T。 延续和变更分开进行(两者时间根据产品具体情况自行考虑)。延续按照法规要求进行正常延续,变更提交相关资料。 不过在进行延续注册时,审评老师会要求企业提供一份变更的承诺声明。因此,当有新的行业标准公布时,企业应根据实际情况及早制定相应的产品注册计划。
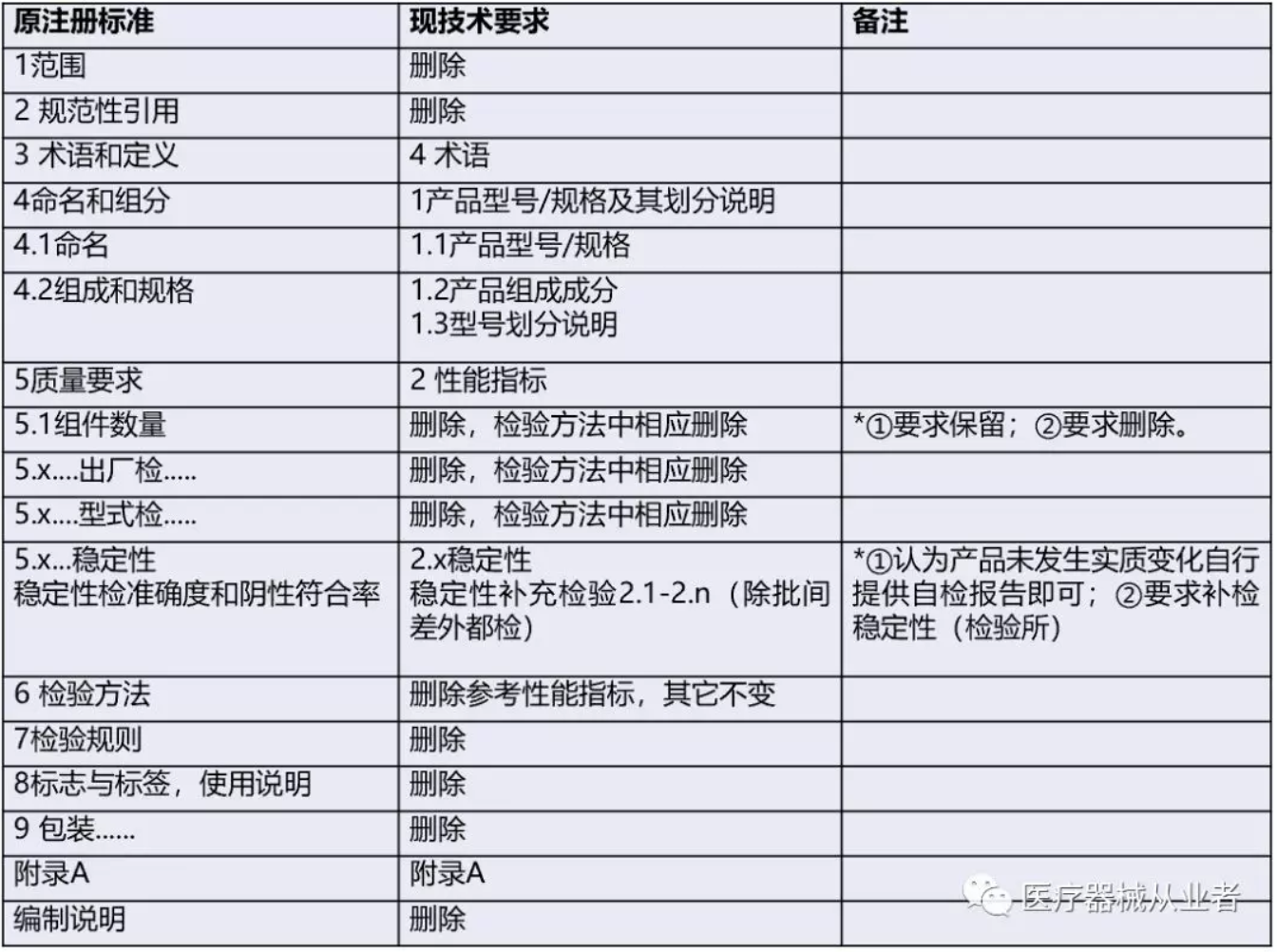
2、关于原注册标准转化为产品技术要求 转化的产品技术要求格式务必按照《体外诊断试剂说明书编写指导原则》17号通告进行修改外,其它注意点如下:
3、关于说明书 在原有说明书不变的情况下,格式严格按照《体外诊断试剂说明书编写指导原则》17号通告编制,其它注意事项如下: * 3.1【产品性能指标】按照技术要求进行修改。 3.2增加【标识的解释】 ①如果原说明书中没有该项,建议添加该项。 ②在产品相应的部位,如:标签、说明书增加相关标识。 ③【标识的解释】说明参照YY/T 0466.1-2016《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》进行解释,解释的内容是标识的符号标题。 3.3增加【生产日期及失效日期】 17号通告中并没有该项,但是实际上说明书中应该添加【生产日期及失效日期】。并注明:详见试剂盒标签。
4、关于有效期内分析报告 2018年第53号公告《国家药品监督管理局关于修改医疗器械延续注册等部分申报资料要求的公告》中明确提出,“《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第43号)附件5《医疗器械延续注册申报资料要求及说明》中第五项“注册证有效期内产品分析报告”的内容和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)附件4《体外诊断试剂延续注册申报资料要求及说明》中第五项“注册证有效期内产品分析报告”的内容均修改为:‘五、原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。’ ” but但是延续注册时仍要求提交有效期内分析报告。
5、关于产品注册证编号 《体外诊断试剂注册管理办法》5号令 附 则 第八十五条规定延续注册的,××××3和××××6数字不变。产品管理类别调整的,应当重新编号。 如产品注册是在2014年9月之前审批的,那么省内二类延续注册证编号肯定会发生变化,按新法规的要求进行编号。如产品注册是在新法规即2014年9月之后审批的,那么延续注册的注册证编号肯定不会发生变化。 6、关于IVD注册资料中的符合性声明 江苏省的符合性声明,IVD和医疗器械的版本并不相同。值得注意的是,虽然本省的延续资料清单被一一列出。但是从省局第二类体外诊断试剂延续注册页面中下载的符合性声明为器械版本。IVD版本的符合性声明仍需从IVD首次注册页面中下载。 7、关于批件的查询 省局官网-首页-政务服务-办件送达。 即可查到近期省局下发的批件
来源:医械从业者
|  /3
/3 