金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
一、引言
PCR技术的出现对于研究样品中的微量基因提供了一个强大的武器,但在某些情况下,对于许多靶序列来说,用一对引物扩增的产物仍不足以通过凝胶检测观察到,在这种情况下,就需要用到巢式PCR(nested PCR)技术了。
二、原理
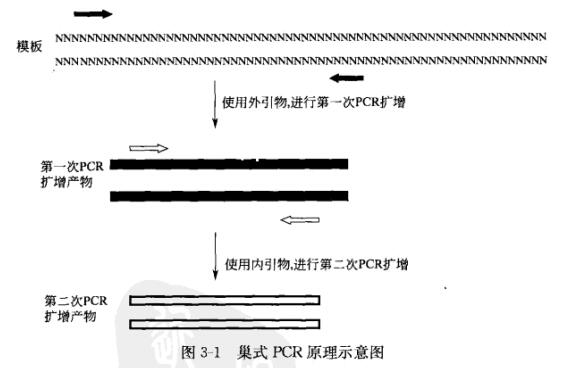
巢式PCR是一种PCR改良模式,它由两轮PCR扩增和利用两套引物对所组成,首先对靶DNA进行第一步扩增,然后从第一次反应产物中取出少量作为反应模板进行第二次扩增,第二次PCR引物与第一次反应产物的序列互补(见图3-1),第二次PCR扩增的产物即为目的产物。
使用巢式引物进行连续多轮扩增可以提高特异性和灵敏度。第一轮是15~30个循环的标准扩增,将一小部分起始扩增产物稀释100~1000倍(或不稀释)加入到第二轮扩增中进行15~30个循环。或者,也可以通过凝胶纯化将起始扩增产物进行大小选择。两套引物的使用降低了扩增多个靶位点的可能性,因为同两套引物都互补的靶序列很少,而使用同样的引物对进行总数相同的循环(30~40)会扩增非特异性靶位点。巢式PCR可以增加有限量靶序列(如稀有mRNA)的灵敏度,并且提高了一些有难度的PCR(如5RACE)的特异性。
三、材料
模板:基因组DNA或cDNA
dNTP混合液:每种脱氧核糖核苷酸的浓度为2.5mmol/L
四条特异引物:两条外引物,两条内引物,浓度均为10mol/L
TaqDNA聚合酶及其10×PCR缓冲液。
高压灭菌去离子水。
PCR扩增仪
用于琼脂糖凝胶电泳的试剂
四、方法
1.引物设计
巢式PCR的引物设计原则与常规PCR相同。通常内引物与外引物间隔多长距离也没有统一的要求,具体情况根据每个实验而定
2.模板
一般使用经过提取的基因组DNA或合成的cDNA
3.操作方法
设立50的PCR反应体系,在0.25ml的PCR管中,分别加入
10×PCR缓冲液 5μl DNA模板 5ul
2.5mmol/L的dNTP混合液 1ul TaqdnA聚合酶(5U/pl) 0.5ul
10ymol/L的外引物(Pl,P2) 各1ul H2O 至50ul
如果PCR仪没有热盖,在反应液上加一滴矿物油(约50l)。将PCR试管放入到PCR仪上。
设置PCR反应条件:
预变性 94,3min
变性 95,30
退火 55,30s
延伸 72,60s
延伸
PCR反应中的温度要根据具体反应而定,一般来说每分钟合成1000bp左右。
进行第二轮PCR反应,在0.25ml的PCR管中,分别加入:
10×PCR缓冲液 5 I cDNA模板
2.5mmol/L的dNTP混合液 1 ul TagdNA聚合酶(5U/p 0.5p
10mo/L的内引物(P3,P4) 各1H2O 至50pl
PCR反应条件同第一轮。
PCR产物的检测
反应结束后,用10μ第二轮PCR反应液进行琼脂糖凝胶电泳分析。
五、注意事项
注意事项同常规PCR
六、应用与小结
巢式PCR应用简单,所需条件与常规PCR相同,但与常规PCR相比,进一步提高了反应的特异性与灵敏性,在应用中极为广泛。对于用常规PCR方法难以扩增出的样品,可以尝试使用巢式PCR。
巢式PCR大多应用在当模板DNA含量较低时,用一次PCR难以得到满意的结果,这时用巢式PCR的两轮扩增可以得到很好的效果。范金水等分别用常规PCR和巢式PCR检测我国8个城市184例肝炎病人,其阳性率分别为9.1%~23.5%和31.8%~62.5%,说明巢式PCR的敏感性要高于常规PCR2。
在临床检测中,还会用到单管巢式PCR方法,单管巢式PCR是在传统巢式PCR的基础上将两对PCR引物作特殊的设计,巢式外侧两个引物为25bp,退火温度比较高(68);巢式内侧两个引物为17bp,退火温度较低(46),PCR反应液的其它成分与一般PCR相同。这样,通过控制退火温度(68)使外侧引物先行扩增,经过20~30次循环后(第一次PCR),再降低退火温度(46)使内侧引物以第一次PCR产物为模板进行巢式扩增,该PCR的灵敏度可达到每毫升样品检出0.3个淋球菌,而传统的一步PCR法只能检测到3个淋球菌。
|
|
 /3
/3 