金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
本帖最后由 萝卜涨价了 于 2018-9-25 编辑
一、引言
PCR在分子诊断和突变基因的检测方面起着重要作用。人们通常面对的问题是,在大量的野生型等位基因中何时存在突变的DNA序列,如何从异质癌症活组织中能得到突变的DNA般的PCR对突变的等位基因是没有内在选择性的,因而导至突变的和未突变的基因都有大致相当的扩增效率,这样下游分析工作需要对大量PCR产物进行突变体鉴定和测序,很不方便。尽管时下对种系和广谱的突变体细胞进行筛选和对未知低频突变子进行测序有一定的可靠性,但是这些技术以及其它所谓功能强大的技术仍然存在自身缺点。在许多医学领域,包括癌症、产前诊断和感染性疾病等方面鉴定基因的变异是至关重要的3。近期出现了低温变性共扩增PCR技术( co-amplification at lower denaturation temperature- PCR, COLD-PCR),这种新型的PCR方法,不管突变存在于什么位置,均能从野生型和含突变的序列的基因混合物中选择性扩增出为数不多的等位基因。因此, COLD-PCR从基因组中扩增出发生突变的等位基因的概率相对来说是很高的。DNA突变的检测技术包括 Sanger测序、实时PCR、突变体筛选、突变体基因分型和甲基化分析,由于PCR通常是基因分析的起始步骤,因此 COLD-PCR从本质上为这些技术的灵敏度提供了宽广的平台。
二、原理
COLD-PCR的原理如下,双链DNA合成时,由于单个核苷酸的错配,使得这段序列的熔点温度会产生微小的而可预测的变化。根据这段序列的上下游碱基背景和错配位置,多至200bp的序列的熔点温度一般可以变化0.2~15℃甚至更高…5。
每条DNA序列都有低于其熔点的临界变性温度(T),一旦低于这个温度时PCR的效率将急剧下降。例如,一条长167bp的p53序列,当变性温度设定在87℃时,PCR扩增的量非常可观;当变性温度设定在86.5℃时,PCR扩增有适量产物;而当变性温度设定在86℃或者更低时,就检测不到PCR产物了。因此这段序列的T≈86.5℃。
变性温度的临界点很大程度上取决于DNA的序列。当PCR变性温度设定在临界点时,由于单个碱基的不同,重复循环扩增时,导至不同的DNA有不同效率的扩增产物。在给定的序列的任何位置存在一个或者多个不一样的碱基,选择性扩增少数等位基因时,就能够观察到这种现象了。在 COLD-PCR中,为了使突变型基因和野生型的等位基因发生分子杂交,PCR循环时中间需要设定一个退火温度,异型双链杂交时的退火温度要低于同型双链,因此扩增时异型双链在T时已经变性,而同型双链仍是双链的状态将无法高效扩增。 COLD-PCR时通过将变性温度设定在T,突变子在任何位置都能大量得到扩增。
根据实验的需要, COLD-PCR分为两种应用模式,即完全 COLD-PCR和快速 COLD-PCR,前者侧重于鉴别出所有可能的突变子,后者侧重于大量得到低变性温度的突变子。
(1)完全 COLD-PCR[图14-7(a)]首先经过数个常规PCR循环,使得原始目的扩增子得到积累,然后启用完全 COLD-PCR程序。94℃变性后,PCR扩增子在中间退火温度进行杂交(70℃条件下,2~8min)。由于含有突变基因的突变体数量很少,绝大多数的突变体等位基因因两条链碱基的不能完全互补配对而终止于异源双链的状态,异源双链熔点温度要低于完全配对结构(同源双链)。然后PCR体系的温度升至T,使得异型双链变性,而同型双链未能变性,最后体系温度降至55℃,使得引物与优先变性的模板结合,为下一轮复制作准备。因为每一轮PCR都执行临界变性温度,使得含突变子的等位基因的扩增的量呈指数增长,循环到最后各个突变子基因和野生型等位基因的扩增效率就相差很大了
(2)快速 COLD-PCR[图147(b)]通过 COLD-PCR使低变性温度的突变子基因扩增的方式如下所述,大多数点突变基因即使没有中间70℃的杂交环节,也能得到扩增,因此快速PCR扩增是在专门为低熔点等位基因设置的T。下进行的,而不是94℃。例如,现在两个等位基因仅有一对碱基不同,A:T置换了G:C,在循环过程中,等位基因A:T突变子得到扩增,因为所含的碱基对A:T复制子的熔点温度要低于等
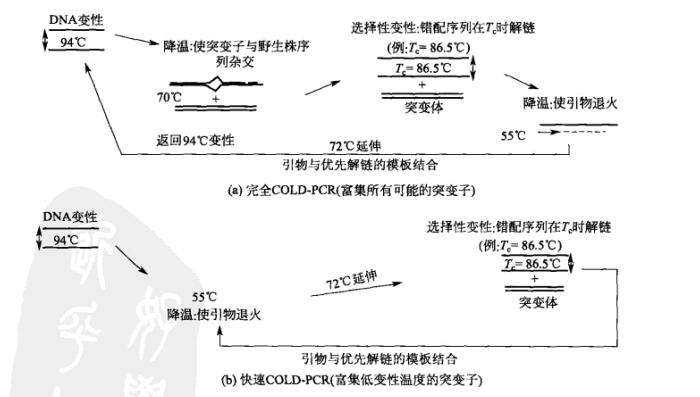
位基因G:C对于突变子的扩增,完全 COLD-PCR需要大量的PCR产物累计来获得高效的分子杂交,这就限制了PCR后阶段的扩增。不同的是,快速 COLD-PCR无需PCR产物的积累,所以突变子在早期的循环中就能得到扩增。快速COLDPCR的扩增速度要比完全〔 OLD-PCR快,扩增的量也较多。然而,要扩增出所有可能的突变子包括缺失性突变和插入型突变,完全 COLD-PCR程序还是不可或缺的。在完全 COLD-PCR时经常会出现突变子与野生型序列之间的错配,而且不管突变的核苷酸增加或降低其熔点温度,都会有扩增产物口
三、材料
①基因组DNA。
②热稳定DNA聚合酶(5U/pl)
③10×缓冲液: Tris-HCl(pH8.0),100mmol/L;KCl,500mmol/L;MgCl2,15mmol/L。
④dNTP混合液(各2.5mmol/L)。
⑤引物(上下游各20pmol/L)。
⑥灭菌蒸馏水。
四、方法
1.临界变性温度(T)的确定
以常规PR方法,将模板变性温度按照一定温度梯度降低(例如0.5℃),当温度降到一定温度后,会有适量产物,而温度再降低时,不会再出现PR产物,此温度即可定为该模板DNA链的T。
五、反应体系(50示例)
热稳定DNA聚合酶(5U/pl) 0.25 为例)
10×缓冲液 5pl引物1(20;mol/L) lul
dNTP混合液(各2.5mmol/L) pl引物2(20gmol/L) lul
基因组DNA(人类基因组DNA0.1~1pg灭菌蒸馏水补齐至50p
3反应条件
(1)完全 COLD-PCR94℃5min;94℃30s,55℃30s,72℃3min,10~30循环;94℃30s,70℃2~8min,T3s,55℃30s,72℃3min,30循环。
(2)快速 COLD- PCR94℃5min;94℃30s,55℃30s,72℃3min,10~30循环;94℃30s,T3s,55℃30s,72℃3min,30循环
4.结果分析
COLD-PCR可作为检测突变基因的起始步骤,其产物可结合MALD-TOF基因分型、Sanger测序、实时PCR、突变体筛选、突变体基因分型和甲基化分析等进行分析,从而鉴定包括癌症、产前诊断和感染性疾病等方面的基因突变情况,需要特别指出的是, COLD-PCR常和荧光实时定量PCR联合使用,以增强检测突变基因的能力,提高检测效率,联合使用时,PCR体系按照荧光实时定量PCR建立,PCR反应条件中在退火温度步骤加入荧光读取操作。
五、小结
在未来的分子医学时代中,肿瘤的临床诊断会越来越依靠肿瘤的分子资料。对包括异型的肿瘤和体液等各种临床体细胞癌变样本的检测手段的依赖性也会与日俱增。 COLD-PCR代替普通PCR更加推进了这些技术的广泛应用,并且能特异性扩增和分离各微型缺失突变子。COLDPCR有望在生物标记检测、示踪、基因组多样性、传染病、DNA甲基化检测和母血胎儿等位基因的产前鉴定等领域有更加广泛的应用。
|
|
 /3
/3 