登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
沉淀反应(precipitation) 可溶性抗原与相应抗体在有适量电解质存在下,出现肉眼可见的沉淀现象,称为沉淀反应。参与反应的抗原称沉淀原(precipitinogen),抗体称沉淀素(precipitin)。沉淀原可以是多糖、蛋白质、类脂等,由于其体积小,相对反应面积大,故试验时需对抗原进行稀释,以避免后带现象。应用较早的沉淀反应是环状沉淀反应(ring precipitaion)和絮状沉淀反应(flocculation precipitation),因其敏感性不高,已被淘汰。目前应用最多的沉淀反应是Oudin建立的凝胶(琼脂)沉淀反应及其派生方法。
1.单向琼脂扩散(simple agar diffusion) 简称单扩,将特异性抗体与熔化的琼脂混合均匀,使抗体均匀分布于琼脂,然后浇制成琼脂板,再按一定要求打孔并加入抗原,使抗原向孔周自由扩散,与板中的抗体形成沉淀圈。本法为定量试验,沉淀圈的直径与抗原浓度成正比。单扩常用于血清中免疫球蛋白、AFP等的定量测定。
2.火箭电泳(rocket electrophoresis) 若在单向琼脂扩散基础上,加入抗原后,将琼脂板置电场中,使抗原置于负极即向正极定向扩散,在与板中的抗体结合而形成锥形沉淀峰,形似火箭,故名火箭电泳。沉淀峰的高度与抗原浓度成正比。由于在电场作用下,促使带负电荷多的抗原泳动,故火箭电泳需时短,可用于快速测定抗原含量,如在标本中加入少量同位素标记的抗原后,可作放射免疫自显影,能检出微量抗原。应用范围与单扩相似。
3.双向琼脂扩散(double agar diffusion) 简称双扩,先制备琼脂板,再按要求打孔并分别加入抗原和抗体,使两者同时在琼脂板上扩散,若两者对应且比例合适,则在抗原和抗体两孔之间形成白色沉淀线。一对相应的抗原抗体只形成一条沉淀线,因此可根据沉淀线的数目推断待测抗原液中有多少种抗原成分;根据沉淀线的吻合、相切或交叉形状,可鉴定两种抗原是完全相同、部分相同还是完全不同(图18.4)。本法常用于定性测定抗原抗体,亦可用于判断免疫血清的效价。
双向琼脂扩散试验 4.对流免疫电泳(counter immunoelectrophoresis) 若在双扩基础上加电泳,将抗原孔置负极端,抗体孔置正极端。由于抗原所带的负电荷较抗体多,且抗原分子小于抗体,在电场中能够克服电渗的作用而由负极泳向正极;抗体却克服不了电渗作用,从正极向负极移动,二者形成对流,并在比例适宜处形成白色沉淀线,称为对流电泳。因抗原抗体皆作定向运动,所以敏感性较双扩为高。 除上述方法外还有多种免疫沉淀分析技术,如区带电泳和双扩相结合的免疫电泳(immunoelectrophoresis)、区带电泳与火箭电泳联用的交叉免疫电泳(cross immunelec-trophoresis),及免疫选择电泳、免疫固定电泳等,分别应用于复杂抗原成分的分析和骨髓瘤、冷球蛋白血症等临床疾病的辅助诊断。随着精密仪器的研制成功,最近又建立了散射比浊、速率散射比浊等方法,使沉淀反应技术更加敏感、精确和自动化。
补体结合试验 补体结合试验(complement fixation test,CFT)该试验是在补体参与下,以绵羊红细胞和溶血素作为指示系统,来检测未知的抗原或抗体的血清学试验。有五种成分参与,分为指示系统和待检系统(已知抗原和未知抗体或已知抗体和未知抗原)。补体用新鲜豚鼠血清。方法是将已知的抗原或抗体与未知标本(可能含相应抗体或抗原)充分混合,再加入补体作用一段时间,最后加入指示系统。若待检系统有相应抗体或抗原,则能形成抗原抗体复合物,从而消耗了补体不出现溶血现象,此为阳性;相反,出现溶血则为阴性。补体结合试验的影响因素较多,正式试验前需对已知成分作一系列滴定,尤其是补体,应选择适宜的量参与反应,避免假性结果。每次试验尚需同时设立多种对照,以作为判断结果可靠性的依据。该法对颗粒性或可溶性抗原均适用,临床上常用于检测某些病毒、立克次氏体和螺旋体感染者血清内的中的抗体,亦可用于某些病毒的分型。
中和反应 中和反应(neutralization) 毒素、酶、激素或病毒等与其相应的抗体结合后,导至生物活性的丧失,称为中和反应。常用的中和试验有病毒中和试验和毒素中和试验。 1.病毒中和试验(virus neutralization) 是检测抗病毒抗体(中和抗体)的中和试验。当机体感染病毒后,能产生特异性的抗病毒中和抗体,可使相应的病毒失去毒力。将待检血清与病毒悬液混合,接种于细胞培养,根据对细胞的保护效果判断病毒是否已被中和,并计算出“中和指数”,即代表中和抗体效价。该试验可将已知免疫血清用于病毒鉴定,或用已知病毒检测患者血清内的中和抗体,用于流行病学调查及病毒性疾病的诊断。 2.毒素中和试验(toxinneutralization) 抗链球菌溶血素O试验(antistreptolysin O test),简称抗“O”试验,是体外的毒素抗毒素中和试验。乙型溶血性链球菌能产生溶解人或兔红细胞的溶血素O,具有抗原性,能刺激机体产生相应的抗体。当该毒素与相应抗体作用时,毒性被中和而失去溶血活性。试验时,病人血清先与溶血素O混合,作用一定时间后加入人红细胞,若不出现溶血表明待测血清中有相应抗体(抗O),即为阳性。本试验可根据抗体的含量并结合临床,帮助风湿病等免疫相关性疾病活动期的诊断。由于健康人血清中也有一定量的抗体,其含量与地区、季节、年龄等因素有关,因此检测到抗体并不一定表明疾病处于活动期。而当效价高达500单位以上时,才有临床意义。
免疫标记技术 为提高抗原和抗体检测的敏感性,将已知抗体或抗原标记上易显示的物质,通过检测标记物,反映有无抗原抗体反应,从而间接测出微量的抗原或抗体。常用的标记物有酶、荧光素、放射性同位素、胶体金及电子致密物质等。这种抗原或抗体标记上显示物所进行的特异性反应称为免疫标记技术(immunolabelling technique)。
免疫标记不仅大大提高了试验敏感性,若与光镜或电镜技术相结合,能对组织或细胞内的待测物质作精确定位,从而为基础与临床医学研究及诊断提供方便。免疫标记技术大致分为两大类:一类属于免疫组织化学技术(immunohistochemical technique),用于组织切片或其他标本中抗原的定位。另一类称为免疫测定(immunoassay),用于液体标本中抗原或抗体的测定。
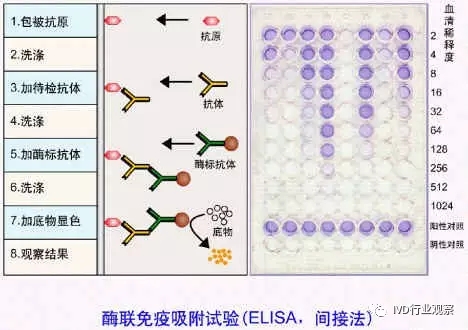
免疫酶技术(immunoenzymatic technique) 最早应用的免疫酶技术是免疫酶组织化学染色,即用标记的抗体与标本中的抗原发生特异性结合,当加入酶的底物时,在酶的作用下经一系列生化反应产生有色物质,借助光镜作出定位判断。目前,应用最广泛的是酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)。该法特异性强,敏感性高,既可检测抗体,又能测定可溶性抗原。主要方法及操作要领见图18.5,除了图示的两种方法外,还有抗原竞争法,现较少应用。ELISA常采用的酶为辣根过氧化物酶(hosradish peroxidase,HRP),其底物是二氨基苯胺(DAB),底物被分解则呈棕褐色,可目测或借助酶标仪比色。ELISA为非均相免疫测定,另外还有均相法,在此不作介绍。
由于酶免疫测定无需特殊仪器和试剂,且操作简便,利于普及。因此,在免疫标记技术中,该法应用最为广泛,并在原有方法基础上加以改良,使得众多新的,更敏感的方法应运而生。①生物素-亲和素放大系统(biotin-avidin system,BAS),建立于70年代后期,通过将酶标记在生物素或亲和素上,借助生物素与亲和素的高度亲力和生物素能与抗体结合的特点应用于ELISA,显著提高了检测的敏感性。②双表位ELISA(two-site ELISA),其方法同双抗体夹心法,只是将包被的抗体和酶标抗体换成针对两个不同抗原决定簇的单抗,用于检测单抗的亲和性及表位特异性,亦可用于标本中抗原的快速检测,即在试验时可将待测抗原与酶标单抗同时加入反应体系,减少检测步骤。③斑点免疫渗滤试验(dot immunofiltration assay,DIFA),其原理与ELISA相同,但以微孔膜(如硝酸纤维素膜、尼龙膜等)代替聚苯乙烯板作载体。试验时,将包被有抗原或抗体的微孔滤膜贴置于吸水材料上,依次滴加的标本、酶结合物、底物,分别进行洗涤,多余的标本和酶标抗体及洗涤液等可渗滤入吸水材料中,最后阳性标本在膜上呈现着色斑点。④酶联免疫电转移印渍法(enzyme linked immunoelectrotransferblot,ELIB),该法将免疫转印技术与酶标技术相结合,有利于分析和检测更加复杂的抗原成分。ELIB分三阶段进行。第一阶段为SDS-聚丙烯酰胺凝胶电泳,先将抗原分成不同的区带(肉眼不可见);第二阶段为转移电泳,即将凝胶上的电泳区带经电泳转移至硝酸纤维素膜上;第三阶段为酶免疫定位,用特异性抗体和酶标抗抗体作间接ELISA,结果阳性区带呈显色反应。
2.免疫荧光技术(immunofluorescence techniques) 该法是以荧光素,如异硫氰酸荧光素(fluorescence isothiocyanate,FITC)、罗丹明等标记抗体或抗原,以检测标本中抗原或抗体的方法。免疫荧光技术也包括两种基本类型,即荧光抗体染色(fluorescentantiboby technique)和荧光免疫测定(fluorescein immunoassay)。①荧光抗体染色:是用荧光抗体浸染可能含有抗原的细胞或组织切片,若有相应抗原存在,则抗原与荧光抗体结合而使荧光素不被洗脱,在荧光显微镜下可见发光的物体,从而达到定位检测目的,在基础与临床医学的研究及疾病的诊断等方面有着广泛用途。根据荧光抗体的不同可分直接法和间接法,前者即用荧光标记的第一抗体直接检测标本片上的抗原,如病毒及某些蛋白质成分等;后者则在未标记的相应抗体(第一抗体)处理标本片后,覆以荧光标记的抗球蛋白抗体(第二抗体),借此可检测多种抗原与抗体。与直接法相比,间接法仅需标记一种第二抗体即可适应多种抗原抗体系统的检测,且敏感性较高。②荧光免疫测定:本法与酶免疫测定一样,可分均相和非均相法。均相法常利用荧光的某些特性,如荧光的激发、吸收、猝灭等设计试验,无需作结合的与游离的标记物分离。双标记法即为均相荧光免疫测定的一种类型,检测试剂为FITC标记的抗原和罗丹明标记的抗体,当两种标记物标记的抗原和抗体特异性结合后使两种荧光素靠近,由于FITC的发射光谱能被罗丹明吸收,从而使FITC的荧光明显减弱。试验时将可能含有抗原的标本与两种标记物一起反应,则能与FITC标记的抗原竞争结合罗丹明标记的抗体,从而减少罗丹明对FITC发射光谱的吸收。通过FITC荧光测定可推算出标本中抗原的量,其与荧光强度成正比。非均相法限于实验室条件、试剂和容器或载体的非特异性荧光干扰等,应用不及ELISA广泛。近年建立的时间分辨荧光免疫测定(time resoloved fluorescence immunoassay,TR-FIA)有很大改进,该法利用稀土金属(铕、铽等)的螯合物具有特长的荧光寿命,将其标记抗体并延长测定时间,以使短命的非特异性荧光衰退,从而测得均一的长寿命稀土螯合物荧光。此外稀土螯合物的激发光吸收峰(340nm)与荧光发射峰(613nm)之间的差别显著,也利于排除非特异荧光的干扰。目前已用于IgE等微量血清成分及激素和某些药物水平的测定。
3.放射免疫测定(radioimmunoassay,RIA) RIA是最敏感的免疫标记技术,精确度高且易规格化和自动化。但由于放射性同位素有一定的危害性,使其临床应用受到一定限制。目前主要应用于激素(如HCG、胰岛素)和药物浓度的检测。①液相放射免疫分析:为经典的放射性同位素标记技术(radio-isotypelabeliingtechnique),简称放射免疫分析。其原理是用已知的标记抗原与标本中可能存在的抗原竞争一定量的已知抗体,分别形成标记的和无标记的抗原抗体结合物。再经某些途径分离结合的(B)与游离的(F)标记物,并根据测得的放射性强度,算出结合率[B/B+F],此与标本中抗原的量成反 New Roman'; mso-hansi-font-family: 'Times New Roman'">],此与标本中抗原的量成反比。试验时除作标本检测外,还要以不同浓度的已知抗原参与反应得到的数据绘制出竞争抑制曲线,作为定量分析的依据。液相放射免疫测定的另一类型是免疫放射测定(immunoradionmetricassay,IRMA),试验时受检抗原与过量的标记抗体反应,然后加入固相的抗原免疫吸附剂,以结合游离的标记抗体,经离心后测定上清液中放射性强度,从而推算出标本中抗原的含量。②固相放射免疫测定(solidphase radioimmunoassay,SPRIA):其原理、方法和应用与ELISA基本相同,区别在于标记物和检测仪。SPRIA的敏感性略高于ELISA。与RIA相比,该法既可用已知的标记抗原测抗体,也可用已知的标记抗体测抗原。主要应用于特异性IgE的检测。
4.免疫胶体金标记技术(immunologic colloidal gold signature,ICS) 胶体金是分散相粒子的金溶液,经凝聚法制成的金溶胶颗粒表面带有较多电荷,能吸附抗体形成金标记的抗体。用这种金标记抗体与组织或细胞标本中的抗原反应,借助显微镜观察颜色分布即可定位、定性测定组织或细胞中的抗原。该法最早用于免疫胶体金标记电镜技术,利用胶体金颗粒高电子密度,经衬染后对超微切片中的抗原作定量或定位研究。继后又应用于光镜并根据金催化还原银离子的原理,结合摄影技术以银增强金标抗体的可见性,建立了免疫金银法(IGSS)。此外,若将荧光素吸附于胶体金,在荧光显微镜下作定向性分布及定位观察荧光染色标本,可增强荧光效果。胶体金标记技术发展较快,如胶体金斑点渗滤试验和胶体金斑点免疫层析试验,尤其是后者检测敏感度高,操作简单,时间短,1~2分钟即可出现结果,已应用于HCG和HBV和两对半的检测。方法简述如下(图18.6),试验用的均为干试剂,多个试剂被组合在一狭长的试剂条上,条上端(A)和下端(B)分别为吸水性材料,胶体金标记的特异性抗体干片粘贴在B的近D处,紧接着为硝酸纤维膜,其上有两个反应区域,测试区(T)包被有与待检抗原相应的特异性抗体,对照区(C)包被有对应的抗IgG抗体(二抗)。测试时将试纸下端浸入液体标本中,通过吸水材料虹吸作用吸引标本液向上移动,经过D处时如标本中有与金标抗体相应的抗原,两者即结合,胶体金颗粒发生聚集变为红色。反之则不发生变化。过剩胶体金标记的抗体继续向前,与对照区的二抗结合,出现红色质控条带
来源: IVD行业观察 |  /3
/3 