登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
在晚期或转移性癌症患者的血液中,循环肿瘤细胞(CTC)与循环肿瘤DNA(ctDNA)的浓度要比癌症早期的患者高出许多。利用这一特性,研究人员想要将它们开发成诊断转移性癌症的生物标志物。研究人员相信,如果能分离出和肿瘤不同阶段有关的循环肿瘤细胞,也许就能了解癌症进展和扩散的关键机制。这些思考衍生出了“液体活检”。如今,研究人员了解到,患者体液样本中分离出的CTC,ctDNA与外泌体不但能标志肿瘤的严重程度,也标志着肿瘤在不同阶段所拥有的细胞多样性。开发出高灵敏度和高特异性的检测手段,在癌症的诊断上会有巨大的价值。今日,我们将结合《Nature Biomedical Engineering》的特刊,为各位读者送上早期诊断专题。在本篇文章中,我们将回顾CTC,ctDNA与外泌体的生物特性,介绍它们目前的诊断方式,并且讨论潜在的临床应用。

▲近日,《Nature Biomedical Engineering》推出了早期诊断专题(图片来源:《Nature Biomedical Engineering》) 循环肿瘤细胞 癌症的原发病灶会将一些肿瘤细胞释放到血液中。这些细胞一般具有侵袭性,并对失巢凋亡(anoikis)具有耐受。因此,它们能在肿瘤原发部位之外的器官(如肝脏、骨骼、肺部和大脑)安家,产生新的肿瘤。 尽管目前对这些细胞的研究还非常不足,研究人员们相信这些细胞可能是依赖于趋化因子的浓度梯度而发生的迁徙,或是依赖于这些细胞表面表达的特定受体。一些研究表明,如果这些细胞要脱离原发病灶或其他的转移性位点,它们必须先获得一类能帮助迁徙的侵袭性性状,这与上皮-间质细胞转型(epithelial-to-mesenchymal transition,EMT)有关。研究人员甚至相信,肿瘤细胞不必完成EMT的所有步骤,就足以产生新的肿瘤——这种转变让肿瘤细胞具有高度可塑性,并让它们具有发生间质-上皮细胞转型(mesenchymal-to-epithelial transition,MET)的潜力,使它们易于在体内的其它位点生根。目前,研究人员正在验证EMT/MET模型在肿瘤患者中的作用。
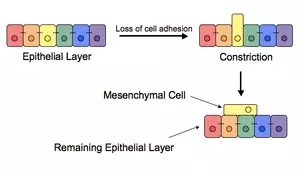
▲表皮-间质细胞转型让肿瘤细胞具有了高度可塑性(图片来源:维基百科) 一些临床研究表明,CTC的生命周期理应极短,大概只能存活1-2.4个小时。然而,这些细胞会想尽一切办法活得更久。在一些研究中,易于被免疫细胞攻击的CTC会通过在细胞表面表达PD-L1蛋白来伪装自己,让免疫系统失活。在另一些研究中,被血小板包裹的CTC也对免疫系统介导的细胞裂解有更好的保护。研究人员们指出,事实上,由于肿瘤细胞容易聚集并停留在微血管中,它们很容易出现外渗,从而离开血液循环。就是这种短暂的“搭便车”,对癌症的转移起到了决定性的作用。 目前,研究人员经常使用的CTC富集方法利用了这些细胞的物理或生物特性。比如说,我们能用抗体去特异结合表面表达上皮细胞粘附分子(epithelial cell-adhesion molecule,EpCAM)的CTC,或是通过装置去区分血细胞与大型肿瘤细胞。另一方面,我们也能使用“反向富集”的手段,在血液中去除血细胞,留下肿瘤细胞。 无论采取哪种方法,这些富集后的细胞将被用于免疫学、细胞生物学和功能上的分析。举例来说,在过去10年里,研究人员们用EPISPOT(epithelial immunospot)技术在许多不同的癌症类型中检测CTC。此外经过长期培养后的CTC,或是在免疫缺陷型小鼠上进行异种移植CTC,都能被用来检测药物的效果。
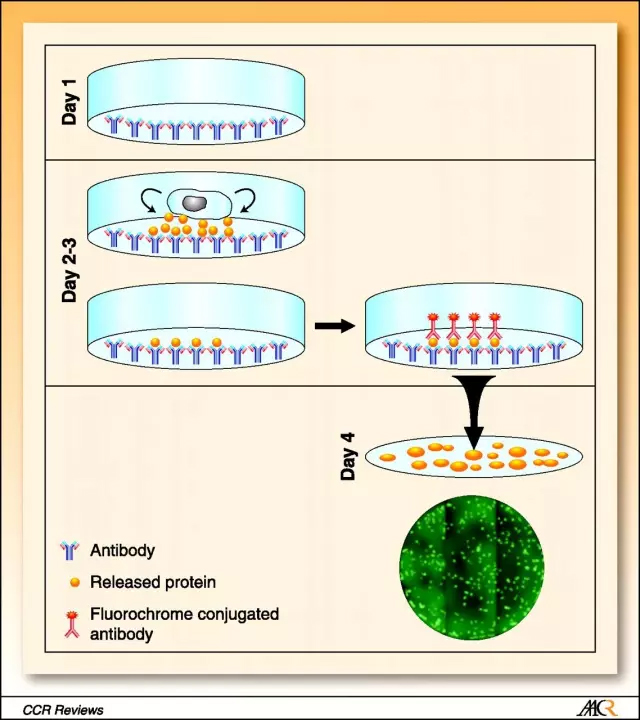
▲EPISPOT技术的原理(图片来源:Clinical Cancer Research) 然而,考虑到CTC细胞的含量较低,在血液里进行CTC的富集依然是个不小的挑战。因此,研究人员需要寻找到合适的CTC生物标志物,并对其进行验证,提高富集效率。这对于晚期或复发型的癌症患者来说,尤其关键。 在治疗前的病人分层(stratification)、实时监测治疗效果、鉴定治疗靶点、检测耐药性的机制、以及评估复发或转移的风险上,CTC得到了很广泛的应用。举例来说,在一项研究中,研究人员招募了168名慢性阻塞性肺病(COPD)患者,并在其中5名患者体内检测出了肺癌CTC。果不其然,这5名患者随后罹患上了肺癌。这些初步的结果表明了CTC对于肺癌检测的特异性。 类似的,研究人员也在用CTC来评估乳腺癌与前列腺癌疗法的早期治疗效果,拓展CTC的更多应用可能。在一项临床试验(NCT01710605)中,研究人员利用CTC来选择转移性HR受体阳性乳腺癌患者的一线疗法;在另一项临床试验(DETECT III,NCT01619111)中,尽管患者的转移性乳腺癌是HER2阴性,但她们CTC的HER2检测结果则让研究人员决定使用靶向HER2的疗法进行治疗;第三项临床试验(TACTIK)里,医生们利用CTC来评估转移性去势抵抗前列腺癌症患者是否需要接受化疗。 循环肿瘤DNA 发生凋亡和坏死的细胞会将DNA释放到肿瘤中。在癌症患者内,ctDNA水平的上升也被认为具有诊断的潜力。目前,学界的主要假设认为在这些DNA中寻找到的肿瘤相关突变,能够很好地反映出原生肿瘤和转移病灶的异质性。这些研究已经取得了一些实际应用上的进展。2016年,美国FDA批准了首个相关的诊断测试(cobas EGFR Mutation Test v2),用来检测肺癌患者血液中DNA内带有的EGFR基因突变。作为EGFR抑制剂erlotinib的伴随测试,它能通过PCR扩增的手段,检测19号外显子删除或21号外显子中L858R点突变等特异性突变。
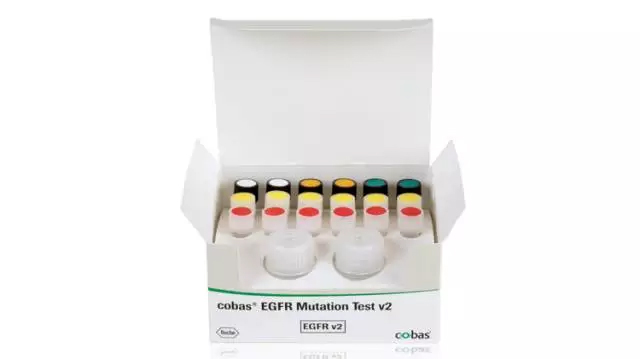
▲罗氏研发的cobas EGFR Mutation Test v2是首个经美国FDA批准的ctDNA相关伴随测试(图片来源:罗氏) 在结直肠癌患者中,在确定KRAS、NRAS和BRAF基因的突变上,研究人员也确认了ctDNA和组织间获取的信息大体上高度一致。在一些偶尔的情况下,血检会发现一些手术的样本中没有发现的KRAS突变,这也反映了组织活检可能无法全面反映肿瘤的异质性,进一步体现了将液体活检作为临床金标准的重要。 值得一提的是,这些液体活检手段能被用来指导EGFR突变非小细胞肺癌患者的治疗。这些患者的病变组织难以获得,因此液体活检能提供更多的信息。在巨大的临床应用潜力面前,研究人员相信,我们需要进一步的研究,来表明液体活检在临床上是否足以让医生采纳或不采纳某种特定疗法。 循环肿瘤DNA的另一项应用是在患者切除肿瘤后检测残留病灶。一些研究已经发现,在结直肠癌患者中,它能被用来进行术后监控。这些应用能提供重要的病情进展信息,帮助那些有高复发风险的患者尽早采取干预措施。
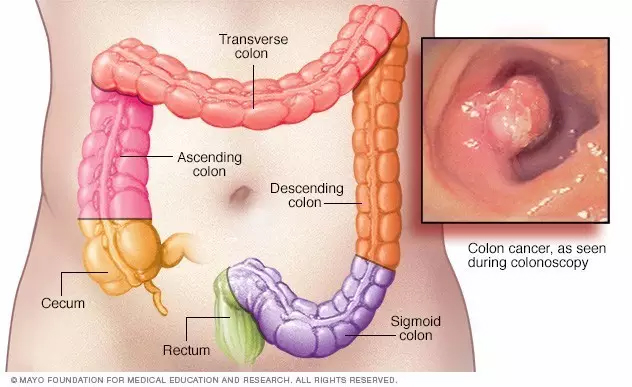
▲循环肿瘤DNA也能被用于检测结直肠癌手术后的肿瘤残留病灶(图片来源:Mayo Clinic) 对早期肿瘤患者的ctDNA检测有助于带来全新的癌症筛选技术,但它们在灵敏度、特异性和生物复杂度等方面也还存在着一些挑战。举例来说,人们只在少于40%的早期肿瘤患者的ctDNA中找到了P53蛋白相关的突变。而对于不同的癌症类型来说,尽管用上了灵敏的数字PCR技术,ctDNA的检出率仍只有48%-73%不等。更重要的是,与癌症有关的突变,并不一定只出现在癌症患者中——一些突变可能会导至良性的状况。由于这一现象,基于ctDNA的检测可能会让患者出现焦虑,并带来不必要的治疗。因此,研究人员相信我们需要验证在ctDNA在每个特定情况下的临床潜力,而不是开发一种泛泛的检测工具。 为了在早期癌症诊断中达到尚可的灵敏度和特异性,临床研究人员需要决定哪些情况才适用这些先进的技术。比如说,我们需要大量研究来找出“癌症特异性突变”与合适的“量化标准”的组合,以避免过度诊断。因此,我们需要DNA测序技术做到既广泛(能涵盖大部分肿瘤异质性),又深度(能在大量正常DNA中找到少量的突变DNA片段)。目前,我们已经在多种癌症上应用了高灵敏度的技术,它可以在血液中检测到少于0.1%的ctDNA。但它也有一些限制。首先,它在早期癌症患者中的血样未必能代表整个癌症基因组。其次,一些非恶性的细胞死亡后会释放出一些正常的DNA,这会进一步稀释ctDNA在血液中的浓度,影响定量分析。 外泌体 外泌体包含了大量从母细胞中获得的细胞组分,它们包括了蛋白质、mRNA、miRNA、甚至是DNA。这些物质对于癌症进展来说非常关键。比如,它们能调控癌症的微环境,在CTC抵达前,建立起一个适合转移的位点。目前,外泌体的分离主要通过超速离心,或是基于抗体的方法。利用微流体科技,通过表面等离子体共振(surface plasmon resonances)的新式外泌体检测技术也已成为了可能。 在一些分析中,研究人员发现,检测血液和其他体液中的外泌体,能鉴别出实体瘤特异的蛋白靶点,血清中的外泌体中也带有胶质母细胞瘤相关的miRNA和mRNA突变。此外,通过分析外泌体miRNA,研究人员找到了肺癌、前列腺癌、胰腺癌和卵巢癌等一系列疾病的标志物。目前,外泌体和它们的内含物还是一块未经广泛探索的蓝海。在外泌体分离、富集和鉴定上的更优策略能促进外泌体生物学的发展,并将外泌体在临床上转化为特定疾病的生物标志物。
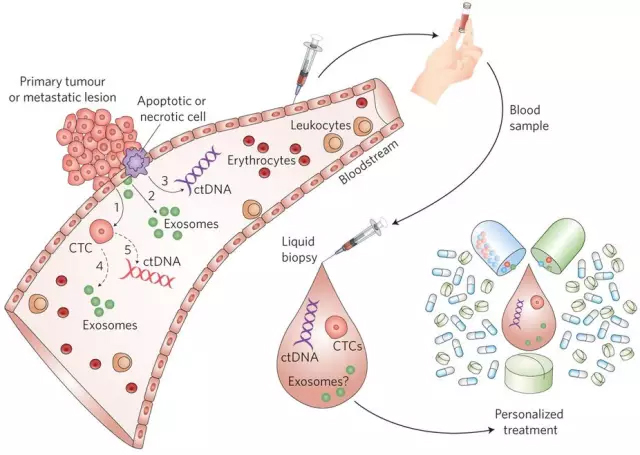
▲多种手段共同使用,有望带来更好的早期诊断结果(图片来源:《Nature Biomedical Engineering》) 前景 目前,液体活检中分离出的CTC或ctDNA关注于病人的分层和癌症患者的个体化监控。这些应用会让精准医疗计划更好地落到实处,并实时为癌症患者进行疾病发展和疗法效率的监控。考虑到CTC和ctDNA能用不同的分子去探寻,这两者之间有望在临床上形成互补。举例来说,我们可以同时检测表达PD-L1的目标,以及产生耐药性的RNA变体。最近取得巨大发展的外泌体生物学则会提供更多宝贵的临床信息。这些技术上的发展以及这些技术产生的大量信息能被用于癌症的伴随诊断。 参考资料 [1] Clinical prospects of liquid biopsies [2] 《Nature Biomedical Engineering》早期诊断特刊 来源:药明康德
|  /3
/3 