登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
卵巢癌不是一种单一的疾病,包括至少5种组织学亚型,不同亚型的风险因素、细胞起源、分子组成、临床特征和治疗手段都有所不同。卵巢癌是全球性的问题,通常发现时已经处于晚期阶段,并且没有有效的筛查手段。对于新诊断的病人,标准的治疗手段包括肿瘤细胞灭减术和以铂类药物为基础的化疗。对于复发性癌症患者,目前临床使用的药物有化疗药物、抗血管生成药物和PARP(聚腺苷二磷酸核糖聚合酶)抑制剂,免疫治疗药物还处在临床研究阶段。随着卵巢癌高风险因素相关基因(例如BRCA1和BRCA2)的发现,对于鉴定卵巢癌高风险人群和针对卵巢癌的个性化药物开发有重要作用。 流行病学全球每年新诊断的卵巢癌患者有22.55万人,每年因卵巢癌死亡的人数为14.02万人。过去的10年时间里,卵巢癌的死亡率并没有明显的改善。卵巢癌患者的总体生存率为45.6%,但是这个数据与初始诊断的癌症分期有很大关系,初始诊断为卵巢癌Ⅰ期的病人5年生存率为92.1%,初始诊断为Ⅲ期和Ⅳ期的病人5年生存率仅为25%。 基因突变 卵巢癌的发病风险与一系列的遗传因素有关。BRCA1和BRCA2基因突变是目前研究较为透彻的与卵巢癌发病相关的基因突变,有17%的卵巢癌患者伴有BRCA1或者BRCA2突变。此外,BRCA突变也会增加其他癌症的患病风险,例如乳腺癌(BRCA1和BRCA2)、胰腺癌(BRCA2)、前列腺癌(BRCA2)、黑色素瘤(BRCA2)和浆液性子宫内膜癌(BRCA1)等。卵巢上皮癌的多数亚型都与BRCA突变有关,但这种突变在高级别浆液性癌(HGSCs)中最常见,在粘液性癌中最罕见。目前,BRCA突变的卵巢癌患者的生存率相较BRCA野生型患者有所提高。另外,BRCA2突变型卵巢癌患者的总体生存率也高于BRCA1突变型,这可能是由于BRCA2突变增强了肿瘤细胞对铂类化疗药物的敏感性。除了BRCA1和BRCA2,其他在DNA修复过程中的基因突变也会增加卵巢癌发病风险,包括Fanconi anaemia–BRCA通路中的基因,例如RAD51C、RAD51D、BRIP1、BARD1和PALB2。另外,CHEK2、MRE11A、RAD50、ATM和 TP53等其他在DNA修复过程中的基因突变也与卵巢癌发病相关。 合成致死 在介绍卵巢癌个性化药物之前,先简单介绍一下“合成致死”的概念。合成致死最早是Bridges在1922年在果蝇中观察到的一种遗传现象,之后在1946年由Dobzhansk对其命名。对于细胞中的两个基因,其中任何一个单独突变都不会导至细胞死亡,而两者同时突变就会就会导至细胞死亡,这种现象就称为合成致死。在合成致死现象发现的早期,就有人提出利用这一理念来指导抗肿瘤,但直到阿斯利康成功将PARP抑制剂Olaparib推向市场,才真正将合成致死成功地运用在抗肿瘤药物开发上。 聚腺苷酸二磷酸核糖基聚合酶(PARP)是一种单链DNA修复酶,其通过碱基切除修复( base excision repair,BER) 途径对DNA复制过程出现的单链损伤( SSBs)进行碱基切除修复。BRCA基因(BRCA1、BRCA2)是双链DNA损伤(DSBs)同源重组修复途径(homologous recombination,HR)中的关键基因,BRCA1/2缺陷会使DSBs无法修复,从而增加细胞死亡的概率。由于PARP抑制与BRCA1/2缺陷在单独存在时都不会引起细胞死亡,而二者同时存在就会致死,所以PARP 与BRCA是合成致死的关系(图1)。PARP抑制剂Olaparib正是利用这一机制,对BRCA突变的卵巢癌发挥作用,成为治疗BRCA突变卵巢癌患者的个性化药物。
图1:PARP抑制剂对BRCA1/2缺陷性细胞的选择性合成致死作用(修改自Nat. Rev. Clin. Oncol., 2010, 7, 508-519)
已上市个性化药物 Olaparib(Lynparza,图2)的原研公司是英国生物技术公司KuDOS Pharmaceuticals,2005年阿斯利康将KuDOS公司收购后,由阿斯利康继续开发这款药物。Olaparib是首创的口服PARP抑制剂。在欧洲,Olaparib被批准用于对铂类药物敏感的复发性BRCA突变的高级别浆液性上皮性卵巢癌、输卵管或原发性腹膜癌患者的治疗。在美国,Olaparib被批准用于BRCA突变(用FDA批准的检测方法)的,且经过化疗的晚期卵巢癌患者的治疗。Olaparib的上市之路颇为坎坷,Ⅰ期临床实验表现积极,但Ⅱ期实验结果逊色许多,以至于阿斯利康考虑有没有必要进行Ⅲ期临床实验。加上2011年,Sanofi公司开发的一种声称是PAPR抑制剂的药物iniparib(最后证实并非PARP抑制剂)针对三阴性乳腺癌的临床Ⅲ期结果不尽人意。一时间,市场上对PARP抑制剂这类药物的兴趣已经明显减弱了,阿斯利康也一度停止了对Olaparib的研发。直到英国伦敦大学癌症研究所的肿瘤学家Jonathan Ledermann对实验数据进行重新分析时,情况才发生了改变,公司将焦点放在了携带BRCA1或BRCA2突变的癌症患者身上。2013年9月,阿斯利康启动OlaparibⅢ期SOLO项目,旨在调查olaparib作为一种单药疗法,用于携带BRCA突变铂敏感卵巢癌患者维持治疗的疾病无进展生存期(PFS)利益。随后在2014年3月,FDA授予Olaparib优先审评资格,但2014年6月,FDA专家评审委员会以11:2的票数反对Olaparib上市,认为阿斯利康公司提供的关于Olaparib的研究数据无法证明其安全性,同时也未能表明该药物对患者生存率的改善。之后阿斯利康又提供了更多的有力证据,才使Olaparib最终在2014年12月获得FDA的批准,用于BRCA突变的晚期卵巢癌的3线治疗。目前除了卵巢癌,Olaparib针对其他肿瘤适应症的研发也在进行之中,Olaparib的研发历程如图3所示。

图2:Olaparib的化学结构
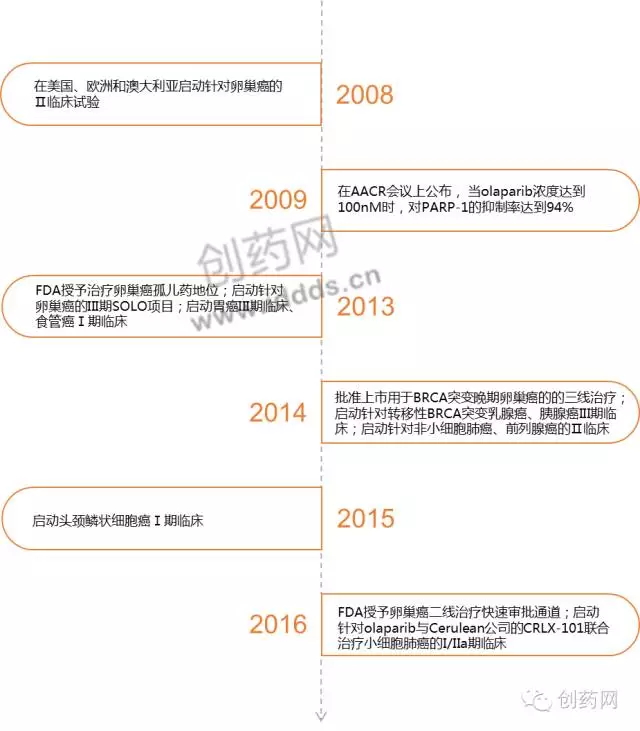
图3:Olaparib的研发历程图
其他在研个性化药物
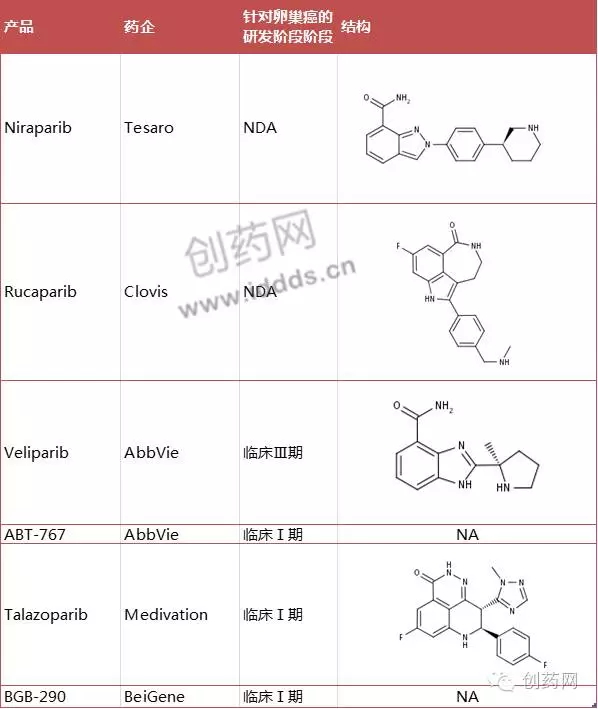
Olaparib作为首个PARP抑制剂上市之后,其他公司也加快了自家PARP抑制剂的研发进程。目前PARP抑制剂研发处于行业领先地位的公司主要有Abbvie、阿斯利康和Tesaro等,分别有14、10和6个在研适应症(图4)。处在临床阶段的PARP抑制剂主要如表1所示,其中包括已经处在预注册阶段的Rucaparib、在卵巢癌Ⅲ期临床试验中大获成功的Niraparib、号称“Best-in-Class”的Talazoparib、以及来自中国创新药物研发公司百济神州的BGB-290等。
图4:PARP抑制剂在研适应症数量排名前10 的公司(来源:Informa) 表1:处在临床阶段的PARP抑制剂
小结 近20年来,卵巢癌的5年生存率得到了明显的提高,这主要得益于更加有效的手术方法和治疗手段,但是卵巢癌的总体治愈率仍然只有大约30%。PARP抑制剂的兴起给BRCA突变卵巢癌患者带来希望,除了已经上市的Olaparib,Clovis公司的Rucaparib以及Tesaro公司的Niraparib等药都已经处在研发后期,相信该类药物相继上市会给卵巢癌治疗带来突破。
参考资料 1. Informa 2016-09-09;2. Banerjee, S. et al. Making the best of PARP inhibitors in ovarian cancer. Nat. Rev. Clin. Oncol .2010, 7, 508-519; 3. Ursula A. Matulonis et al. Ovarian cancer. Nature Reviews Disease Primer, 2016, 2, 1-22
来源:创药网/YQHuang
|  /3
/3 