登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
标识、标记问题是医疗器械企业常犯的错误之一,本文从CE标识的法规要求、整机CE标识要求、自制附件CE标识要求、自制部件CE标识要求、外购件CE标识要求,五个方面阐述CE标识要求。简短精炼,可谓小知识,大学问。欢迎医疗器械从业人员参与互动讨论。 一、法规要求 根据被2007/47/EC修订后的MDD,针对CE标识要求,有下面几处: Article 17对加贴CE标记的要求做了阐述:满足基本要求的设备(除定制器械和临床试验用器械之外),在投放成员国市场时,都必须加CE标记,以标示法规符合性;CE标记应清晰、易读、不易擦除,应同时标示在产品的本体(或无菌包装)和说明书中,如可行,还应标示在包装上;CE标记后应标明执行符合性评估程序的公告机构代码;与CE标记一起标示可能引起混淆的标记不允许加。 Article 18对错误加贴CE标记的3种情形做了说明:不正确地加贴CE标记;漏加CE标记;针对非MDD涵盖的产品按照MDD的程序加CE标记。 二、整机的CE标识要求 现在举例,做CE认证的MD产品I、IIa、IIb三个大类。 I类产品(不带量测功能、不以无菌形式提供),如超声医用影像记录仪MVR-11,应根据MDD的Article 11的规定,并结合附录七中的符合性评估程序,准备CE技术文档,签署符合性声明,自我宣称法规符合性;因为该符合性评估程序不需要公告机构介入审核,所以设备上只需要加CE标记。IIa和IIb类产品,如监护仪、麻醉机、诊断超声、X-ray影像系统,应根据MDD的Article 11的规定,并结合附录二中的全面质量保证体系程序,让公告机构评估符合性,颁发EC证书,并实施持续监督;同时,依据公告机构颁发的EC证书的要求,准备CE技术文档,签署符合性声明。因为公告机构介入产品的符合性评估和上市后监督,所以产品标识和使用说明书、CE标记上应加上公告机构编。0。 三、自制附件的CE标识要求 MD附件的种类很多,范畴很广,如超声产品的探头、穿刺架,监护产品的血氧探头、心电导联等。 针对附件,通常将其和整机一起准备一套CE技术文件,对其单独按照分类原则进行分类,按照安全通标和附件的专标对其专门进行验证。根据MDD附录二的第2节,针对超声产品,我们还在整机的CE符合性声明中列出了整机所配的探头、穿刺架附件的名称和型号。 针对IIa、IIb和I类(带量测功能、以无菌方式提供)附件,需要在附件的标签和使用说明书上加CE0123标记。有些附件,由于尺寸限制,设备标贴的信息并入了包装标贴,因此,CE0123标记就应加在包装标贴上。 针对I类(不带量测功能、不以无菌形式提供)附件,加贴CE的方式同上,只是CE标记上不需要标明公告机构代码。 四、自制部件的CE标识要求 部件,不同于附件,其自身是设备整机的组成部分。如超声设备的CW板、4D探头板、TEE探头板、电源板;DR设备的高压发生器、机电控制箱等。有些部件具备独立的医疗用途(medical purpose),如4D探头板、高压发生器;有些部件,只有在和整机配合使用后,才认为具有医疗用途,如电源板配超声设备后、机电控制箱配DR设备后。有些部件有适用的安全专用标准,如高压发生器(EN 60601-2-7)、球管(EN 60601-2-28);有些部件不具有,如CW板、机电控制箱。有些部件同时也是维修备件,如电源板;有些部件不是维修备件,如高压发生器、机电控制箱。 部件是否需要加CE标记,如何加CE标记,可按照下列的流程图加以判断:
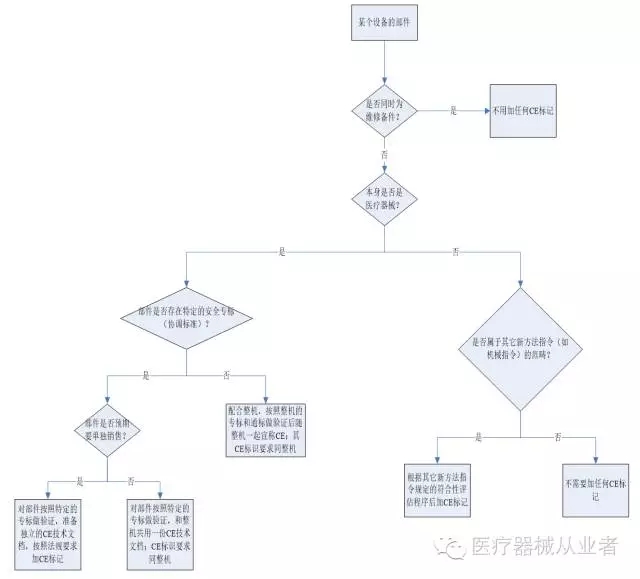
图1:自制部件CE标识流程 五、外购件的CE标识要求 外购件,按照性质,可分为外购附件和外购部件;按照贴牌方式,可分为贴外购厂商的牌子和自主的牌子;按照CE标记,可分为带有CE标记和不带有CE标记。 针对外购附件,根据MDD指令,医疗器械的附件,按照其制造商宣称的预期用途,配特定的医疗设备工作,也可视单独的医疗器械。外购附件的CE标记方法,可按下列流程图加以判断:
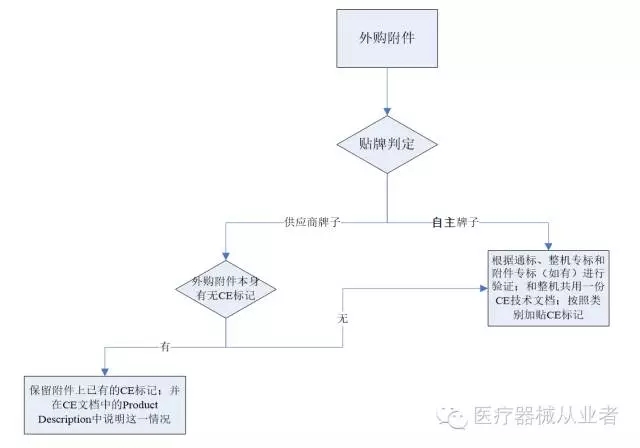 图2:外购附件CE标识流程
图2:外购附件CE标识流程 外购附件本身的安全验证报告,可以在做物料认证时,要求供应商提供;整机的安全验证报告中可以引用供应商提供的外购附件的报告。如果供应商不能提供,则只能由自己做测试并归档验证报告。 针对外购部件,如果贴自主的牌子,则CE标识流程图可参照图1。如果贴供应商的牌子,则要求供应商提供CE符合性声明、EC证书和安全测试报告,并在整机的安全测试报告中引用部件的报告,同时保留部件标贴不变。
来源: 医疗器械从业者
|  /3
/3 