登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×

凭借Rituxan、Avastin、Herceptin这3大王牌,罗氏长期霸占着全球肿瘤药市场40%以上的份额。但在如火如荼的肿瘤免疫治疗领域,罗氏尽管也有atezolizumab(MPDL3280A,anti-PD-L1)压阵,但风头似乎完全被Opdivo(BMS)和Keytruda(MSD)盖过,诸如“BMS和MSD要在anti-PD1市场开展世纪大战”、“Opdivo获批NSCLC创FDA审批记录”等新闻充斥耳端,不知道罗氏能否一直保持内心平静……
如果把目光转向CAR-T领域,主要是诺华、Kite、Juno、Cellectis持续刷屏,特别是刚闭幕不久的ASH2015年会上,CAR-T疗法的数据集中公布吸引了大多数人的眼球。肿瘤领域的王者罗氏哪里去了?
3大CAR-T疗法玩家的数据 
即便在anti-PD-L1领域,似乎也是阿斯利康的MEDI4736更活跃一些。阿斯利康不仅努力开发自身管线的肿瘤免疫治疗药物组合,还不断扩展MEDI4736与各大公司热门药物组合的外部合作,其中也包括Juno的CAR-T细胞疗法。
阿斯利康MEDI4736的主要开发情况 
抱守MPDL3280A的罗氏除了主攻膀胱癌和非小细胞肺癌外(这两个适应症均获得FDA突破性药物资格,进行到III期阶段),还计划利用MPDL3280A继续巩固自身在乳腺癌领域的统治地位。根据AACR2015年会公布的一项结果,MPDL3280A治疗21例PD-L1阳性三阴乳腺癌患者的客观应答率为24%,2例完全缓解,3例部分缓解,6例患者的PFS超过24周(Lancet Oncol)。另外,罗氏还在今年4月启动了MPDL3280A治疗肾癌的III期研究。整体看来,罗氏在anti-PD-L1上的思路是要自己玩耍,希望通过扩展适应症将MPDL3280A打造成另外一个年销售额超过50亿美元的重磅品种。
目前大家普遍认为CAR-T疗法将在2017年率先攻破ALL,因为进度最快的诺华表示2016年就要提交CTL019的上市申请了。在血液肿瘤领域,罗氏除了2013年推出CLL药物Gazyva之外,并没有参与极其火爆的CAR-T疗法。肿瘤药巨头罗氏一直按兵不动,在犹豫什么呢?
我们都知道CAR-T细胞疗法的原理是对T细胞进行嵌合抗原受体(Chimeric Antigen Receptor,CAR)修饰,使T细胞能够特异性识别肿瘤细胞相关抗原,并杀灭肿瘤细胞。治疗方法一般是先提取患者自身的T细胞(Cellectis公司使用的是异体T细胞),在体外进行CAR修饰后大规模扩增CAR-T细胞,之后输送回患者体内。大家对CAR-T疗法的质疑主要是它仅对血液肿瘤更加有效,而且不易进行大规模量产导至治疗成本难以承受。
CAR-T细胞疗法是治疗技术的重大突破,还是一项前景不太确定的技术?观望许久之后,罗氏终于决定进入这一领域了……12月7日,罗氏与总部位于波士顿的SQZ生物技术公司签订了一项合作协议,总额超过5亿美元,预付款并未透露。SQZ生物技术公司拥有一种名为CellSqueeze的技术,其原理是将细胞与嵌合物混悬在一起,细胞受迫单个通过一根极细的管,细胞膜受到挤压而发生破裂变形,嵌合物顺利嵌入细胞膜。细胞通过管道后恢复原形,同时被嵌合物标记成功,而且细胞活力可高达80%。 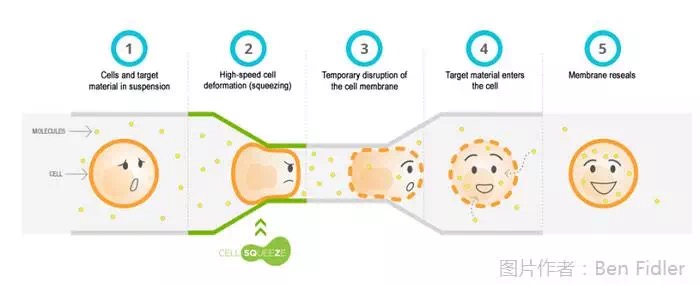
罗氏打算开发的第二代CAR-T疗法与诺华、Juno和Kite不同,因为它并不是以T细胞为武器,而是选择以B细胞为武器。B细胞在免疫系统中的角色更像是T细胞的导盲犬。B细胞擅于识别来自肿瘤细胞分泌的蛋白碎片(抗原),可以通过抗原呈递作用引导T细胞准确杀灭肿瘤细胞。这样以来,通过采集患者肿瘤细胞分泌的抗原,在体外利用CellSqueeze技术将该抗原与B细胞嵌合,然后将改造后的B细胞打回患者体内,训练患者的T细胞杀灭肿瘤细胞……好像很好理解的样子呢。
CAR-T疗法对T细胞进行工程改造一般是利用电穿孔或病毒载体技术在其外表插入一种脂质体包被的蛋白。电穿孔技术的缺陷是修饰后的T细胞回到体内只有40%-70%能够恢复免疫杀伤功能,病毒载体的缺陷是修饰后的T细胞可能会被人体免系统视为有毒性而直接杀灭。
通过CellSqueeze技术改造B细胞的缺点也有一些跟电穿孔或病毒载体嵌合技术相似的地方,比如毒性问题可能会影响患者的耐受性和临床疗效,难以大规模开展临床试验等。最大的疑问在于:改造后的B细胞对T细胞的训练效果如何?接受训练的T细胞能像接受遗传改造的T细胞一样有效吗?这些问题尚未在人体中得到验证,也没有比较研究能够证明B细胞疗法能比CAR-T细胞疗法更有效。
但是相比以上疑虑,基于CellSqueeze技术的B细胞疗法可以想象的空间更大。首先CAR-T疗法的1个治疗周期通常要数周以上,诺华CTL019一个治疗周期的费用可能要45万美元,B细胞疗法则能够在一天甚至几个小时内完成,治疗成本也会便宜很多。其次,CAR-T细胞疗法仅对血液肿瘤更有效,改造后的B细胞则可以对乳腺癌、卵巢癌、肺癌等多种实体瘤有效。
理论上罗氏可以将CellSqueeze技术用于多种肿瘤免疫疗法的开发,但推测罗氏还是会优先开发免疫应答受到抑制的一些实体肿瘤,比如黑色素瘤和NSCLC。当然,罗氏的选项远不止于此。大象跺跺脚,地面震一震,罗氏引领之下,B细胞疗法会成为下一波开发热潮吗? 来源:医药魔方数据 作者:禾木
|  /3
/3 