登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
本文主要针对国家局最新发布的《医疗器械软件注册技术指导原则》并结合软件相关的国家及行业标准,介绍医疗器械软件的定义及分类、设计开发过程验证及确认、风险管理的要求。
[backcolor=rgba(103, 68, 59, 0.941176)]一医疗器械软件术语定义及分类
1、独立软件:预期本身用作医疗器械而开发的软件,即:作为医疗器械或其附件的软件;
2、软件组件:在被开发医疗器械内的已开发的软件,即:作为医疗器械或其部件、附件组成的软件

3、独立软件应同时具备以下三个特征:具有一个或多个医疗用途,无需医疗器械硬件即可完成预期用途,运行于通用计算平台,包括如下:
1)独立软件包括通用型软件和专用型软件,其中通用型软件基于通用数据接口与多个医疗器械产品联合使用,如:PACS、中央监护软件等;
2)专用型软件基于通用、专用的数据接口与特定医疗器械产品联合使用,如Holter数据分析软件、眼科显微镜图像处理软件等。
4、软件组件应同时具备以下两个特征:具有一个或多个医疗用途,控制(驱动)医疗器械硬件或运行于专用(医用)计算平台。软件组件包括嵌入式软件和控制型软件,
5、软件组件也可兼具处理功能。专用型独立软件可单独注册(作为 6870 软件),也可随医疗器械产品注册,此时视为软件组件,软件组件注册一般会作为其它器械分类,如:6821 医用电子仪器设备。
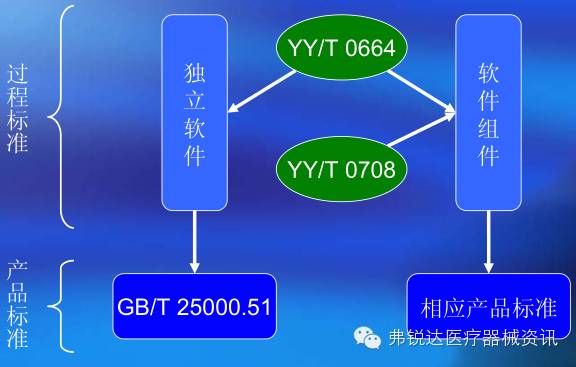
图1 软件对应的标准关系 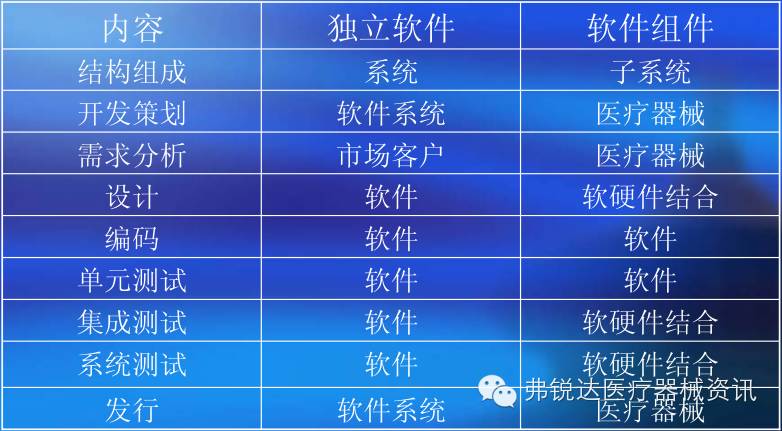
图2 独立软件与软件组件的区别
[backcolor=rgba(103, 68, 59, 0.941176)]二软件类型及架构
1、软件的类型判定 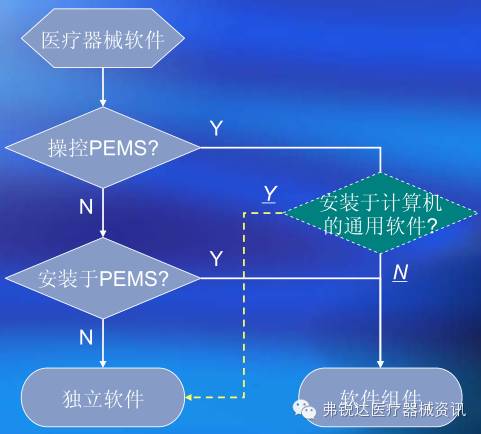
图3 软件的类型判定 2、软件的体系结构 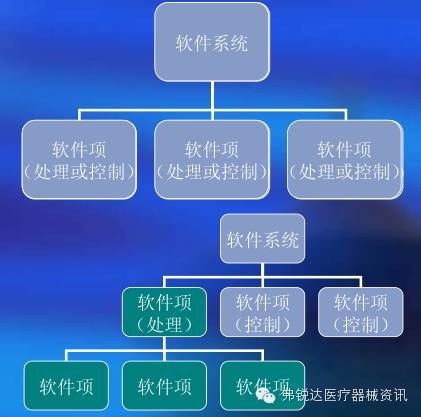
图4 软件的体系结构 3、软件硬件关系 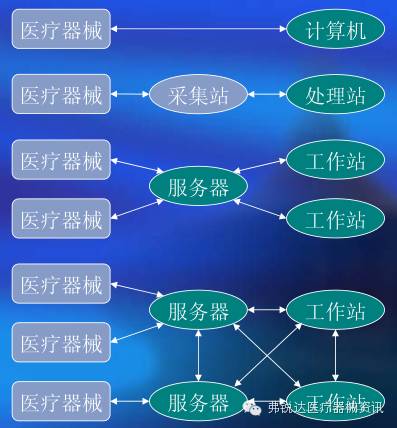
[backcolor=rgba(103, 68, 59, 0.941176)]三软件设计开发
1、软件开发过程包括需求分析、设计 、编码 、集成 、测试(临床验证) 等活动,YY/T 0664 给出了软件开发过程和活动的示意图 ,这些过程与 Y Y/ T 0287 标准“ 7.3 设计和开发 ” 的对应关系 来源:弗锐达医疗器械资讯微信
|  /3
/3 