登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
7月3日,CFDA发布《国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告》(2015年第87号),这是自其在4月28日发布征求意见稿之后的快速跟进。值得注意的是,对于多中心临床试验的申办者,如果多家临床机构签署伦理协议的时间跨度较大,而报备要求各中心进度统一,那么,这种针对医疗器械的捆绑报备将带来时间上的延迟。
下附公告原文及解读
根据《医疗器械监督管理条例》的规定,开展医疗器械临床试验应当备案。现将备案有关事宜公告如下:
Sandalman: 药品的监督管理有法可依,《药品管理法》,其下有国务院颁布的《药品管理法实施条例》;CFDA再根据上述法令发布《药品注册管理办法》,或发布公告,对药物临床试验的备案或登记实施管理。医疗器械的特殊性在于目前并没有上位法,国务院颁布的《医疗器械监督管理条例》已是最高规格的法令,其第18条规定“开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在有资质的临床试验机构进行,并向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。接受临床试验备案的食品药品监督管理部门应当将备案情况通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。”本次关于临床试验备案的公告,其实只是明确了《医疗器械管理条例》第18条的实施细则。
一、开展医疗器械临床试验,申办者应当在试验项目经伦理审查通过并与临床试验机构签订协议或合同后,填写《医疗器械临床试验备案表》(附件1),提交备案表中列出的相关材料,其中境内医疗器械向申办者所在地省级食品药品监督管理部门备案,进口医疗器械向代理人所在地省级食品药品监督管理部门备案。
Sandalman: 看点——备案时间:(1)获得伦理批件;(2)与临床试验机构签订协议。
争议点——根据附件1,要求提供所有的临床试验机构信息,自然牵头单位伦理批件是要提供的,对于多中心试验参加中心的伦理批件是否可以省略呢?貌似可以,但实际上行不通,因为要求提供与临床试验机构签订的协议。一般来讲,如果没有本中心伦理委员会批准,临床试验机构是不可能与申办者签协议的。
挑战——医疗器械多中心临床试验的申办者当心,整个试验周期可能被延长。按附件要求,备案表复印件(受理后有省局盖章的)应交临床试验机构留存。如果临床试验机构出于谨慎考虑,要求申办者提交复印件后,再开始正式入组病例,则多中心临床试验由于中心数多、伦理审查和协议签署的时间跨度长,就可能出现最早过伦理签协议的机构迟迟等待最晚一家机构过伦理的情况。而按照现行管理体制,各中心试验进度是相对独立的,带给申办者在项目管理上一定的灵活性。现在的捆绑报备,自在不再。
对策——还是附件1,存在一个BUG,要求多中心临床试验必须大于等于3个中心以上。对于申办者,可能有一个曲线救国的方式,可以先选择2家中心完成报备程序,再根据实际需要增加中心。按照公告,增加中心不属于必须报备的情况,当然这需要申办者选择的临床试验机构对公告也持相同理解。详见第五条评论。
二、接受备案的省级食品药品监督管理部门,对《医疗器械临床试验备案表》填写完整且提交材料齐全的,应当当场备案。备案号编排方式为:X1械临备XXXX2XXXX3,其中X1为备案部门所在地简称,XXXX2为年份,XXXX3为流水号。
Sandalman: 当场备案,令人欣慰的一幕。想象一下申办者的极速备案场景——获得最后一家临床试验机构的伦理批件和协议(边过伦理,边谈协议,获伦批当天,签协议),当天申办者向临床试验机构打款,完成启动培训;注册部的同事,当天去省局备案,将备案表复印件交给临床试验机构;当天开始筛选入组受试者。够快,把前面等待捆绑备案的时间夺回来。
三、接受备案的省级食品药品监督管理部门,应当在10个工作日内将备案信息(格式见附件2)通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。
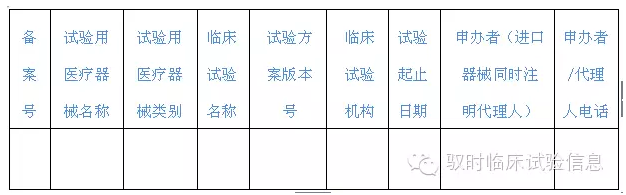
Sandalman: 备案信息表要求填报的信息很简单,见下表,概括一句话:“我局某申办者的某个医疗器械临床试验项目正在某临床试验机构进行,预计从何时起何时止。”
根据《医疗器械监督管理条例》第18条,“医疗器械临床试验机构资质认定条件和临床试验质量管理规范,由国务院食品药品监督管理部门会同国务院卫生计生主管部门制定并公布;医疗器械临床试验机构由国务院食品药品监督管理部门会同国务院卫生计生主管部门认定并公布。”截止今日,由于去除药味的“医疗器械临床试验机构资质认定条件和临床试验质量管理规范”均暂未发布,各省局在审核备案资料时,对于申办者关心的临床试验机构资质问题,牵头单位应仍需参照CFDA的《国家药物临床试验机构资格认定公告》,为认定机构的认定专业,参加单位从认定机构中选取,对专业无认定要求。
相比医疗器械临床试验备案要求的火速出台,关键性的机构资质认定条件和GCP迟迟不出台,步子迈得比脑袋快,成熟一个公告一个?
四、自公告发布之日起,开展医疗器械临床试验应当按照本公告备案后实施。
五、申办者完成临床试验备案后,对试验项目起止日期有变化的,应当于变化后10个工作日内告知原备案管理部门并留有信息变更的记录。
Sandalman: 对比《征求意见稿》,正式公告的表述显然对申办者应该告知原备案部门的信息变更内容大大缩减了,仅限于试验项目起止日期变化需要报备!!??
只报备试验项目起止日期变化,不报备引起变化的原因。如果是临床试验方案的改变尤其是适应症的改变不需要报备?增减临床试验机构不需要报备?(这为前述曲线救国打下良好的基础)试验起止日期如何定义?项目开始前预测的临床试验结束日期与实际结束日期之间相差多少,就视作有变化?……问题较多,需要明确。
六、食品药品监督管理部门应当加强对医疗器械临床试验备案工作的监督检查,对违反规定的依法查处。
接受备案的省级食品药品监督管理部门应当每月10日前将备案信息以电子邮件方式报送国家食品药品监督管理总局医疗器械注册管理司(电子信箱:mdct@cfda.gov.cn)。
Sandalman: 再次学习《医疗器械监督管理条例》,看看违反规定怎么查处,第六十五条“未依照本条例规定备案的,由县级以上人民政府食品药品监督管理部门责令限期改正;逾期不改正的,向社会公告未备案单位和产品名称,可以处1万元以下罚款。备案时提供虚假资料的,由县级以上人民政府食品药品监督管理部门向社会公告备案单位和产品名称;情节严重的,直接责任人员5年内不得从事医疗器械生产经营活动。”这一条更多是针对实施备案管理的一类医疗器械申办者的,临床试验备案是否按此条管理,待明确。
实施医疗器械临床试验备案的压力可能更多来自于临床试验机构,《医疗器械监督管理条例》第六十九条规定“违反本条例规定开展医疗器械临床试验的,由县级以上人民政府食品药品监督管理部门责令改正或者立即停止临床试验,可以处5万元以下罚款;造成严重后果的,依法对直接负责的主管人员和其他直接责任人员给予降级、撤职或者开除的处分;有医疗器械临床试验机构资质的,由授予其资质的主管部门撤销医疗器械临床试验机构资质,5年内不受理其资质认定申请。”如果CFDA把开展未实施临床备案的医疗器械临床试验视作“违反本条例”的情况,那么临床试验机构会有充足的动力要求申办提供省局临床备案表,才会动工。
来源:驭时临床试验信息
|  /3
/3 