登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
文/杨爱荣 本文为蒲公英原创文章,转载请注明来源和作者。
最近就在整清洁验证,正逢欧盟 GMP Annex15Qualification and Validation正式版发布及中国CFDA发布正式的《确认与验证》,也仔细的阅读了两份文件,从文字的理解上看,其中的清洁验证章节两份文件基本一致,均强调风险和科学评估,只是在某些细节上略有不同,现将其总结如下:
最近就在整清洁验证,正逢欧盟GMPAnnex15Qualification and Validation正式版发布及中国CFDA发布正式的《确认与验证》,也仔细的阅读了两份文件,从文字的理解上看,其中的清洁验证章节两份文件基本一致,均强调风险和科学评估,只是在某些细节上略有不同,现将其总结如下:

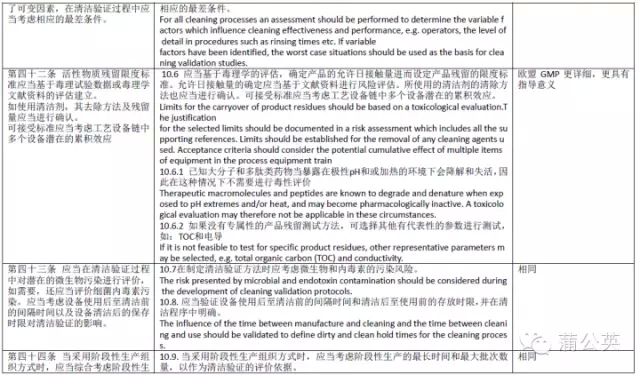
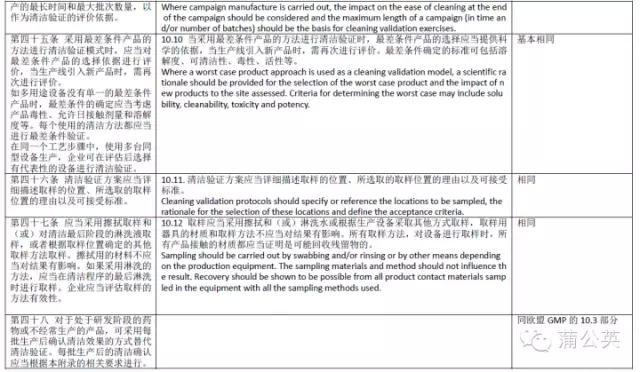

从以上对比可以看出,中国GMP《确认与验证》附录与欧盟GMPAnnex15基本一致,相比欧盟GMP更详细一点,但基本原理是一样的。但是不管GMP讲的详细与否,在实际清洁验证中,风险分析,科学设计是非常重要的,只有真正的理解了清洁验证的目的,对自己的产品相当的熟悉,了解每一个步骤可以存在的问题及风险是决定清洁验证是否成功,是否能被“可持续的重复”的关键,也是保证产品质量的关键。本人在进行供应商审计,迎接客户及官方的各种审计也有一定的频次,见过、审核批准了不少的清洁验证,每一次都感觉对清洁验证有了一点点多的理解,现将体会与各位普友交流如下,也欢迎大家拍砖。
一、首先应理解清洁验证和清洁确认的区别:
欧盟GMP Annex15对清洁验证和清洁确认定义如下: Cleaning Validation:cleaning validation is documented evidence that an approved cleaning procedure will reproducibly remove the previous product or cleaning agents used in the equipment below the scientifically set maximum allowable carryover level.翻译成中文:清洁验证是用书面证据证明一个已批准的清洁规程能在所使用设备上重复清除前次生产产品或所使用的清洁剂低于经科学评估设定的可接受标准。 Cleaning verification:The gathering of evidence through chemical analysis after each batch to show that the residues of the previous product or cleaning agents have been reduced below the scientifically set maximum allowable carryover level. 翻译成中文:清洁确认在每批生产后通过化学分析收集证据证明前次生产的产品和所使用的清洁剂残留低于经科学评估设定的可接受标准
简单的说:清洁验证验证的是一种方法,以后可重复性的得到相同的清洁效果。而清洁确认是是一次性的行为,仅是收集证据证明所做的清洁是达到了目标要求。
在实际工作中,遇到过新设备的清洁也有编写清洁验证方案的,其实严格意义上讲新设备的清洁是一种清洁确认,因为是一次性的行为,不存在可重复性。另外一点是对于新设备的清洁,本人认为可以起草一个统一的新设备清洁的SOP,也就是新设备清洁的原则,能拆的拆,能卸的卸,用抹布擦、用碱洗等等一个流程,记录所有清洁过程,最后检测合格即可。
中国及欧盟新的GMP附录中对临床样品的制备很明确的指出直接做清洁确认即可,这是因为临床样品一般情况下批量较小,而且是一次性的行为。但是在产品正式商业化之前,建议重新做一个评估,因为选择最差产品时,除了考虑溶解度,毒性外,还应考虑批量,如果综合评估下来,仍然先前的产品是最差产品,可以不重新进行清洁验证,但是建议进行一次清洁确认,证明用此种方法,以商业化批量的条件生产,按既定的清洁SOP能够将该产品清洁至可接受水平。
温馨提示:所谓所选择最差产品,一定是在使用同一清洁程序的情况下,如果清洁程序不同,要分别进行清洁验证啊。
二、清洁SOP的制定:
清洁SOP应足够详细,应包括设备的拆卸要求,详细的清洗步骤,所用的清洗溶剂,清洗的压力、流量、温度要求,清洗的次数,清洗剂的排放要求,设备及部件的存放条件,经验证过的清洁及脏设备的存放条件(干燥存放,密闭存放),存放时间(当然经过验证后才能有此数据),设备长期贮存再投入到生产中去需要做的额外工作等。如果可能,在SOP中描述设备的形状,表面积的计算等都可以包括进去。
三、正常的清洁验证程序相信大家都很熟悉,但中国及欧盟GMP附录中都有一句话叫:明确清洁验证中的可变因素,当可变因素发生变化时,应进行评估,因此在清洁验证时应特别小心的设计,才能使得清洁验证处于一种有效的可重复的状态:
1、擦试用棉签一定用同一品牌的专用棉签:以前发现过不少人在做清洁验证时选用的医用棉签,而且品牌不一,质量不一,使得在清洁验证中出现了不少难以解释的“峰”,反而污染设备,导至清洁验证失败,查不到原因。另外一种情况,非专用的棉签,棉签的大小、长短不一,那么回收率也没有任何借鉴意义。
2、在做回收率试验时,要注意产品接触的所有材质均要做回收率试验,因为不同材质回收率会有所不同。比如304不锈钢与316L不锈钢由于表面粗糙度不同,回收率也会不一致。
3、做回收率试验时,擦试设备的人员一定要与试验室做回收率擦试的人员一致,并且最好有二至三名人员同时进行擦试试验,擦试时用力强度,棉签的方向,擦试的轨迹都要做好设计,避免在实际擦试中与回收率擦试时的不一致而导至的回收率无参考意义。
4、擦试设备时应使用可溶解产品的溶剂润湿棉签,同样在试验室回收率及含量分析时也应使用此类溶剂,千万不要试验室与生产各做一套,出现不一的现象。
5、擦试后再溶液要记得做稳定性试验,因为很多时候,擦试后不能及时做检测,需要放置一段时间,在放置的这一段时间内要确保无降解,否则,检测结果可能会欺骗你哦。
6、要掌握淋洗取样的时机:有两种取样方式,一是最后一遍淋洗水,但要在最后淋洗液快排放结束时取样,因为这时候浓度应该是最高,因为浸泡时间最长,当然这样的取样也比较困难;二是最后一遍淋洗水后,再加入可溶解该产品的溶剂,要记得最好能润湿到设备的所有表面,加温或搅拌一段时间后再取淋洗样品。
总之,做清洁验证是这样,做工艺验证及设备确认也是样,要能科学的观察到其中的可变因素,才有可能可重复性能到一种结果。
从以上对比可以看出,中国GMP《确认与验证》附录与欧盟GMPAnnex15基本一致,相比欧盟GMP更详细一点,但基本原理是一样的。但是不管GMP讲的详细与否,在实际清洁验证中,风险分析,科学设计是非常重要的,只有真正的理解了清洁验证的目的,对自己的产品相当的熟悉,了解每一个步骤可以存在的问题及风险是决定清洁验证是否成功,是否能被“可持续的重复”的关键,也是保证产品质量的关键。本人在进行供应商审计,迎接客户及官方的各种审计也有一定的频次,见过、审核批准了不少的清洁验证,每一次都感觉对清洁验证有了一点点多的理解,现将体会与各位普友交流如下,也欢迎大家拍砖。
|  /3
/3 