登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
定义及范围 “延续注册”适用于第II、III类医疗器械产品注册证有效期届满需要延续注册,且产品与获证时相比无任何变化的情形。相关的法规依据请参见下图: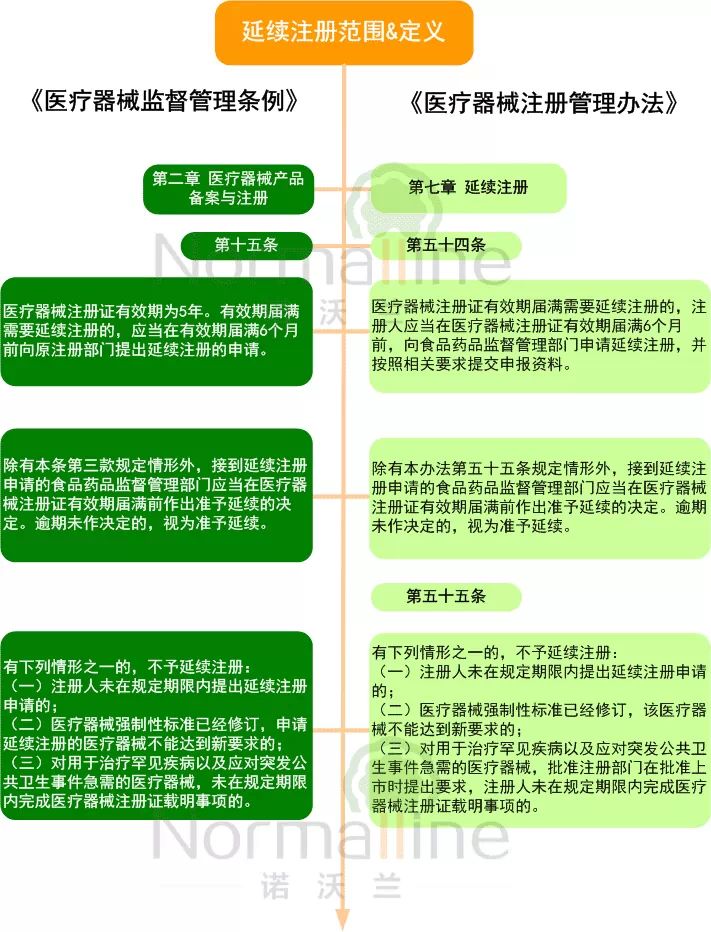
注:《体外诊断试剂注册管理办法》中关于“延续注册”的规定与上述内容基本一致,区别在于不予延续的情形第2条为“体外诊断试剂强制性标准已经修订或者有新的国家标准品、参考品,该体外诊断试剂不能达到新要求的。”
风险分析 第II、III类医疗器械的注册包括四个许可事项:注册申请,许可事项变更、登记事项变更及延续注册。“延续注册”是其中风险较低的。 延续注册风险较低的原因为: 1)产品通过了食品药品监督管理部门的“首次注册”或“注册变更”的审评审批; 2)产品与之前审评审批时相比无任何变化; 3)作为上市产品,在注册证有效期(原4年,现5年)内,接受了更大范围样本(相比与上市前临床试验样本量)的检验,获得了更多关于产品安全性及有效性的检验数据。 延续注册项目管理工具 资料管理工具 基于上述风险分析,国家食品药品监督管理总局对“延续注册”的递交资料要求进行了简化。反映到《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》附件5《医疗器械延续注册申报资料要求及说明》中:
注:体外诊断试剂注册申报资料要求与上述内容基本一致,区别在于产品检验报告部分增加了“如有国家标准品、参考品发布或者更新的,应提供产品能够符合国家标准品、参考品要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合相应通知规定的检验报告。”
时间管理工具 《境内第三类和进口医疗器械注册审批操作规范》规定了第II、III类医疗器械的延续注册的审评审批时限,分别为88和118个工作日。由此,制作的延续注册工作时间管理图供参考: 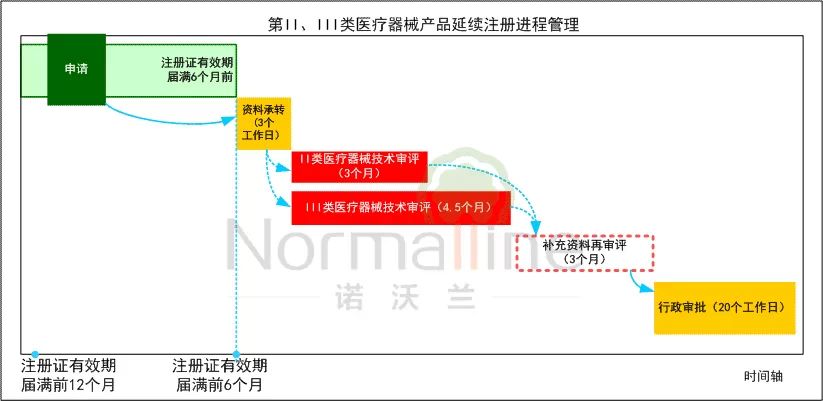
当然,我们之前的微文中分析过,最靠谱儿的法规人员通常会将延续注册申请的时间控制在注册证前的12个月左右。

本文索引法规目录: 《医疗器械监督管理条例》2014年国务院令第650号 《医疗器械监督管理办法》2014年国家食品药品监督管理总局令第4号 《体外诊断试剂注册管理办法》2014年国家食品药品监督管理总局令第5号 《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》2014年国家食品药品监督管理总局第43号公告 《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》2014年国家食品药品监督管理总局第44号公告 《境内第三类和进口医疗器械注册审批操作规范》食药监械管〔2014〕208号
来源:CMDRA
|  /3
/3 