登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
2014年12月19日,医疗器械技术审评中心发布了《大动脉覆膜支架系统的临床试验指导原则(征求意见稿)》,意见征集截止日期为2015年1月15日。 至此,本年度的技术指导原则制定及发布工作已尘埃落定。今天,小编调取了现行法规库中的技术指导原则,并为大家整理了2014年CFDA发布的28项技术指导原则,及CMDE正在制定的14项技术指导原则。
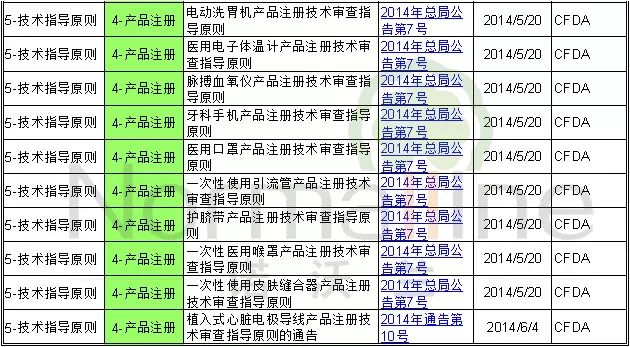
2014年公布的医疗器械技术指导原则共18条,其中通用技术指导原则1条,说明书、标签和标识指导原则2条,产品技术审查指导原则15条。 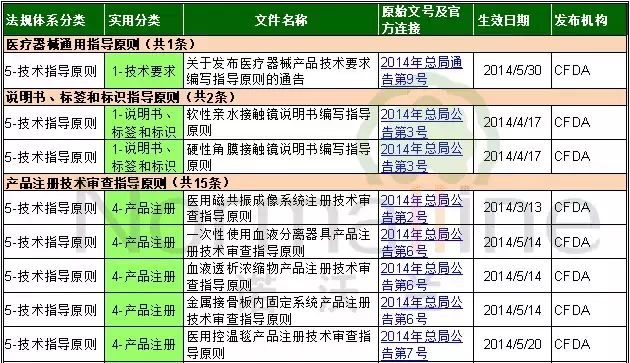
2014年公布的体外诊断试剂技术指导原则共9条,其中通用技术指导原则2条,产品技术审查指导原则7条。产品技术审评要点1条。 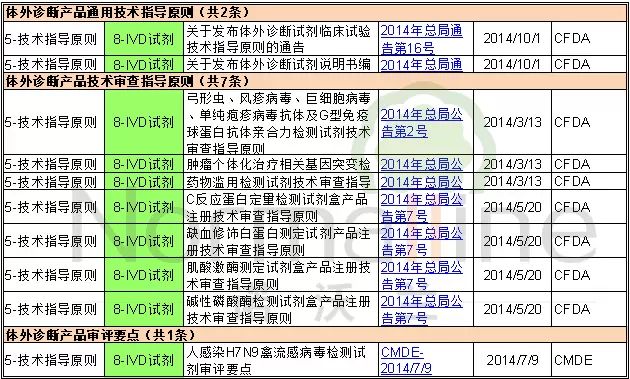
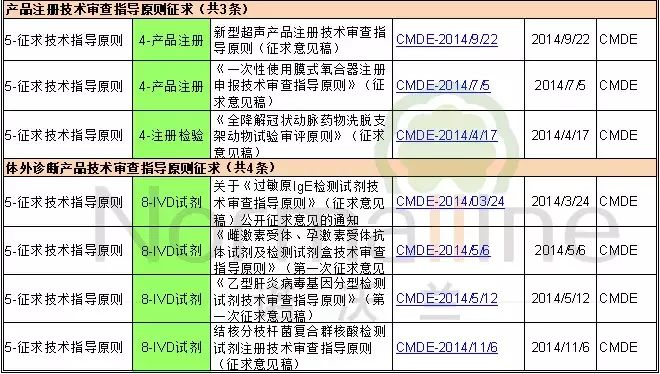
2014年已发布的征求意见稿且未发布最终版的技术指导原则共14条,其中医疗器械10条,体外诊断试剂4条。值得注意的是征求意见稿中包含多项临床试验技术指导原则。 
来源:CMDRA
|  /3
/3 