登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
点击图片上面的蓝色小字体(依科赛生物)快速关注!! 第一次作ELISA,真简单,偶暗想。
第二次做,咿,结果差别这么大(同一份标本)怎么还有跳孔。
第三次,决定做的认真一些,争取作到同一份标本,做两到三次,板间无差异,发觉很难。
原来ELISA 也这么讲究。看看ELISA的注意事项吧:
(一)加样
在ELISA中除了包被外,一般需进行4~5次加样。在定性测定中有时不强调加样量的准确性,例如规定为加样一滴。此时应该使用相同口径的滴管,保持准确的加样姿势,使每滴液体的体积基本相同。在定量测定中则加样量应力求准确。 标本和结合物的稀释液应按规定配制。加样时应将液体加在孔底,避免加在孔壁上部,并注意不可出现气泡。
正确的加样方法应为45度,吸头贴着孔壁加入,应注意:
(1)角度太小,会使液体残留在孔壁上,导至加样不准确!
(2)吸头应当贴着管壁和液面的交界处! 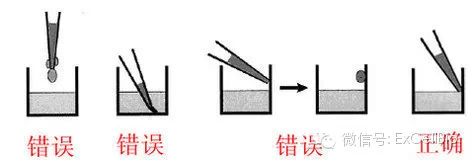
ELISA中加样还须注意如下问题:
1. 吸取样品时,加样枪吸头不应黏附多余的液体;加样时不可90度向孔中滴加液体,这样会导至液体残留在吸头上,加样不准确!
2. 不要将吸头伸入孔中,一方面若接触孔底可能压弯吸头,另一方面可能会将孔中的液体吹起来,加样不准确!
(二)保温
在ELISA中一般有二次抗原抗体反应,即加标本后和加结合物后,此时反应的温度和时间应按规定的要求,保温容器最好是水浴箱,可使温度迅速平衡。各ELISA板不应叠在一起。为避免蒸发,板上应加盖,或将板平放在底部垫有湿纱布的湿盒中。湿盒应该是金属的,传热容易。如用保温箱,空湿盒应预先放在其中,以平衡温度,这在室温较低时更为重要。 加入底物后,反应的时间和温度通常不做严格要求。如室温高于20℃,ELISA板可避光放在实验台上,以便不时观察,待对照管显色适当时,即可终止酶反应。
(三)洗涤
洗涤在ELISA过程中是决定实验成败的关键。 洗涤的目的是洗去反应液中没有与固相抗原或抗体结合的物质以及在反应过程中非特异性吸附于固相载体的干扰物质。 聚苯乙烯待塑料对蛋白质的吸附作用是普遍性的。因此在ELISA测定的反应过程中应尽量避免非特异性吸附,而在洗涤时又应把这种非特异性吸附的干扰物质洗涤下来。在标本和结合物的稀释液和洗涤液中加入聚山梨酯(吐温,Tween)一类物质即右达到此目的。 聚山梨酯是聚氧乙烯去水山梨醇脂肪酸酯,为非离子型的表面张力物质,常作为助溶剂。根据脂肪酸的种类而对聚山梨酯编号,结合月桂酸的为聚山梨酯20,在ELISA中最为常用。它的洗涤效果好,并具有减少非特异性吸附和增强抗原抗体结合的作用。
洗涤如不彻底,特别在最后一次,如有酶结合物的非特异性吸附,将使空白值升高。另外,在间接法中如血清标本内的非特异性IgG吸附在固相上而未被洗净,也将与酶标抗体作用而产生干扰。
ELISA板的洗涤一般可采用以下方法:
①吸干孔内反应液;
②将洗涤液注满板孔;
③放置2min,略作摇动;
④吸干孔内液,也可倾去液体后在吸水纸上拍干。洗涤的次数一般为3~4次,有时甚至需洗5~6次。
|  /3
/3 