登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
今天为大家分享一篇2024年发表在Nature Biomedical Engineering的文章,题目为“Antibody-displaying extracellular vesicles for targeted cancer therapy”。本文中,作者开发了一种模块化的细胞外囊泡(EVs)系统(Fc-EVs),能够通过特定的Fc结合域与不同类型的IgG抗体结合,从而实现对几乎任何组织的靶向,并在构建药物递送系统用于肿瘤的精准治疗中具有巨大潜力。
01背景介绍程序性细胞死亡蛋白1(PD-1)及其配体PD-L1是免疫疗法中的主要靶点之一,尽管PD-L1在多种恶性肿瘤中高度表达,但只有部分患者对治疗有持久反应。为了提高反应率,治疗策略包括联合化疗、多重检查点抑制和其他免疫刺激方法。然而,这些策略在将不同治疗方法协调递送到目标部位时存在局限性。EVs是一种直径范围从30 nm到2000 nm且具有异质性的天然纳米囊泡。EVs含有来自亲本细胞的脂质、蛋白质和核酸,并且具有通过细胞间通信系统传递这些大分子的独特能力,可以影响邻近细胞或远处细胞。因此,利用EVs构建靶向癌症治疗的模块化递送系统具有广阔前景。
02设计思路该研究利用分子工程工具,开发了能够结合抗体片段可结晶区(Fc)的EVs,使得可变区能够展示以识别抗原。这种Fc结合的EVs(Fc-EVs)可以修饰不同类型的抗体,从而靶向几乎任何感兴趣的组织。
图1 原理图
03数据介绍(1)Fc-EVs的优化
为了优化Fc-EVs的展示效率和靶向能力,作者筛选了不同的Fc结合域和EVs分选域。作者首先对9个在C端或N端与报告蛋白mNG融合的EV分选结构域进行评估(图2a),通过成像流式细胞术(IFC)结果可以发现当mNG与四次跨膜蛋白(CD9、CD63、CD81)、膜联蛋白V或肿瘤坏死因子受体(TNFR)融合时,细胞表现出最高的表达水平(图2b),而其他EVs分选域的mNG水平较低。接着,通过比较表达9种不同EV分选结构域的不同EV生成细胞的条件培养基,TNFR和四跨蛋白,特别是C端融合的CD63,每毫升mNG阳性(mNG+)数胜过其他EVs分选结构域 (图2c) 。通过与四次跨膜蛋白或TNFR融合,EVs被设计成显示蛋白A、z或4z结构域。所有构建体都产生了带有Fc结合物的工程化EVs,CD63-z的结合产生了最高水平的表达(图2d)。所有EV都显示出抗体结合能力,当使用z结构域时,四次跨膜蛋白构建体之间的结合效率相似,但使用TNFR作为表达支架时,其结合效率明显较低(图2d)。当使用4z或蛋白A作为Fc结合剂时,也观察到类似的趋势。此外,CD63-z融合也产生了最高表达水平的工程化EVs(图2e),因此,作者最终确定了CD63与z域融合产生的EVs作为最佳的Fc-EVs候选者,展现出最高的表达水平和Fc结合能力。图2 EV分选蛋白和Fc结合域的筛选 (2)Fc-EV的表征
作者使用多种方法详细表征了Fc-EVs的物理特性和功能性。首先,作者采用纳米颗粒跟踪分析(NTA)技术进行分析,结果表明Fc-EVs具有大约100 nm的峰径(图3a)。为了进一步确认抗体与Fc-EVs的结合,作者用尺寸排阻色谱(SEC)(图3b,e)、IFC(图3c)、纳米成像(图3f)证明了Fc-EVs与抗体的有效结合。接着,作者同时评估了不同IgG亚型对Fc-EVs的亲和力(图3d),其中人IgG1(hIgG1)对 Fc-EVs的亲和力最大,这与之前关于蛋白质 A 和 z 结构域的报道结果一致。最后,作者使用单颗粒分析仪(SPP)对单个EV上抗体的定量分析(图3g、h、i)。综上,证实了抗体能够高效且稳定地结合在Fc-EVs上。 图3 Fc-EVs的表征 (3)抗体修饰的Fc-EVs的多功能靶向性为了证明所开发的Fc-EVs技术能够实现对肿瘤细胞的高效靶向,作者使用特定的肿瘤细胞系:HER2阳性的乳腺癌细胞和PD-L1阳性的黑色素瘤细胞,在体外验证修饰相应抗体后Fc-EVs的靶向能力。与未修饰的EV相比,在临床使用的 HER2 抗体曲妥珠单抗的引导下Fc-EVs能被HER2 阳性乳腺癌细胞(SKBR-3 细胞)显著摄取(图4a)。在PD-L1表达的恶性黑色素瘤细胞(B16F10)系中也得到了相似的结论,在阿替利珠单抗的引导下,Fc-EVs 能被B16F10细胞显著摄取(图4b)。荧光显微镜成像结果(图4c)进一步证实了抗体修饰后能够显著提高肿瘤细胞对EVs的摄取。
图4 使用抗体进行Fc-EV靶向 (4)抗体修饰的Fc-EVs靶向肿瘤 作者通过PD-L1抗体修饰的Fc-EVs在恶性黑色素瘤(B16F10)荷瘤小鼠模型中的表现反映抗体修饰后Fc-EVs的肿瘤靶向能力(图5a)。与单独使用 Fc-EVs相比,PD-L1-Ab的修饰显著增加了 Fc-EVs 在肿瘤组织中的积累,而同种对照不影响Fc-EVs在肿瘤中的积累(图5b),用Fc-EVs+ PD-L1-Ab处理的小鼠,在注射后30分钟肿瘤积累达到最高水平(图5c)。作者也评估了Fc-EVs在血浆中的半衰期,与先前的调查结果一致,Fc-EVs在血浆中的半衰期为3-4分钟,与单独使用Fc-EVs或显示PD-L1-Ab或IgG-ctrl时没有显著差异(图5d),与Fc-EVs+ IgG-ctrl 相比,Fc-EVs+ PD-L1-Ab 在脾脏和肝脏中检测到的 EV 水平略低(图5e,f),组织分布的差异进一步强调了该方法的靶向效率。接着,作者在对小鼠注射mNG Fc-EVs后使用流式细胞术对来自分离组织中的单细胞悬液进行荧光检测。与对照抗体相比,当显示PD-L1-Ab时,Fc-EVs在肿瘤细胞中富集,特别是在PD-L1肿瘤细胞中(图5g,h),同时,Fc-EVs同样能在肿瘤组织的T细胞中积累(图5i)。 图5 使用PD-L1抗体修饰Fc-EV靶向肿瘤 接下来,为了评估Fc-EVs在肿瘤靶向中的通用性,作者将其应用于HER2阳性乳腺癌模型(图6a)。与前述PD-L1阳性恶性黑色素瘤模型类似,展示HER2抗体的Fc-EVs能够特异性地积累在HER2阳性的乳腺癌肿瘤组织中(图6b-d)。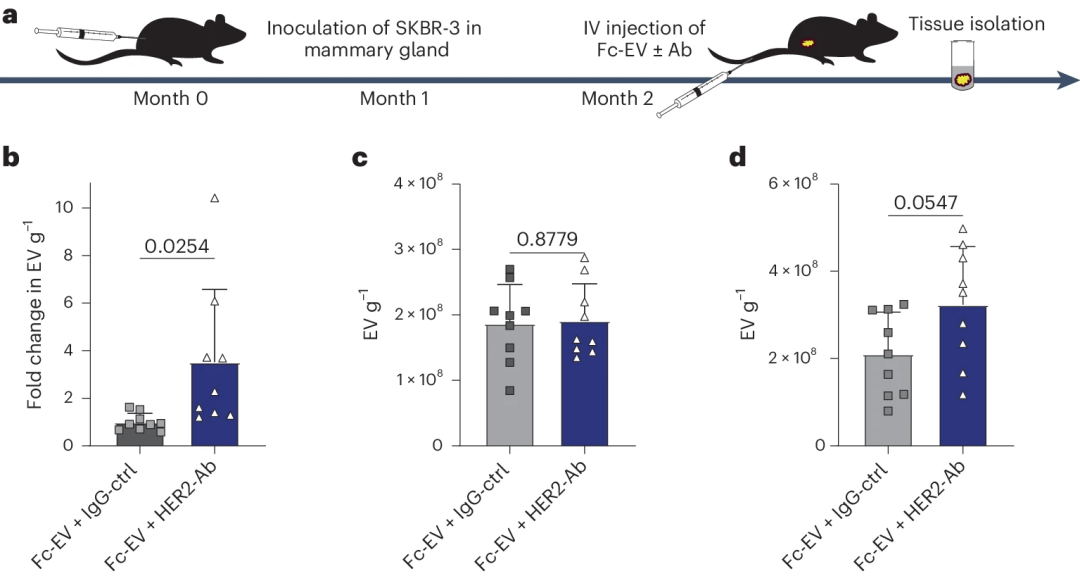 图6 使用HER2抗体修饰Fc-EV靶向肿瘤 (5)PD-L1抗体修饰的Fc-EVs用于恶性黑色素瘤的治疗
基于前述抗体修饰的Fc-EVs对肿瘤的靶向性,作者进一步探究了Fc-EVs是否可以用作靶向递送化疗药物的递送载体。作者每三天用负载Dox并用PD-L1-Ab修饰的Fc-EVs对携带B16F10的黑色素瘤小鼠进行全身治疗(图7a)。与对照组相比,Fc-EVs + Dox + PD-L1-Ab显著抑制了肿瘤进展,肿瘤生长尺寸减小并显著提高生存率(图7b-d)。为了评估该方法在长时间治疗中的有效性,作者将终点设置为35天,进行了第二次实验(图7e),如预期的那样,Fc-EVs+ Dox + PD-L1-Ab治疗再次显示出随着时间的推移肿瘤大小发展减少(图7f,g)和显著提高的生存率(图7h)。 图7 PD-L1抗体修饰的Fc-EVs用于恶性黑色素瘤的治疗
04总结作者开发了一种EV-抗体联合疗法,通过在Fc-EVs上展示特定的抗体,实现了对肿瘤细胞的精确靶向,并且Fc-EVs可以作为药物递送系统,通过将化疗药物Dox封装于EVs中,能够提高药物的疗效并减少副作用。
|  /3
/3 