金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
<span class=&#34;nolink&#34;>上一期文章中我们为大家介绍了流式实验流程中的实验设计、样本制备和样品染色,还没有阅读过的小伙伴可以先点击《流式细胞术实验流程》阅读后,再阅读本期文章哦!
赛尔普生物:史上最全 | 流式细胞术实验流程!3个步骤拿下!<hr/>《实验Protocol大全》,包含以下内容,有需要自取(文末还有!)
1)实验与Protocol-表型确认
2)实验与Protocol-分子机制
3)实验与Protocol-细胞交互
4)实验与Protocol-直接作用机制
5)中文版69个实验protocol大全--DNA技术+PCR技术+RNA技术+蛋白质技术+感受态技术+细胞技术
6)1502页的实验指南
7)14类实验课程+PCR
8)7大热门实验技术实验方案大全
9)分子生物学实验技术大全
10)免费实验技术查询:60,000种实验protocols和methods
11)实验技术及原理指南
如图所示操作即可领取
<hr/>一、样品读取
1)在设置仪器电压时,须遵守两个基本规则:
背景信号应位于对电子噪声贡献最小的区域。
阳性信号必须在标度范围内,处于检测器的线性范围内。 在设置电压时,通常可从仪器校准后的仪器设置开始。检查每个通道的阳性信号是否在标度范围内(图1)。若阳性信号过高,可降低通道电压,以确保染色的群体在标度范围。此步骤对于检测实验所使用的细胞是必需的,但对于其他试剂如捕获微球并非必需。
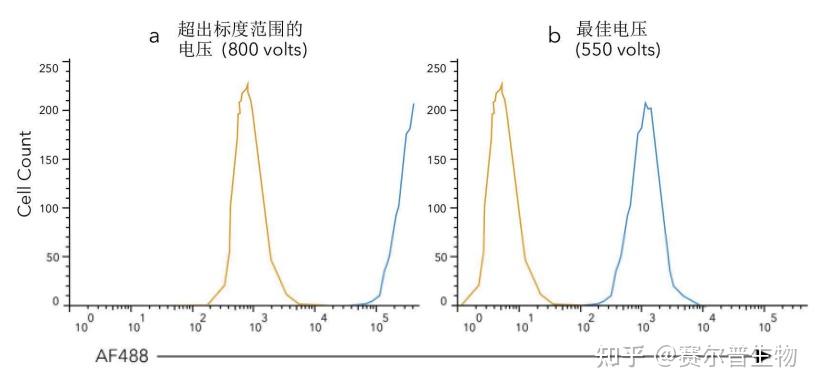
图1
图1:超出标度范围的电压vs.最佳电压。在设置流式细胞术的电压时,必须确保所有阳性信号都在标度范围内(在仪器可检测到的荧光限度内)。若电压设置太高(a),则阳性信号太亮,无法分辨。设置时必须始终注意,确保阳性信号在标度范围(b)。 2)利用单染对照进行补偿
在为每个通道设好最佳电压之后,接着测量补偿值。
注意:
由于抗体捕获微球具有高的结合能力,故不建议使用补偿微球来设置(或重设)电压。如果信号饱和,则降低在捕获微球上使用的抗体效价。
对于每个补偿对照,每个通道的电压必须相同。运行每种荧光染料对照,确保收集到足够多的阳性事件,并准确计算补偿值。补偿值可在釆集前利用仪器软件自带的算法来计算,也可在数据釆集后利用流式细胞术分析软件来计算。 3)应当收集多少事件?
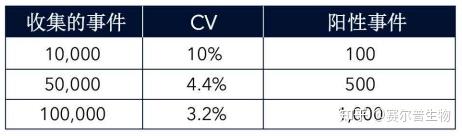
对于稀有群体,收集更大量的事件才能获得有重现性的结果。在一百万个细胞中寻找一个细胞,需要收集超过10000个细胞,甚至1000000个细胞。不过,这既没有严格的规则,也没有所谓“正确的”数字。使用正确的对照,了解所研究系统的生物学,才是最佳的入手点。
<hr/>二、分析
流式细胞术的数据分析软件通常使用含有一系列数据图的工作表来实现数据可视化。单参数(直方图)或双参数(散点图)显示了每种标志物的表达模式(图2)。通过设门来明确数据边界并分离具有共同表型特征的细胞,从而识别和分离感兴趣的细胞群体。利用层层设门或布尔逻辑可以缩小目标群体的范围。根据门内的数据点(如频率)进行统计计算。
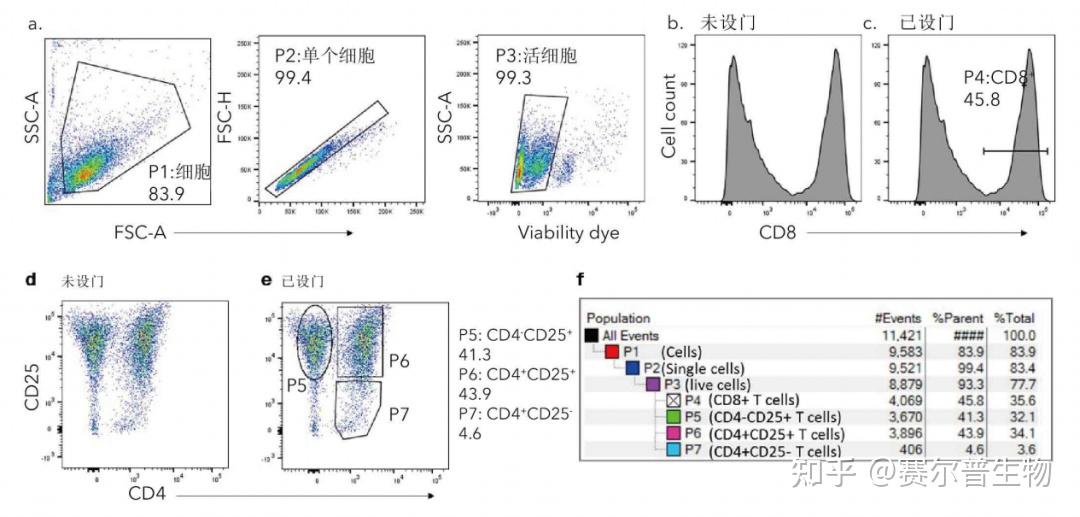
图2
图2:直方图、散点图和设门层次结构。利用CD3/CD28抗体刺激人CD3+T细胞7天。接着用hCD4抗体(R&DSystems货号FAB3791)、hCD8抗体(R&DSystems货号FAB1509)和hCD25抗体(R&DSystems货号FAB1020)对细胞进行染色。(a)绘制细胞群(P1)、单细胞群(P2)和活细胞群(P3)的图。hCD8的未设门(b)和设门(c)直方图。hCD4和hCD25的未设门(d)和设门(e)二维散点图。设置各种门的hCD4和hCD25的二维散点图。多边形门内是CD4+CD25T细胞群、长方形门内是CD4+CD25+T细胞群,椭圆形门内是CD4+CD25+细胞群(e)。设门层次结构如(f)图所示,其中CD8+直方图门(c)是P1、P2和P3的子门;CD4/CD25散点图(e)上显示的门(P5-P7)也是如此。 1)文件格式-FCS文件
流式细胞仪可以生成以FCS(流式细胞术标准)文件格式的数据。FCS文件由国际流式细胞协会(ISAC)的数据标准工作组建立和维护,提供了“完整描述流式细胞术数据集所需的规格”以及可在不同软件平台中分析的统一文件格式。
2)文件注释
FCS文件包含了许多可在分析期间使用的关键词。其中一些是标准文件所必需的,由制造商的软件自动填充。另外一些关键词需要用户输入。
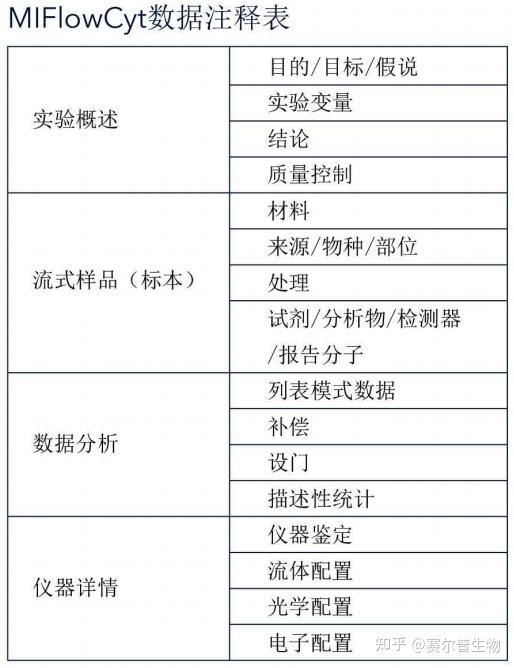
流式细胞术实验最低信息标准(MIFIowCyt)概括了数据注释的最佳做法,是ISAC公认的标准3。
注释包括样品名称、标志物/染料名称、处理方法等。
上方的表格源于MIFIowCyt文献,列出了一份更详尽的清单。根据最佳做法,实验变量的详细信息应与数据文件相关联。 3)数据分辨率和呈现
数据换算——每台流式细胞仪将获得的荧光信号处理成数字信号,并按一定的组距对荧光信号进行处理。组距的数量决定了数据的精度,通常用比特(Bits)表示。一般来说,获取数据的精度在10到24比特之间。数据可在线性或对数模式下获取,具体取决于荧光群体的动态范围(图3)。
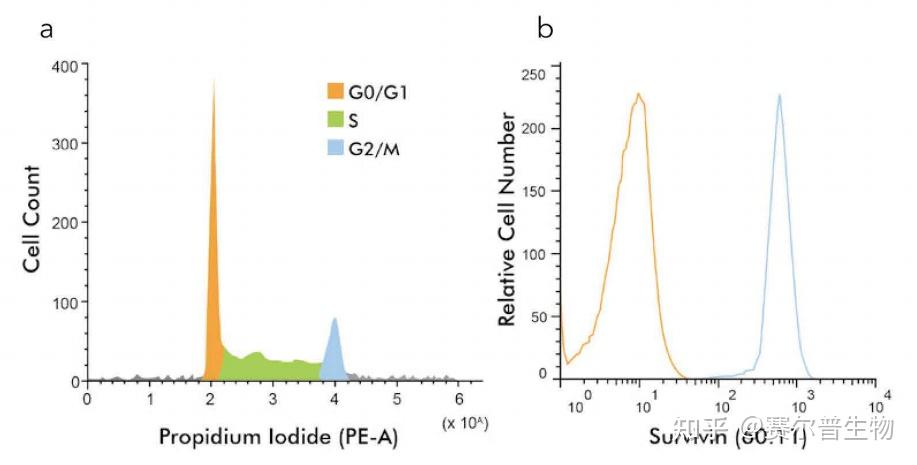
图3
图3.线性放大vs.对数放大。对于DNA含量分析等应用,从G1期到G2期的荧光存在线性变化,其中G2期的DNA量是G1期的两倍,这就需要数据的线性显示(a)。对于其他大多数应用(如免疫表型分析),当荧光水平在大的动态范围内变化时,数据是以对数模式获取的(b)。
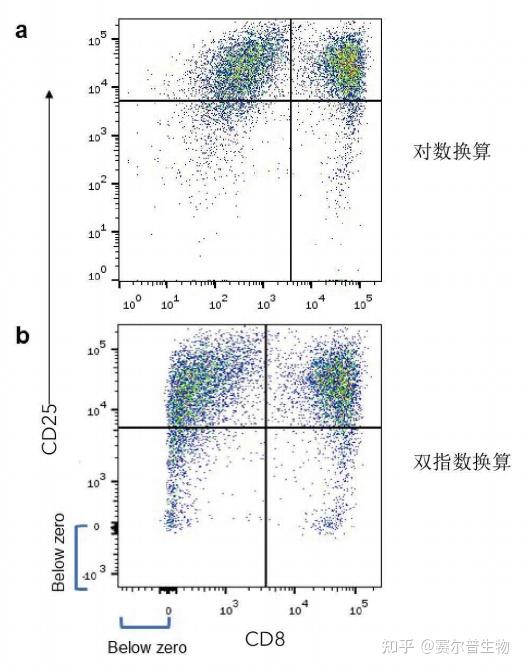
图4
数据转换——数据转换是另一种工具,用于显示具有高动态范围的数据。在流式细胞术中,数据转换有助于观察因背景扣除和扩散误差而落在零附近的数据点。这些数据点被分配到第一个对数通道,导致事件在轴上堆积4,5。双指数(Biexponential)和hyperlog是数据转换时常用算法(图4)。数据转换压缩了低于零和高于零的数据,以便更准确地观察这个较小范围内的数据。
图4.对数vs.双指数数据换算。利用CD3/CD28抗体刺激人CD3+T细胞7天,然后用hCD8抗体(R&DSystems货号FAB1509)和hCD25抗体(R&DSystems 货号FAB1020)对细胞进行染色。对数换算显示在(a)图,而双指数换算显示在(b)图。 4)数据清除
与其他技术一样,流式细胞术也很容易因仪器问题、样品制备问题或操作失误而产生异常数据。这对质控来说很重要,如有必要可清除异常数据,避免错误解读。数据清除时的设门策略包括:
间设门——记录样品的持续时间是每个FCS文件中包含的参数。这可以与散点图中的其他任意参数作图,以寻找流体系统的不稳定性。例如,在出现堵塞或气泡的情况下,用户可对异常值以外的持续时间进行设门,以确保测量的荧光没有错误(右图)。
在某些情况下,一旦问题得到解决,可能需要从分析中删除样品信息或重新记录数据。在釆集过程中也可以监控此时间图,以便及时发现和解决问题。
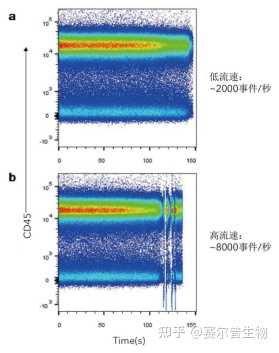
图5
图5:低速vs.高速采集时间图。利用hCD45抗体(R&DSystems货号FAB1430)对PBMC进行染色,并在Fortessa上低速(a)或高速(b)釆集样本。(a)低速(~2000个事件/秒)釆集在时间对CD45双参数图上显示出稳定的液流,而高速(8000个事件/秒)采集(b)显示出液流的多次中断。 散射光设门——根据细胞形态和光散射特征,FSC和SSC双参数图可提供细胞的粗略视图(图6)。在FSC参数上设置阈值可以排除检测中的噪声。阈值决定了将电信号计为事件所需的最低值。此外,散射图可提供了解死细胞数量、碎片量和细胞团块的概况,可作为初始数据清除门。或者,散射门可在时间设门和单细胞设门后设置,作为活细胞设门之前的数据清除门。
单细胞设门——流式细胞术是一种单细胞水平的检测技术。但是,细胞有可能粘在一起,或串联通过分析点。若在分析时没有处理细胞团块(包含感兴趣的细胞和阴性群体),则会导致结果不准确。
单细胞设门通过测定电脉冲信号的高度(H)、宽度(W)和面积(A)参数来区分单细胞群和粘连细胞群。结合两种脉冲参数值,能够鉴定出粘连细胞群,并对单细胞群体设门(图6b)。在一些应用中,对荧光标志物(如DNA结合染料)进行单细胞群设门可能很有用。注意:并非所有这些脉冲测量值都自动包含在数据文件中,因此在分析之前切记在软件中先设置好。
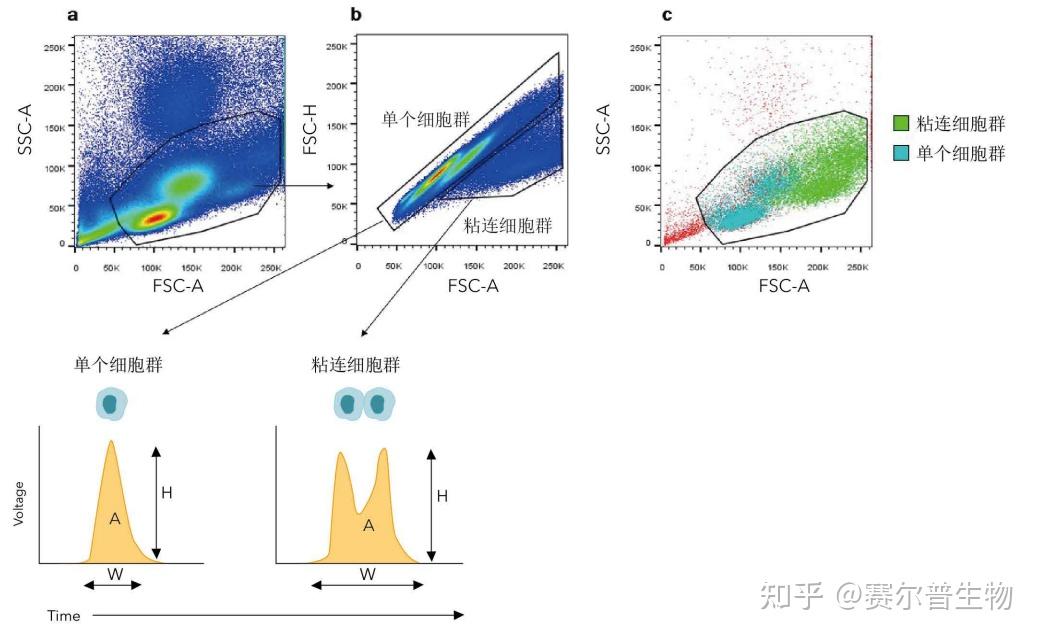
图6
图6.排除粘连细胞,对活细胞(a)设门后利用FSC-Avs. FSC-H可以识别单个细胞群和粘连细胞群(b),(c)图显示了FSC/SSC图上粘连细胞群(绿色)和单个细胞群(蓝色)的重叠。 活细胞设门——当样品中存在死细胞时,可能会影响数据分析。在理想的情况下,样品制备过程应当尽量减少细胞死亡。细胞活力染料有助于将死细胞排除在后续分析之外。根据需求,活力染料可对散射参数或某一荧光标志物作图(详见图7)。
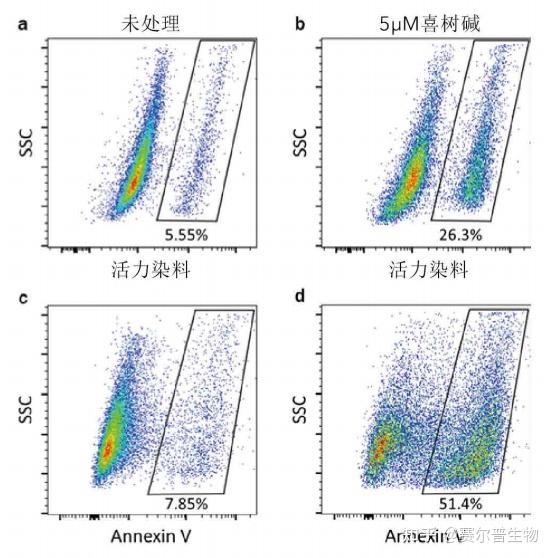
图7
图7.通过细胞活力染料检测凋亡细胞。KG.1细胞未经处理(a和c),或经过5μM喜树碱(TocrisBioscience货号1100)处理12小时,以诱导细胞凋亡(b和d)。收集细胞,并用胺基活性染料(a和b)或AnnexinV(c和d)标记。在胺基活性染料或AnnexinV标记后显示阳性荧光的细胞为死细胞。胺基活性染料与AnnexinV识别的死细胞比例有差异,主要是因为AnnexinV识别早期和晚期凋亡的细胞,而胺基活性染料只在质膜变得多孔后标记晚期凋亡细胞。 <hr/>其他设门策略
DUMP通道——对于流式细胞术的某些组合,可能需要将多个类型的细胞排除在后续分析之外。这种情况下可使用dump通道。通常利用相同染料标记多个不同细胞的标志物,通过对阴性群体设门,区分那些标志物呈阳性的细胞类型,并排除在分析之外(图8);
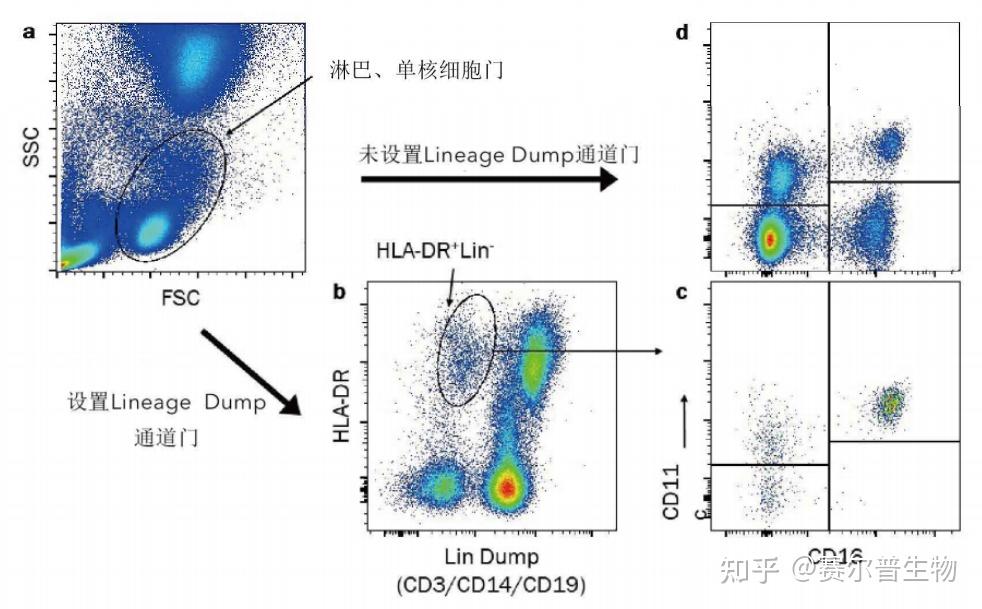
图8
图8.利用谱系标志物的dump通道来识别人血液样本中的树突细胞。血液树突细胞是人血液中的少量细胞群体,存在于淋巴细胞群中。对淋巴细胞/单核细胞设门(a),然后确定血液树突细胞为HLA-DR+、“Lin”阴性(CD3-CD14-CD19-)的细胞(b)。为了便于血液树突细胞的检测,利用谱系标志物CD3抗体(R&DSystems货号FAB100)、CD14抗体(R&DSystems货号FAB3832)和CD19抗体(R&DSystems货号FAB4867)建立“Lin”的dump通道。所有这些抗体都用AF405标记。根据其他细胞表面蛋白的表达,如CD11c(R&DSystems货号FAB1777)和CD16(R&DSystems货号FAB2546),将HLA-DR+Lin-细胞进一步分成不同群体(c)。散点图(d)显示了不使用dump通道时CD11c和CD16群体的大小和分布。 荧光减一对照——某些群体可能难以鉴定,因此如何设置门边界成为一大挑战。在这些情况下,荧光减一对照(FMO)能够更准确的设门。FMO对照的染色方式与样品相同,但减少了一种目标标志物的染色。这种对照显示了除一种试剂外其他试剂贡献的背景荧光,从而更准确地指导设门的边界(图9)
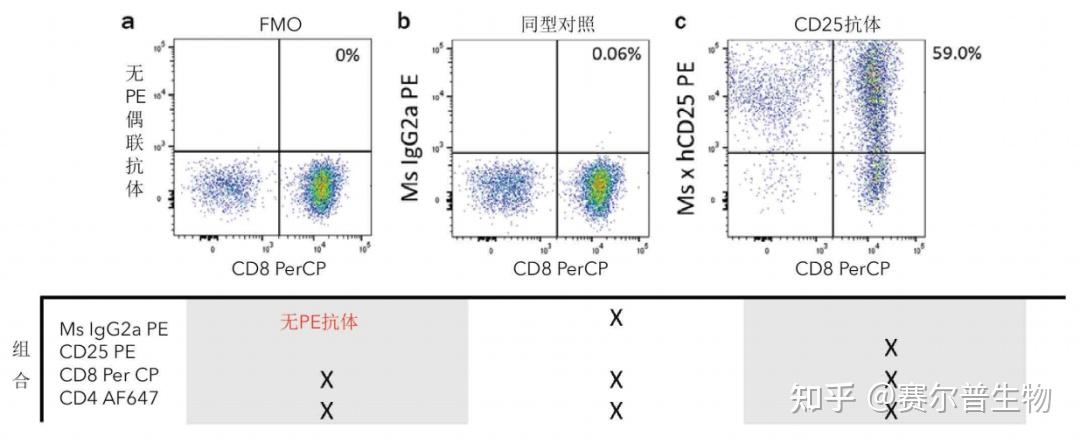
图9
图9.FMO和同型对照的图示比较。使用αCD3/αCD28抗体(分别为5 μg/mL和2 μg/mL)刺激CD3+T细胞9天。收集细胞,并用AF647标记的CD4抗体(R&DSystems货号FAB3791R)、PerCP标记的CD8抗体(R&DSystems货号FAB1509C)和PE标记的CD25抗体(R&DSystems货号FAB1020P)对细胞进行染色。(a)为CD25的FMO对照,即用除一种抗体(CD25PE)外的其余所有抗体(CD4AF647和CD8PerCP)染色细胞。(b)为CD25的同型对照,使用CD25PE的同型对照MslgG2a PE抗体加上CD4AF647和CD8PerCP染色细胞。(c)为全染样本,使用所有三种一抗(CD4AF647、CD8PerCP和CD25PE)对CD3+T细胞进行染色。当MslgG2a PE同型对照抗体和相应的CD25PE抗体的浓度被正确滴定时,(a)图中CD8+细胞在PE通道中的MFI为143而(b)图中CD8+细胞在PE通道中的MFI为169。 反向设门——反向设门是一种非常有用的设门策略,可用于验证门是否能正确鉴定、且未排除任何感兴趣的事件。在分析软件中可以对细胞群体进行着色,以便轻松区分这群细胞在其他图中的分布(图10)。如有需要可调整门,从而更好地圈出感兴趣的细胞,或排除不想要的细胞。
<hr/>统计数据:流式细胞术主要使用两种数据值:频率和荧光强度(图11)。
频率表示特定群体在整个样品或细胞亚群中的比例。
荧光强度在对数数据中应该为荧光强度中位值(MFI,其中M代表中位数)。在比较不同实验(特别是不同仪器)的MFI时应当谨慎,因为仪器配置和设置会极大地影响该值。为了实现准确的比较,可能需要使用微球校正MFI,配合电压调整,从而使仪器的设置统一标准化。
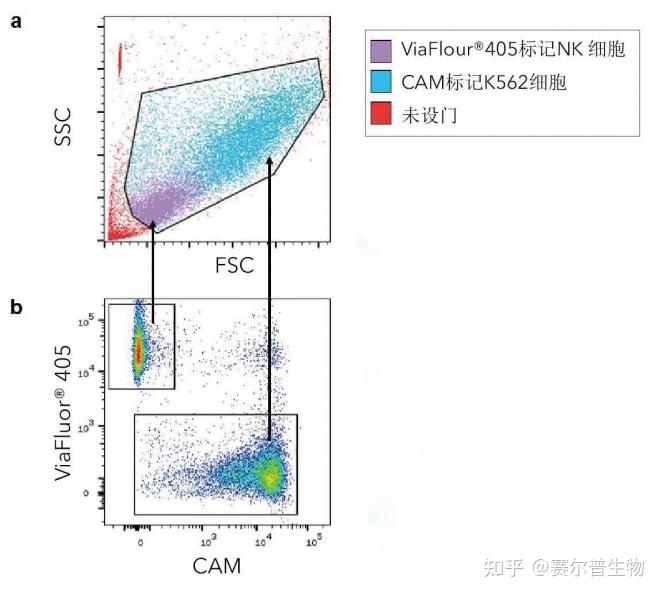
图10
图10.利用反向设门检测特定的细胞群体。ViaFluor®405(2.5 μM)标记活化的NK细胞,并用CAM(0.1 μM)标记K562细胞;两者都在37°C下静置30分钟,然后开展杀伤实验。以0.5:1(NK细胞:K562细胞)的比例混合细胞。上面的散点图显示了混合细胞群的FSC/SSC分布(a)。通过对ViaFluor®405标记的NK细胞和CAM标记的K562细胞进行反向设门(b),以显示它们在FSC/SSC点图中的相对分布(a)。
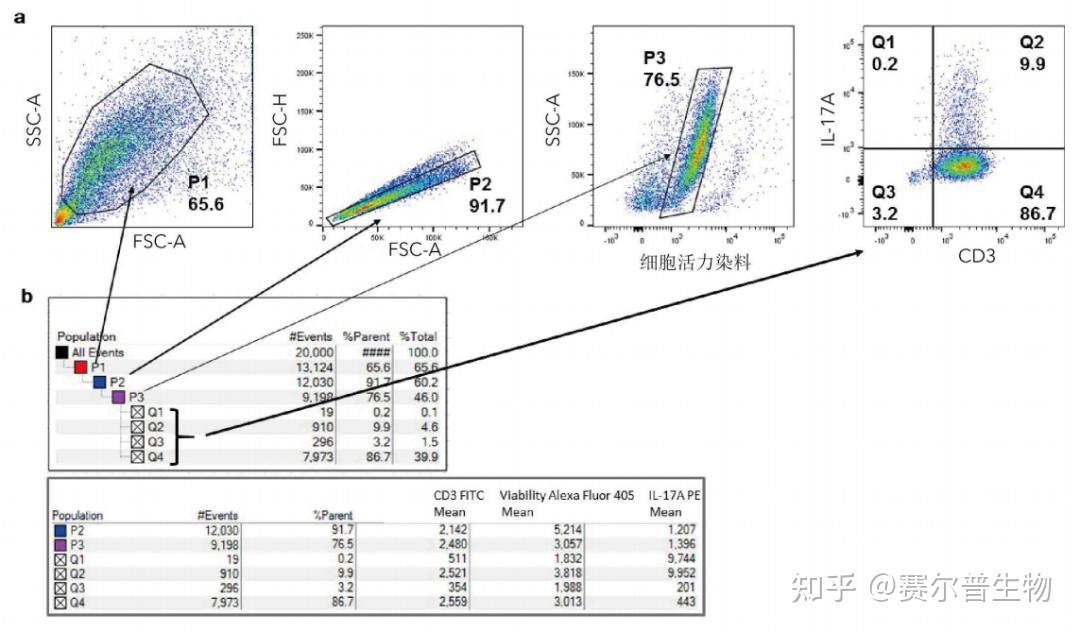
图11
图11.统计数据的分析。将纯化的CD4+T细胞经过5天极化为hTh17细胞。使用Tocrisreactivation cocktail (TocrisBioscience货号5476)再次刺激后,用细胞活力染料和CD3抗体对hTh17细胞进行染色。使用FoxP3buffer kit(R&DSystems货号FC012)染色胞内IL-17A。在Fortessa上读取分析数据。(a)散点图显示了淋巴细胞门(P1)、单细胞门(P2)、活细胞门(P3)和CD3+IL-17A+T双阳性细胞门(Q2)(抗体分别为R&DSystems货号FAB100F和R&DSystems货号IC317P)。(b)图显示了每个散点图的分群结构,并且通过箭头显示了对应每个散点图的门(上图)。细胞数量、占上级细胞群的百分比(频率)以及CD3FITC、细胞活力AlexaFluor® 405和IL-17APE的MFI值等统计数据均呈现在最下方图中。 参考文献:1.RoedererM. (2008) How many events is enough?Are you positive?Cytometry A.73(5):384-5.PMID: 183072572.DonnenbergAD,Donnenberg VS.(2007) Rare-event analysis in flow cytometry. Clin LabMed.27(3): 627-52.PMID: 176584103.LeeJA, Spidlen J, Boyce K,Cai J,Crosbie N,Dalphin M, Furlong J, Gasparetto M, Goldberg M, Goralczyk EM, HyunB, Jansen K, Kollmann T, Kong M, Leif R, McWeeney S, MoloshokTD,Moore W, Nolan G, Nolan J, Nikolich-Zugich J, Parrish D, Purcell B,Qian Y, Selvaraj B, Smith C, Tchuvatkina O,Wertheimer A, Wilkinson B Wilson C, Wood J, Zigon R; InternationalSociety for Advancement of Cytometry Data Standards Task Force,Scheuermann RH, Brinkman RR.(2008) MIFIowCyt: the minimuminformation about a Flow Cytometry Experiment.Cytometry A.73(10):926-30.PMID: 187522824.McNeilLK, Price L, Britten CM, Jaimes M, Maecker H, Odunsi K, Matsuzaki J,Staats JS, Thorpe J, Yuan J, Janetzki S. (2013) A harmonizedapproach to intracellular cytokine staining gating:Results from aninternational multiconsortia proficiency panel conducted by theCancer Immunotherapy Consortium (CIC/CRI).Cytometry A. 83(8):728-38.PM ID: 237884645.ParksDR, Roederer M, Moore WA.(2006) A new &#34;Logicle&#34; displaymethod avoids deceptive effects of logarithmic scaling for lowsignals and compensated data.Cytometry A. 69(6):541-51 .PMID:16604519
<hr/>三、往期热门资源有需要自取哈
ELISA实验学习资料汇总
WB技术大全
生物实验必看之《实验室保命指南》
如图所示操作即可
如图所示操作即可
如图所示操作即可
往期高赞内容推荐:
合集 | SCI论文最标准的Figure图处理规范(含详细工具)
科研绘图王炸:最全矢量素材免费网站/软件合集!
科研画图都用什么软件?
ImageJ定量分析 WB 灰度值(详解版)
赛尔普生物:9个Western Blot工具,帮你搞定实验最关键的一步!
如何查看国家自然科学基金的的摘要和下载结题报告?
赛尔普生物:查询历年国自然科学基金项目?这8个网站必看!
免费好用的PDF编辑器,推荐一下?
白嫖这12个插件,让你的Zotero成为地表最强文献管理器!
赛尔普生物:强推ScienceSlides!好用到离谱的科研插画神器!
endnote x9 激活版下载!
生信分析入门 | 看完别说你不会生信了 |
|
 /3
/3 