金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
变更注册/备案
一、变更注册/备案
已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册申请人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告。
二、变更注册
- 注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求发生变化。
2.进口医疗器械生产地址发生变化。
3.注册证中"其他内容"发生变化。
三、变更备案
- 注册证中注册人名称和住所、代理人名称和住所发生变化。
- 境内医疗器械生产地址发生变化。
四、注册变更办理流程
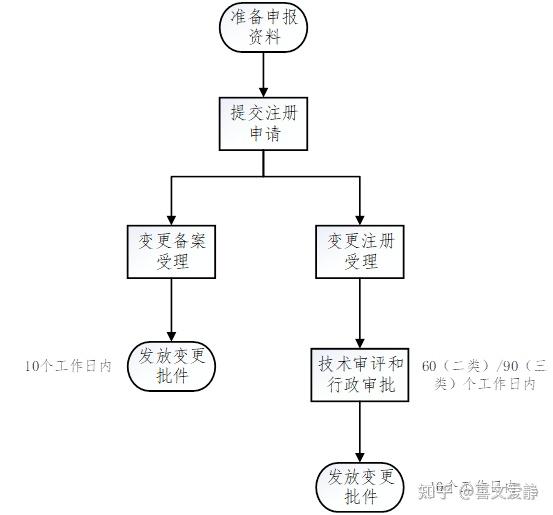
五、TIPS
对于线上途径(eRPS系统):变更备案、变更注册申请可在同一申请表申请,合并变更情形仍然按照现行流程分发变更注册受理号,自动关联变更注册电子目录,在进口医疗器械/体外诊断试剂变更注册电子目录的"CH2.7其他申报综述信息"中体现变更备案需提交的资料。
对于线下途径:变更备案、变更注册申请须分别填表,分别准备材料,同时准备符合《关于发布医疗器械注册电子申报目录文件夹结构的通告(2021年第15号)》要求的电子资料。
医疗器械变更注册文件与原医疗器械注册证合并使用,其有效期与原注册证相同。
取得变更注册文件后,注册人应当根据变更内容自行修改产品技术要求、说明书和标签。
发生其他变化的,注册人应当按照质量管理体系要求做好相关工作,并按照规定向药品监督管理部门报告。
变更事项不可与延续注册合并提出申请。
延续注册
一、延续注册
申请人应当在医疗器械注册证有效期届满6个月前,向药品监督管理部门申请延续注册,并按照相关要求提交申报资料。
二、不能延续的几种情况
申请人未在规定期限内提出延续注册申请;
新的医疗器械强制性标准发布实施或新的体外诊断试剂强制性标准或者国家标准品发布实施,该医疗器械/体外诊断试剂不能达到新要求;
附条件批准的医疗器械,未在规定期限内完成医疗器械注册证载明事项。
三、延续注册办理流程
向原注册部门申请延续注册,参考关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)和关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2021年第122号)相关要求提交申报资料。
资料经立卷审查并受理后,需由技术审评机构重点针对变化部分进行审评,并于60(第二类)/90(第三类)个工作日内完成技术审评工作,若需补充资料的情形参见"发补")。
10个工作日内由相关部门发放延续注册文件。
四、TIPS
查询延续注册项目注册证号和批准日期:登录器审中心网站"办事大厅"栏目,在"审评进度查询"栏中,通过输入受理号、受理日期、申请单位、数据校验码等信息查询。
原医疗器械注册证中载明要求继续完成工作的,应在注册证有效期内产品分析报告中提供相关总结报告,并附相应资料。
在领取新的医疗器械注册证书时,应先提交原注册证原件,可通过邮寄提交。
已注册产品,其管理类别由高类别调整为低类别的,医疗器械注册证在有效期内继续有效。有效期届满需要延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照调整后的类别向相应的药监部门申请延续注册或者进行备案。管理类别由低类别调整为高类别的,注册人应当按照改变后的类别向相应的药品监督管理部门申请注册。
延续注册的批准时间在原注册证有效期内的,延续注册证的注册证有效期起始日为原注册证到期次日;批准时间不在原注册证有效期内的,延续注册的注册证有效期起始日为批准延续注册的日期。
说明书更改
一、说明书更改告知
已注册医疗器械的说明书,除注册证及其附件载明事项之外的其他内容发生变化,不属于变更注册范围内的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。
办理说明书更改告知需满足以下条件:
已注册医疗器械的说明书
除注册证及其附件载明事项之外的其他内容发生变化
不属于变更注册范围内的
二、三种审查结果
同意
不同意
部分同意
三、办理流程
线上途径(eRPS系统):行政相对人通过eRPS系统提交说明书更改告知申请及相关资料。
线下途径改:符合条件的行政相对人应按照《关于发布医疗器械注册证补办程序等5个相关工作程序的通告》的相关要求准备资料。
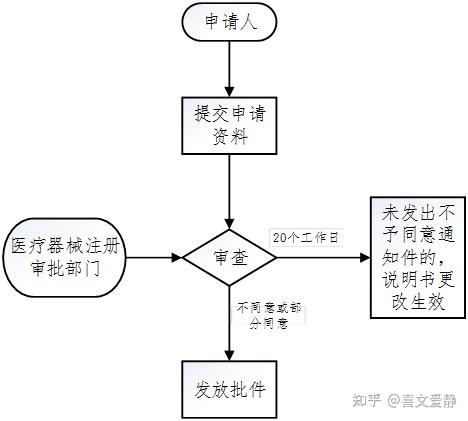
四、TIPS
器械注册审批进度可前往国家药监局网站查询,随时关注。
进入国家药品监督管理局办事服务版块,在"送达信息"页面查看"说明书不予同意通知件发布通知"。
规定时限内未答复的视为同意。
其他
一、补办申请
注册人可在医疗器械注册证/变更文件有效期内,对注册证和/或其附件、变更文件提出补办申请。
办理流程
1.注册人向国家药品监督管理局行政受理服务大厅提出相关事项补办申请,申请资料准备参照《关于发布医疗器械注册证补办程序等5个相关工作程序的通告》(2015年第91号);
2.形式审查通过后,行政受理服务大厅按程序转国家药品监督管理局医疗器械注册管理司(简称"器械注册司")办理;
3.器械注册司经办人自接到资料之日起,10个工作日内出具审核意见,处负责人在4个工作日内出具审定意见,反馈至行政受理服务大厅;
4.行政受理服务大厅在10个工作日内依据相应意见制作文件,并按照有关规定履行送达程序。
Tips:
补发的医疗器械注册证备注栏中应载明"xxxx年xx月xx日补发。原xxxx年xx月xx日发放的注册证作废"。
二、纠错申请
注册人可提出医疗器械注册证/变更文件纠错申请的情形:
- 注册证、变更文件及其附件打印错误;
- 注册证编号错误;
- 企业填报错误;
- 审评、审批工作中出现的其他错误。
办理流程
1.注册人向国家药品监督管理局行政受理服务大厅提出相关事项纠错申请,申请资料准备参照《关于发布医疗器械注册证补办程序等5个相关工作程序的通告》(2015年第91号);
2.经形式审查确认属于注册证、变更文件及其附件打印错误的由行政受理服务大厅即时予以办理;
3.经形式审查确认属于注册证编号错误的,按程序转器械注册司办理;
4.其他情况,按程序转国家药品监督管理局医疗器械技术审评中心(简称"器审中心")办理。器审中心自接到纠错申请资料之日起,应当在30个工作日内依据申请资料要求进行审核并提出意见,器械司经办人自接到纠错申请资料之日起,应当在10个工作日内提出审核意见,处负责人在8个工作日内出具审定意见,2个工作日内反馈至受理服务和投诉举报中心;
5.行政受理服务大厅在10个工作日内依据相应意见制作文件,并按照有关规定履行送达程序。
Tips:
相关纠错信息同时需转国家药品监督管理局信息中心,由信息中心在国家药品监督管理局网站上及时予以公布。
三、自行注销申请
注册人可对尚在有效期内的医疗器械注册证/变更文件提出自行注销申请。
办理流程
1.注册人向国家药品监督管理局行政受理服务大厅提出相关事项自行撤销申请,申请资料准备参照《关于发布医疗器械注册证补办程序等5个相关工作程序的通告》(2015年第91号);
2.形式审查通过后,行政受理服务大厅自受理后3个工作日内,将申请资料移交器械注册司;
3.器械注册司经办人自接到资料之日起,10个工作日内核实有关情况,拟定注销公告,处负责人在5个工作日内提出复核意见,司负责人应当在5个工作日内提出审定意见;
4.审定完成后,按照国家药品监督管理局文件发布程序报批发布。
四、注册证及其附件信息确认
注册人可对境内第三类、进口第二类和第三类医疗器械产品注册、变更注册、延续注册项目中的以下信息进行确认:
1.注册证书载明事项;
2.变更文件载明内容;
3.注册证书或变更文件的附件,包括:产品技术要求、产品说明书、以附页形式载明的注册证书或者变更文件信息。
确认主要是针对上述内容是否完整、文字是否正确,申请人/注册人名称、住所、代理人名称、住所及生产地址等登记事项信息与相关资格证明文件内容是否一致。
办理流程:
1.对于线上申报项目,由eRPS系统在每个工作日的固定时间将含有相应项目注册证书或者变更文件信息的《医疗器械注册证信息确认单》(以下简称"确认单")及注册证书或者变更文件附件推送至申请人/注册人/代理人,并发送短信通知。
2.对于线下申报项目,审评员从审评系统将含有相应项目注册证书或者变更文件信息的确认单及注册证书或者变更文件附件导出生成文件,并通过注册申请表中留存的电子邮件将文件发送至申请人/注册人/代理人。
3.可凭CA登录eRPS系统(线上项目)或通过电子邮件(线下项目)接收确认单,查看相应项目需确认内容并逐项进行核实。所有栏目信息均完成确认后,线上项目应点击"完成确认"按钮,线下项目应通过电子邮件将确认结果回复审评员。
4.应在收到确认单之日起2个工作日内(不含当日)回复,未回复意见的,视为申请人/注册人/代理人同意注册证书或变更文件及其附件内容。
5.上述内容确认完成后,为确保后续注册证附件内容准确,格式无误,请申请人/注册人/代理人将确认后的产品技术要求、产品说明书、载明注册证书或者变更文件信息的附页最终版本的PDF文件通过电子邮件发送至审评员邮箱内。
注:补办、纠错、自行注销和注册证及其附件信息确认等非行政审批事项均不收费! |
|
 /3
/3 