金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
24年8月28日更新
更新下我最近的日常,最近呢不是像以前特别拼,最近比较佛系[睡觉R]。目前比较担忧的是送检,跟检的问题,医疗器械注册最开始 就是了解产品的原理 预期用途 编写技术要求和说明书。我已经把送检资料和设备寄给检测所,受理了。检测花费在5万左右。 目前检测老师正在看资料,后面核对设备,领导也在问进度,我是希望[皱眉R][皱眉R][皱眉R]赶快开检的,和领导说的是下周开检,希望不会延迟或遇到什么问题。
另外一件事 是软件的检测,今天针对说明书中软件的操作不懂的地方,请教了同事。也是之前没有接触过的产品,很多的医学术语,[叹气R][叹气R][叹气R]根本不知道什么意思,自己搜一些医学视频和术语解释看。或者可以搜搜文献。
三件事就是可用性的撰写,这个设备之前没有接触过,按照目前想法,低风险写一个使用性错误评估报告[拔草R][拔草R]
#医疗器械注册 #我的北漂生活 #NMPA认证 #医疗器械注册工程师 #医疗器械注册专员 #检测排队多了多久?
更新了,家人们,24年7.27
今天周六,买了零食,点了芝士饭,享受无忧无虑的周末。发现自己很喜欢火龙果,拿勺子 吃太快乐了。最近开始新任务了,产品变更注册,强标升版,还有新产品型号的增加,还有软件产品说明书,在学习软件使用,都是新的挑战呀,有时候无从下手。

芝士盖饭打开盖子香气扑鼻,香气四溢

美团点了一堆零食,主要怡宝9.9米12瓶太划算了。

2023年结束,2024年了。
今天是24年4月29日, ️下雨,赶地铁中,依然是打工人一名。昨天吃的兰州拉面。1

--------分割线---
原回答:
2021年进入医疗器械行业,开始慢慢了解,当时进入的部门是研发部,研发部里的注册组,当时不明白啥是注册,也没关注,就开始做注册需要的工作,资料整理,因为工科专业,会CAD,solid works画图,所以注册资料里的示意图,三维图,效果图,力学试验工装都是自己画,个人能力不错,资料也写得可以,目前工资8700,前几天有面试个小公司,给9500,全额缴纳五险一金,包中午饭或者给餐补,但是我懒得折腾,想着先在现在这个公司干着。
公司不管吃住,有15餐补,在北京租房,吃饭是比较贵的。有时候会看一些公司,好多公司不了解,不知道工作情况具体怎样。
一般注册都是不会画图的吧,学医或者药或者别的专业,有些工科专业也做注册,还是公司部门职责划分,注册主要是按照国家药监局注册目录把资料整理出来,提交给官方,这个资料太多了,涉及的范围很广,这个是注册的中期工作,
前期应该是产品技术要求,注册计划的制定,还有送检产品,联系送检,做力学试验了,生物学试验了,这个工作看公司的安排,平常咋划分,研发也是同时参与的,技术要求是研发定,技术要求包括产品的名称,示意图,规格,性能,配合性能,机械性能,
送检,北京的检测所,天津的检测所,等,
国家药监局注册目录,三类就是人体植入的6章资料,每章又分为好多节,有些人没有耐心,不细心,特别烦整理文件资料,做注册的女生好像偏多,女生可能细心,临床评价写100多页WORD,和写论文是的,查文献,挺麻烦的。
注册第一次提交资料,国家药监局老师看了,提出问题,进行补充修改,这个习惯叫补正,补正成功,受理了,就得给国家药监局缴费,一个三类的大概15万。
受理了没完,体系考核,简称GMP,国家药监局老师来公司现场审核,要看设计开发文件,设计开发文件也是像本厚书一样,设计输入,输出,验证,风险分析,意思,证明公司为啥做这个产品,公司能做好这个产品,一堆验证,清洗了,包装,加工了,工艺了,太多了,设计开发文件应该是研发负责,可能有的公司注册也同时负责,还要现场答辩,给老师讲产品,回答老师的问题,好像是开15个不合格,答辩不过,就和毕业一样的感觉,比做毕业论文还累,也看个人能力,总有些学霸。
体系过了,还要审核,国家药监局老师,哎就是玩,再看第一次提交的注册资料,这回细看,产品的这个关键尺寸没有,力学试验不充分,生物学没有提供资质,阳极氧化工业验证,等,每个老师提到问题,都可能有差异, 2023年更新中
中秋快乐,一起吃公司发的月饼啦。



医疗器械注册欧盟学习
2023.8.31,这个月结束了,家人们。好累呀。我现在在地铁上,最近看了一路朝阳电视剧。看的根本停不下来了。北漂的辛苦。房子的价格。

地铁宣传片。

一路朝阳
https://www.zhihu.com/video/1680499460730384384
最近在更新一些国外注册年度审核的资料。比如IEC报告什么的。看看报告内容。学习下软件全生命周期技术文件编写培训。学习Fda法规。Fda官网指导原则。
FDA知识分享:第一类:设备受一套全面的监管当局的约束,称为通用控制,适用于所有类别的设备。II类:一般控制本身不足以对设备的安全性和有效性提供合理的保证,并且有足够的信息来建立特殊控制以提供此类保证的设备。III类:一般控制本身不足,并且没有足够的信息来建立特殊控制以合理保证设备的安全性和有效性的设备。III类设备通常需要上市前的批准
有个同事问我国内注册费标准在哪找,这个是官方发的通告,顺便分享给大家。
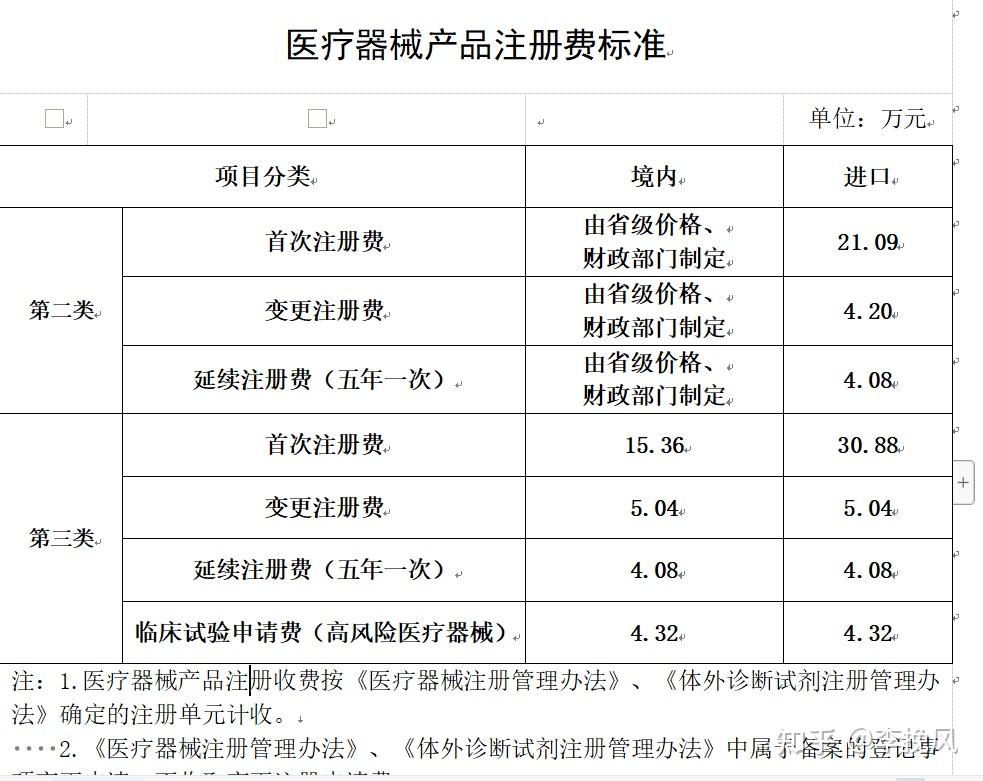
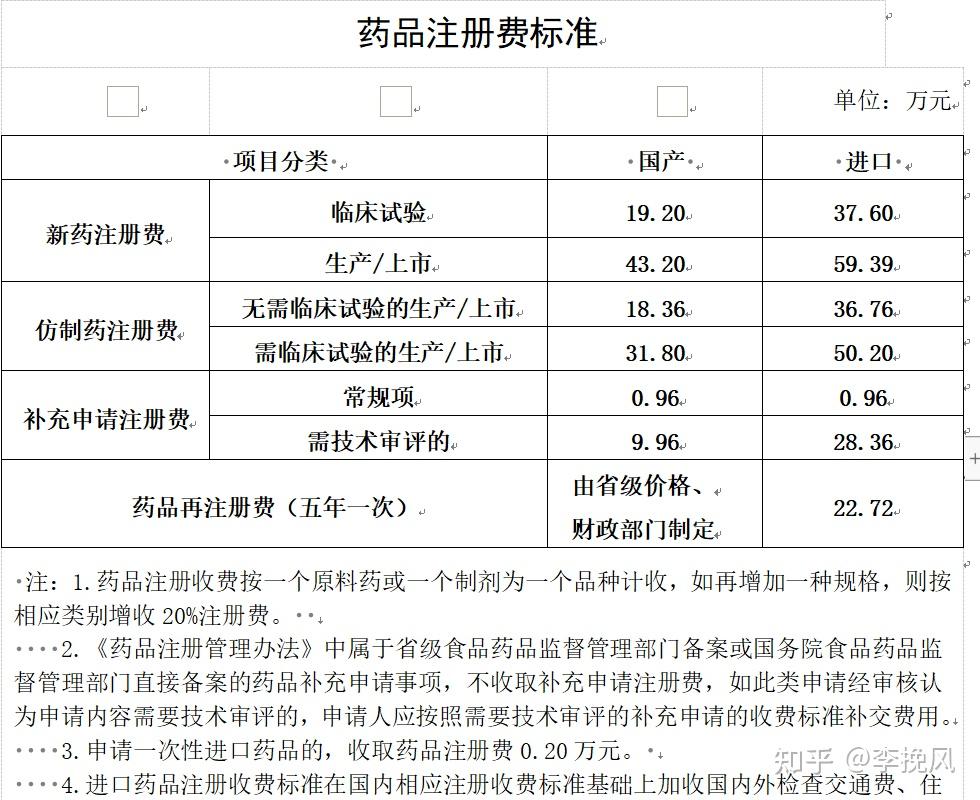
2023.7.21更新
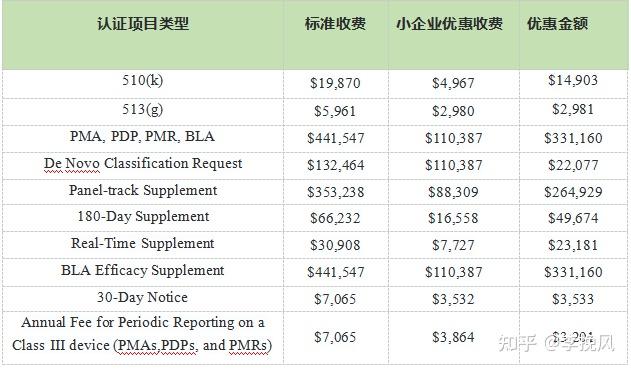
在做FDA认证项目时,FDA针对有小企业资质的企业在一些认证项目的审评费方面会有很大力度的优惠。但是要注意FDA针对年费是没有小企业优惠的。
2023财年标准收费和小企业优惠收费如下:
一、申请小企业资质的条件
最近一个纳税年度的总收入或销售额不超过1亿美元。
如果有任何分公司,需把它们的总收入/销售额加上,总额不得超过1亿美元。
二、可申请小企业资质减免审核费的认证项目类型
上市前通知510(k)、De Novo、上市前申请(上市前批准申请PMA、生物制品许可证申请BLA、产品开发协议PDP)、上市前报告PMR、PMA/BLA补充和PMA年度报告,以及513(g)分类信息请求。
三、小企业资质有效期
小企业资质有效期以美国的一个财政年授予,在该财政年结束时失效。
即从每年的10月1日至次年的9月30日。
<hr/>腾讯会议1对1教学50元,欢迎报名
1.医疗器械注册专员招聘面试咨询;
2.医疗器械注册专员行业快速了解;
3.医疗器械注册知识法规,普及,教会你注册思路。临床评价怎么写,法规标准怎么查,注册思路和流程。
4.可收徒弟。本人一本毕业生,工作一年月入上万。
#医疗器械注册 #我的北漂生活
2023.7.17 今天受邀参加了访谈会

参加活动第一部先领礼品。电风扇,水杯,冰袖,糖 ,抱枕,全部装上,还送个包,送水

2023.6.28 欧盟医疗器械CE注册流程(新手干货)看我这篇文章:
https://zhuanlan.zhihu.com/p/640049304日常看下面:
2023.6.17 最近我厉害了哈,免费请大家看电影,还给30块钱哈,其实不是我请哈,只限北京哈,电影是还未上映的,想看的直接评论区@我,或者给我留言,我看到马上回复哈。名额特别多,不用担心没有
2023.6.17 今天不谈工作,给大家推荐一款鞋子
鸿星尔克2023新款

这款是象牙白,还有酷酷的绿色,黑色,非常NICE


链接给大家放这了。
2023.5.8更新:新公司非常nice,很正规,园区环境非常好,距离地铁站1公里,饮水机全自动,抽纸自动感应。饭补,全勤,交通补齐全。
目前居住距离比较远,每天通勤3小时,感觉每天上班加通勤,加睡觉,没时间更新了。最近在学习GB9706.1通用要求和电磁兼容。
GB9706.1我学习的步骤,是从网上了解下背景,然后看标准pdf.,可能有的专业术语看不懂,看了7章,然后挺中检院的培训视频,前8章是第一个视频。中检院所以标准的培训视频都有,而且有检测报告模板。
餐厅外面的户外饭店
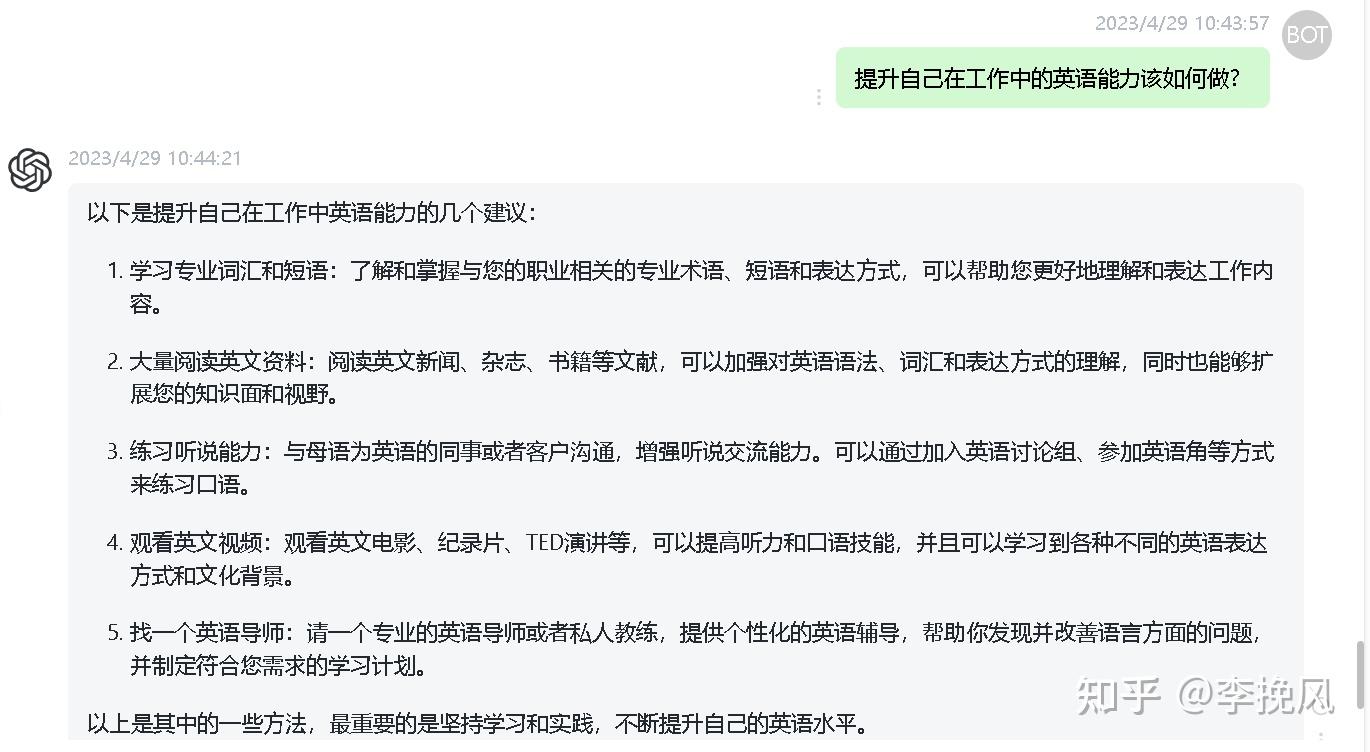
2023.4.29更新:分享一个国内免费使用无需注册的chatGPT网站,有需要留言,点个关注免费分享。
2.如何学习英语
3.读研和工作选择哪个工资高

4月26日
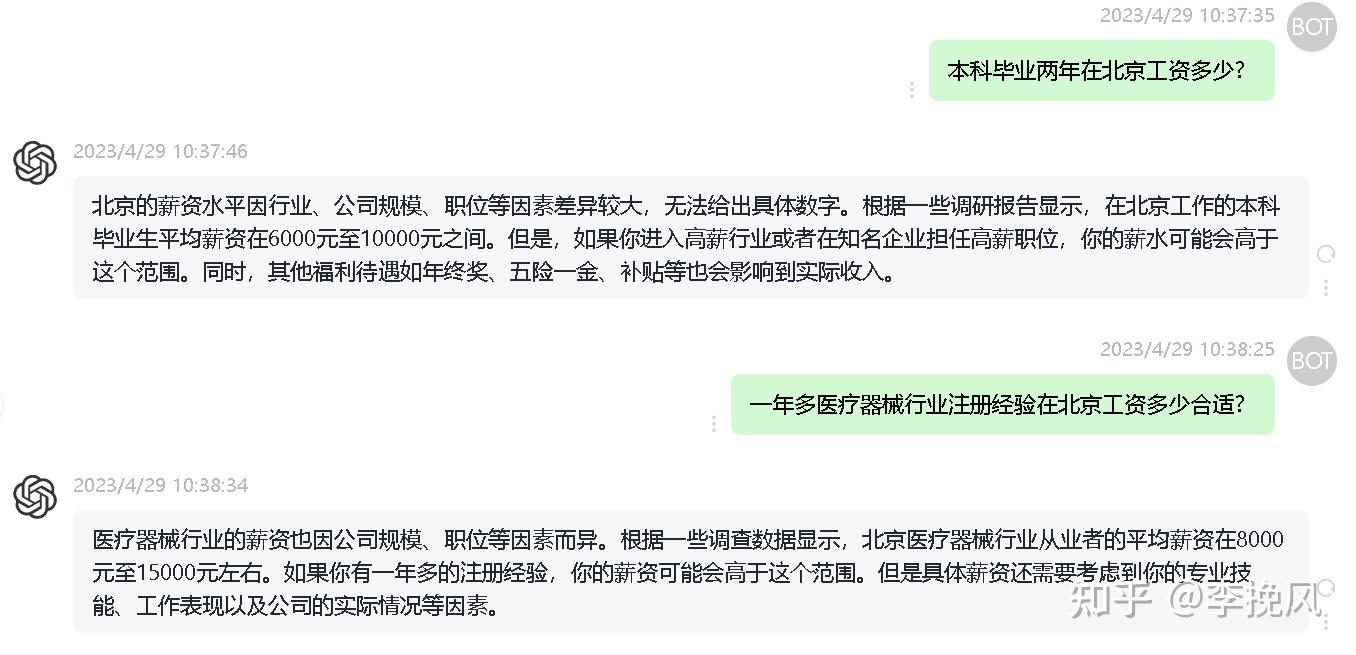
4月份感觉都在找工作了,没有更新知乎,分享给大家一个网站,可以查医疗器械相关标准,可以免费下载的。放在下面,预计5月4入职,祝我一切顺利,昨天我妈给我视频电话了,说我这次不能再反反复复,换工作了,必须坚持到底,说我好吃懒做,去哪能做好,这次就必须踏实,努力,给公司创造价值,给领导瞻前马后,
说还不知道我,在和家里一样懒得,回家行李箱开的就放到地上,我看抖音大家都是行李箱开着不关,还说这样下去,哪个公司要我了,说我是去干活的,坐的啥也不干就能挣钱了?别挑来挑去,最后北京公司都让我面完了也没个去处。
接受她的建议,这次我要坚持3年。家人们。
想了解国内最新标准,或者现行标准的小白们,工标网就是非常适合的网站。百度直接搜索工标网。
下面是免费下载国内标准的网站
GB/T 191-2008 包装储运图示标志_下载地址列表_UPBZ免费标准下载网-www.upbz.net现在工作已定,我要继续更新知乎,在职场,时尚,日志等,继续创作,之前也挣了几千米了,继续努力。早日实现财富自由,大家有想了解的医疗器械注册,或者医疗器械行业,知乎等也可以留言。
2023.4.21日更新
最近我每天都会去1-2个公司,海淀,顺义等,面了北京三和百特科技有限公司,北京翼美云动光电,给艾柯医疗,也投了简历电话沟通,等,也包括一些三方咨询公司,CRO
最终确定了一家在丰台办公的公司,岗位就是注册专员。为了奖励自己,买了一个火龙果,黄桃,樱桃, 樱桃最贵,几个就30块钱,火龙果和黄桃才17米。新公司的转正的必要条件就是,欧盟注册,或者中东,东南,完成一个国际注册资料的提交,才能转正,我还没有递交过国际医疗器械注册资料。还是很有挑战的。不知道我在3个月试用期能否完成。
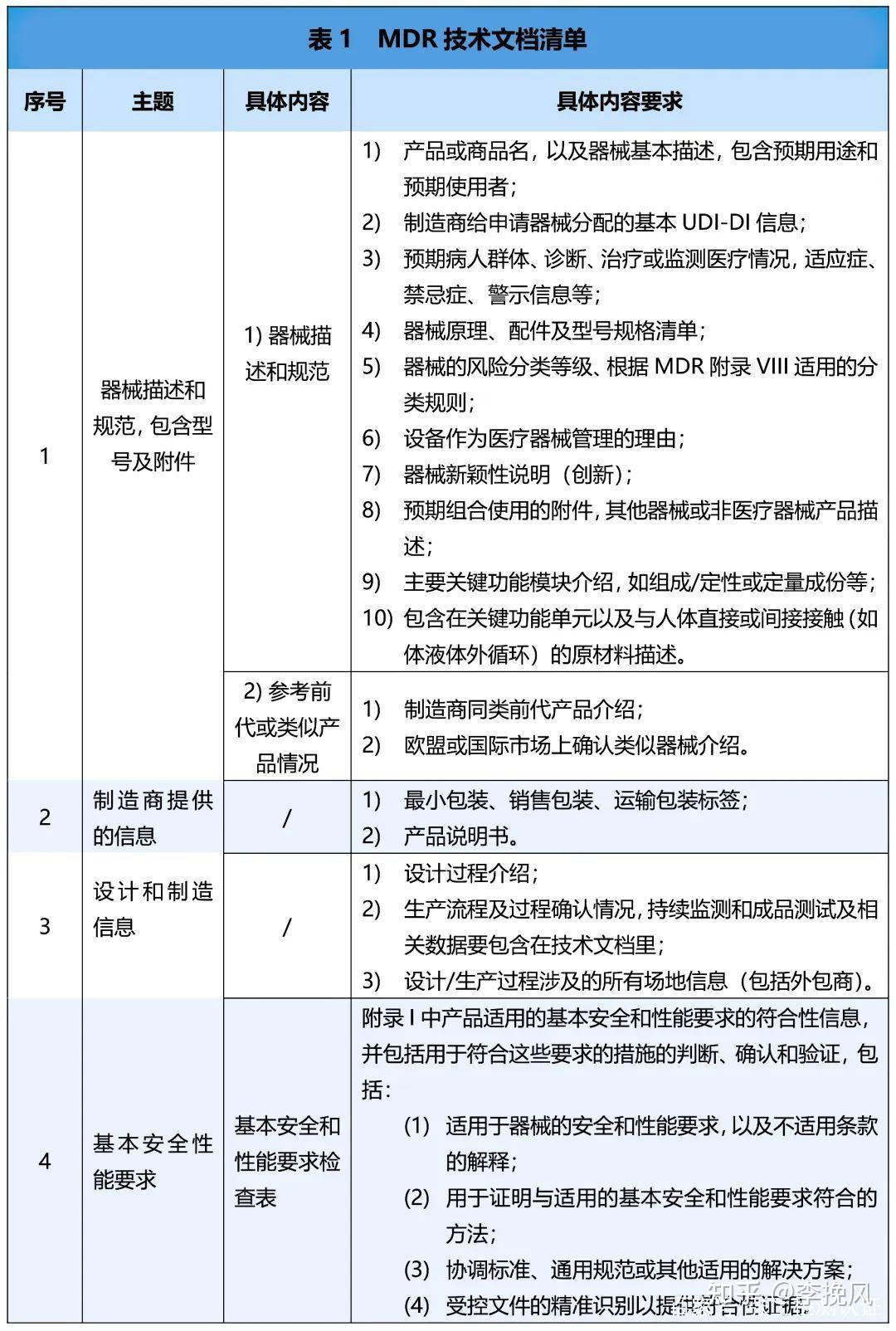
顺带分享给大家欧盟MDR技术文件清单,FDA递交文件清单,在文章最后。
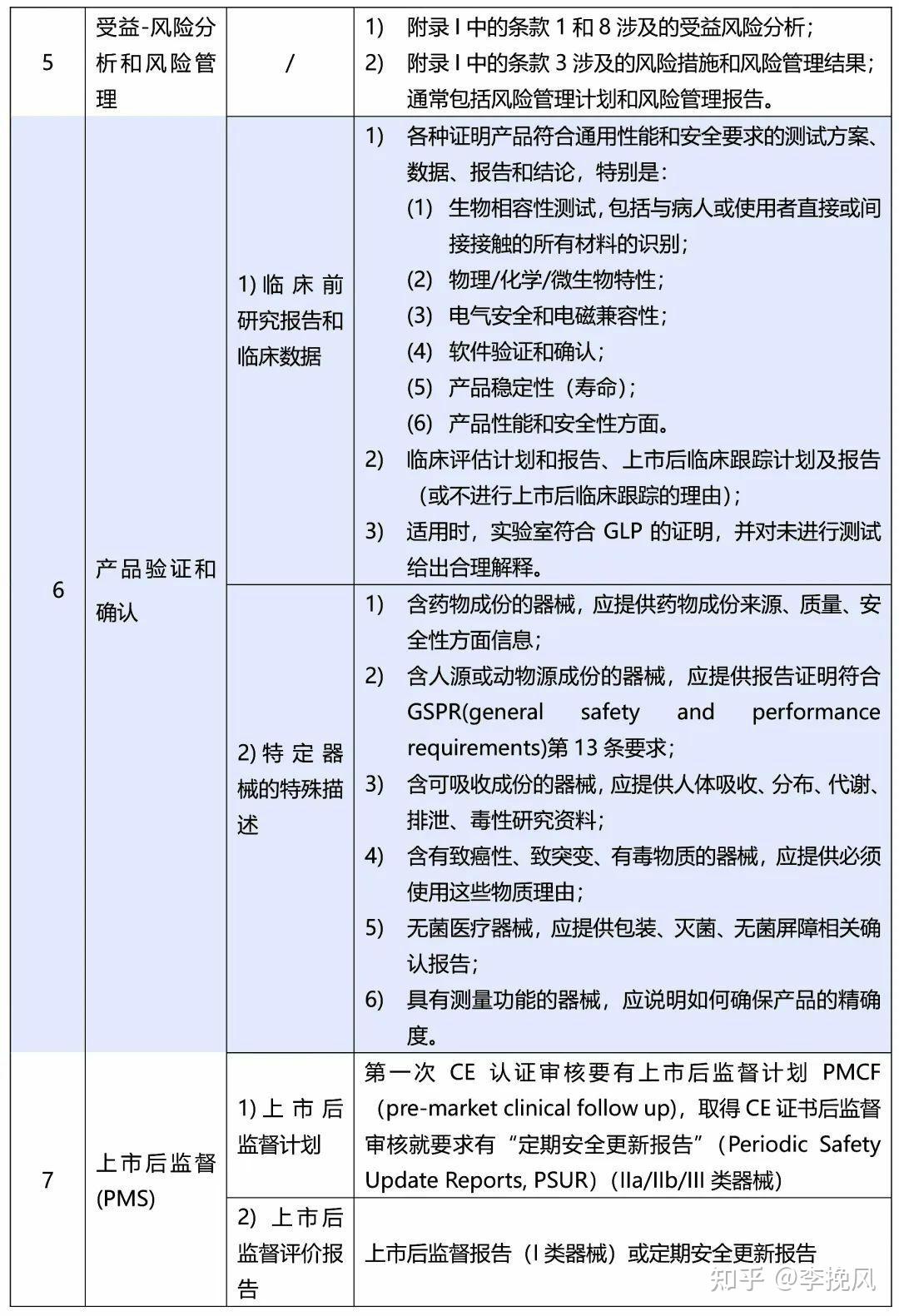
2023.3月23日
目前在找新的注册工作,有工作推荐的小伙伴吗?
昨天面试了一个公司,岗位类似研发支持,结合法规,又要懂法规,体系,又要懂产品,结合法规输出产品的设计开发文件,主要欧盟MDR.感觉能学到不少,也很有技术性,同时要学绘图,这边不用solidworks,用proE,creo来这我又能多学一款软件,顺便提升英语,考个雅思,
唯一美中不足的是,单休,社保公基金基数偏低,呜呜呜呜呜呜呜呜,哎。
顺便说下什么是MDD转MDR,
MDD:medical device directive 医疗器械指令
MDR : medical device regulation 医疗器械法规
那MDD转MDR就是指令变成法规,欧盟对医疗器械的安全有效监管更加严格了
更新下:最近找到一份新工作,但是有一些离谱,法定节假日不休息,过年多放几天,周六日正常休,7月有暑假,说是主要国外,欧盟还有其它国家所以节假日不休息,我之前的公司,我妹的公司也是和国外合作的呀。法定节假日还是休息的。
我觉得这是老板压榨员工的一种方式可能,一种不太认同的企业文化,但是我是准备去学习,去积累,去沉淀的,这些我暂时先忍了。
更新了,根据我的侦查,暗访,新公司2022的团建是去环球影城,我2023去的团建会是什么呢?
晚上11点种,我的大学同学开心的告诉我生了,生了,考上研究生了(北京211.985),ok,你去吃学习的苦,我去吃工作的苦。让我们苦尽甘来
我已收到邮件offer 如下,这个工作内容不是我想做的,我还会重新投简历,面试注册岗位。

在找工作的2023届毕业生们:继续加油 ,心情不好可以吃个火龙果,我比较喜欢吃白果。像吃西瓜 一样,用勺子挖着吃。

坚持,又活了一天,不容易,清明节我还在上班。上班就熟悉产品,看看法规,感觉好无聊,陌生的环境。不知道该怎么和大家交流,不交流了,
原回答:
建了两个目录看过2022年的原回答,可以直接跳过点2023年开工大吉。更多精彩内容不断更新,有想了解,想学习可在评论区留言或私信。工科毕业生,英语专业,医学,材料,等都可以做的工作。
2023开工大吉
徐福记酥心糖,
2022原回答:
2021年进入医疗器械行业,开始慢慢了解,当时进入的部门是研发部,研发部里的注册组,当时不明白啥是注册,也没关注,就开始做注册需要的工作,资料整理,因为工科专业,会CAD,solid works画图,所以注册资料里的示意图,三维图,效果图,力学试验工装都是自己画,个人能力不错,资料也写得可以,目前工资8700,前几天有面试个小公司,给9500,全额缴纳五险一金,包中午饭或者给餐补,但是我懒得折腾,想着先在现在这个公司干着。
公司不管吃住,有15餐补,在北京租房,吃饭是比较贵的。有时候会看一些公司,好多公司不了解,不知道工作情况具体怎样。
一般注册都是不会画图的吧,学医或者药或者别的专业,有些工科专业也做注册,还是公司部门职责划分,注册主要是按照国家药监局注册目录把资料整理出来,提交给官方,这个资料太多了,涉及的范围很广,这个是注册的中期工作,
前期应该是产品技术要求,注册计划的制定,还有送检产品,联系送检,做力学试验了,生物学试验了,这个工作看公司的安排,平常咋划分,研发也是同时参与的,技术要求是研发定,技术要求包括产品的名称,示意图,规格,性能,配合性能,机械性能,
送检,北京的检测所,天津的检测所,等,
国家药监局注册目录,三类就是人体植入的6章资料,每章又分为好多节,有些人没有耐心,不细心,特别烦整理文件资料,做注册的女生好像偏多,女生可能细心,临床评价写100多页WORD,和写论文是的,查文献,挺麻烦的。
注册第一次提交资料,国家药监局老师看了,提出问题,进行补充修改,这个习惯叫补正,补正成功,受理了,就得给国家药监局缴费,一个三类的大概15万。
受理了没完,体系考核,简称GMP,国家药监局老师来公司现场审核,要看设计开发文件,设计开发文件也是像本厚书一样,设计输入,输出,验证,风险分析,意思,证明公司为啥做这个产品,公司能做好这个产品,一堆验证,清洗了,包装,加工了,工艺了,太多了,设计开发文件应该是研发负责,可能有的公司注册也同时负责,还要现场答辩,给老师讲产品,回答老师的问题,好像是开15个不合格,答辩不过,就和毕业一样的感觉,比做毕业论文还累,也看个人能力,总有些学霸。
体系过了,还要审核,国家药监局老师,哎就是玩,再看第一次提交的注册资料,这回细看,产品的这个关键尺寸没有,力学试验不充分,生物学没有提供资质,阳极氧化工业验证,等,每个老师提到问题,都可能有差异,
我个人觉得,和老师专业和出身可能也有关系,工科的老师,注重产品的多角度三维图,二维图,器械原理描述,生物医学的老师可能在表面处理呀,生物学呀,研究上要更多的验证资料,太难了,2022年之后,总的来说,注册专员更加专业,老师也更加专业,审核也越来越严格
过了这次补正,这个习惯叫发补,就可以拿证了,注册证感觉就像产品的合格证,然后公司就可以卖这个产品,上市了。整个过程还是挺麻烦的,
本人也是小白,刚开始,欢迎一起交流
——————分割线————————
2022年9月15日,今天来学习下医疗器械软件注册,
分类:医疗器械软件包括本身即为医疗器械的软件或者医疗器械内含的软件,前者即医疗器械独立软件(简称独立软件),后者即医疗器械软件组件(简称软件组件),那有源器械里很多医疗器械需要软件组件,列如呼吸机。通过下面的医疗器械软件分类图示,就能更清楚了
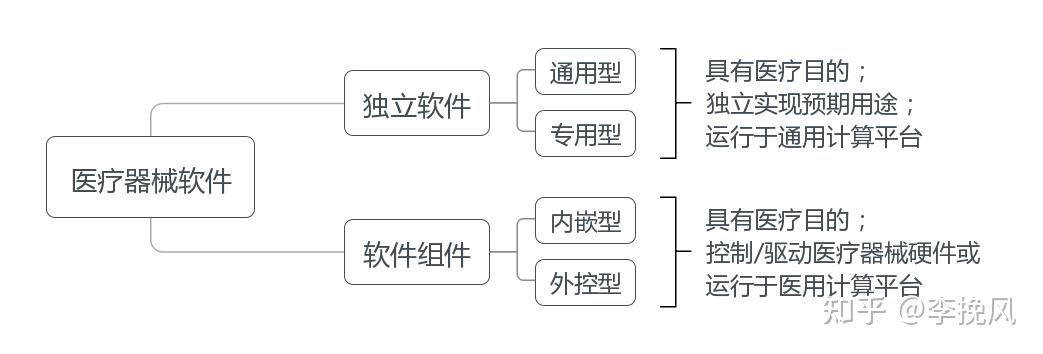
独立软件可分为通用型独立软件和专用型独立软件,前者通常基于通用数据接口与多个医疗器械联合使用,如医学图像处理软件、患者监护软件;后者基于通用、专用数据接口与特定医疗器械联合使用,可视为医疗器械附件,如动态心电数据分析软件、眼科显微镜图像处理软件。
软件组件(SiMD)是指具有一个或多个医疗目的/用途,控制/驱动医疗器械硬件或运行于医用计算平台的软件。医用计算平台满足医用电气设备(GB 9706系列)、实验室用电气设备(GB 4793系列)或有源植入式医疗器械(GB 16174系列)等安全要求(含电磁兼容);医用计算平台可与通用计算平台联合使用构成系统,整体视为医用计算平台。
2022年9月20日,今天学习医美产品注册
产品注册申报思路:方法:查阅相关企业申报透明质酸钠类面部注射产品标准,对所需资料进行总结。结果:企业申报透明质酸钠类面部注射产品注册时主要涉及以下方面:产品名称确定、注册单元划分、注册申请表填写、产品技术资料提供、注册产品标准制订、说明书制订等。结论:透明质酸钠类面部注射产品注册申报的难点在于产品技术资料中研究性资料的提供,因此需要企业加强基础研究能力,制订科学的工艺路线和技术指标,以确保产品的安全性和有效性,同时也为注册申报提供充分的支持性数据。
-----------分割线-----------
2022年11月18日 今天学习学习新国标《GB/T 42062-2022 医疗器械风险管理对医疗器械的应用》与0316-2016 旧版做对比。对应国外ISO TR 24971-2020.感觉很复杂,很多,文字的解读学习。
2022年12月5日更新
最近工作安排,CE欧盟注册,呼吸机欧洲临床评价计划编写,欧洲临床评价报告编写,在搜集文献这块,需要在PUBMED检索英文文献,不知道该如何检索,看了检索方案,也还是感觉无从下手,制定关键词,在思考中,又开始重新细读产品综述资料。网上搜呼吸机资料,来了解产品,来确定搜集什么样的文献合适。根据循证医学文献检索格式,PICO,为population(患者对象),interventions(干预),comparisons(对照),outcomes(结果)来制订关键词。

如果有医疗器械注册问题可以咨询我。欢迎欢迎
2023年了,更新了,为了同时可以学习英语,用英语更新了。希望对提高英语也有点帮助。还有年终汇报,领导评价不好,被advice.了,也谈话了。评价绩效不佳,我decide,要卷起来。
Today is January 2023.I have been working in the new company for five months.
See the top article on my home page about how I get into the medical device registry.
The company is engaged in consulting services for medical device registration regulations.
My position is registration officer.
Salary 11000 yuan
I did not become a full member in 2022.
So there is no salary of 13 years and year-end bonus.
The recent year-end report is not good.The boss and the leader gave advice.Rating 61.7
Performance does not, none of the projects are scheduled。 I did some assistant work, ran errands, changed water, and finally gave me such a low score.
Very unhappy.Recently, I think I should start studying hard, learning English and rolling up.
Scare them to death.
————————分割线————————
2023.1.16
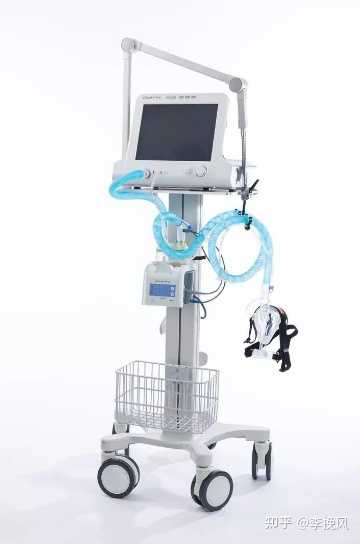
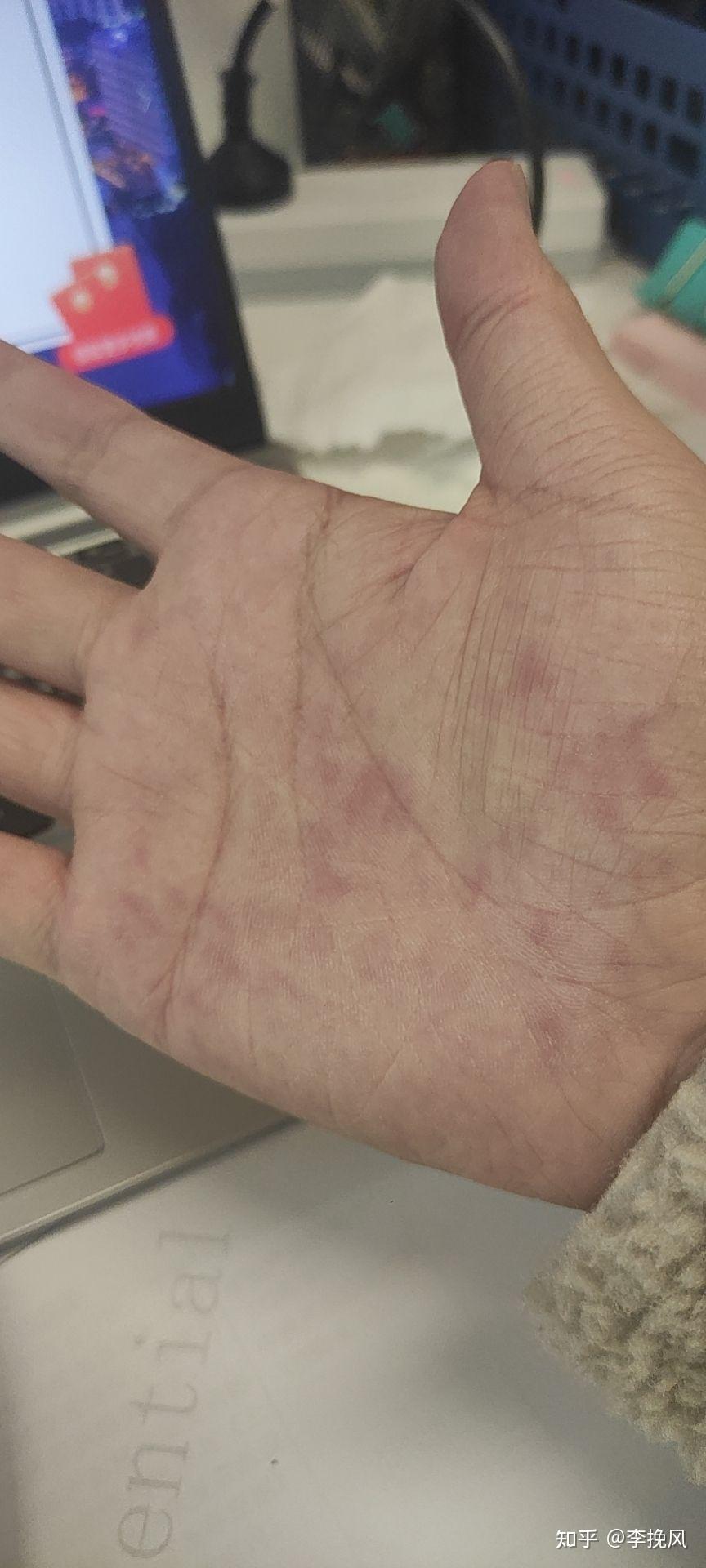
今天上午去北检所拆呼吸机,检测完了,给客户邮寄回去,呼吸机的底座挺沉,中间的支架,还有显示器,拿改锥,扳手,拆了一上午,包好。中午弄完了,出了一身汗。呼吸机大概就是下面这样。手都红了,扳手,轮子很难拆
6角扳手弄的手掌很多红点
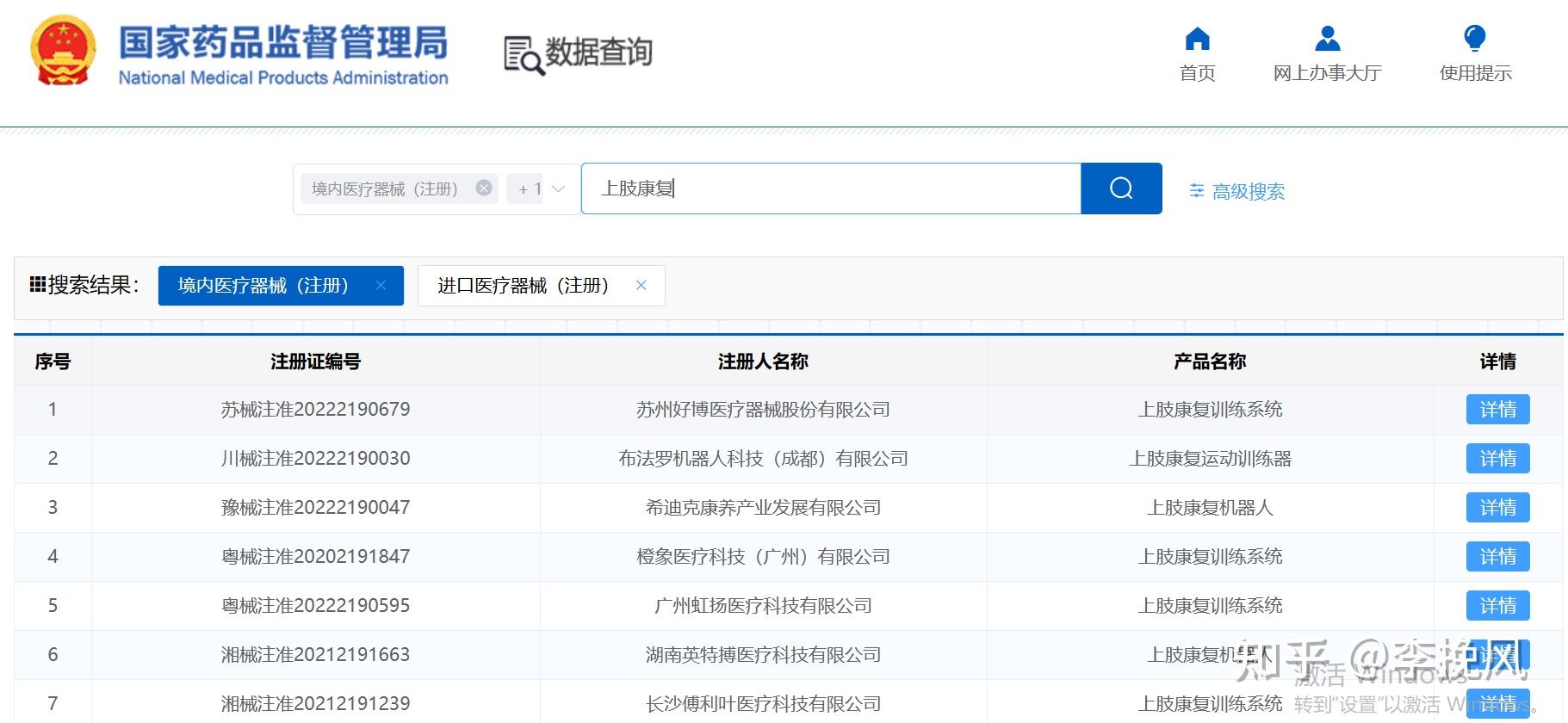
下午回来开始写整理产品资料,上肢康复系统产品与同品种产品对比表。之前有个同学问我上肢康复机器人怎么设计建模相关的图纸问题,最近正好学习这种产品,之前他给我看的更偏向于护甲,像人的衣服一样,穿戴上去,如下图,

而实际的上肢康复机器人是这样的,其实做毕设想想快速了解自己设计的产品,可以通过文献,和一些医疗器械公司已经做出来的产品。我在国家药监局官网查了,国家批准的上肢康复机器人有几十个厂家。
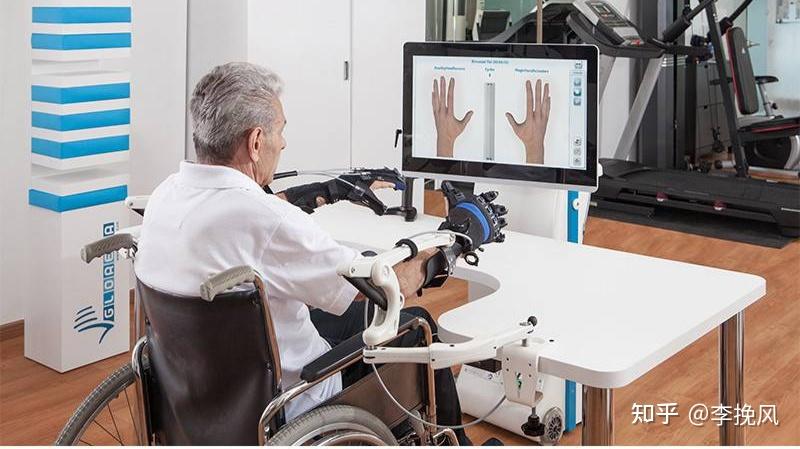
实际的上肢康复机器人是这样的:上肢康复训练系统由训练系统和主控系统两部分组成,两部分之间通过线缆相连。其中训练系统包括操作台、升降柱、连杆、伺服电机和配件,配件主要针对终端固定形式,有抓握固定和分指固定;主控系统包括显示器、电源、控制主机和软件。
有个显示器,现在高级的就是类似玩游戏,通过控制手柄捉蝴蝶等游戏来恢复患者的上肢功能。上肢康复机器人用于脑卒中,脑外伤,脑中风,偏瘫导致的上肢功能障碍。
2023开工大吉
多图预警,滴滴滴滴滴

兔子

兔子

前途似锦
2023.2.2更新了————————
在做医疗器械产品欧盟注册时,记住罗马数字,并发现规律,对于看国外文件与法规时,就会非常方便,你就很清楚的知道哪个章节,哪个附录,第几条。
欧盟法规红封面书,很适合新人用来学习工作,不懂就翻。技术文件,分类规则,临床评价,可在拼多多购买,CE.欧盟注册人必备。
书中目录,中文翻译版
2023.2.7更新:
最近在看欧盟:MDD转MDR下的医疗器械对CEP和CER.和PMS等发布问题,公告机构为TUV南德,发布提出的问题非常细致。涉及到很多方面。产品描述,预期用途,预期人群的明确,文献检索的方案,文献的定的基准,治疗的阈值,产品的对比等可用性,是否设计变更是创新点,。需要符合欧盟指南文件,MDCG相关指南
总而言之,比国内的临床评价内容多,细节多,还有,法规要求多。
最近TUV.南德对提交的资料提出了临床开发计划的问题,需要学习一下,MDCG.2020-3看下,培训视频,关于临床开发的相关问题。
后续国际注册相关会在下面链接更新,国内注册在本片文章更新:
为什么网上关于国际注册的招聘信息很少,这个行业的前景怎么样?2023年,2月15日更新——————
最近安排整理协助 核磁共振术中成像 项目资料准备,
- CH2 预期用途,包装,使用环境,翻译整理了下。
- CH3非临床资料,从风险管理计划开始。
2023.2.23,初步了解了术中核磁共振医疗器械的组成和原理,最近在看验证资料,
软件要求挺多,我听的中关村水木医疗讲的软件需求规格书,网络安全,可追溯,讲的很生动。想学习软件注册资料的可以问我,我把课程录下来了。看视频,同时结合:
- 医疗器械审评中心发的医疗器械软件注册审查指导原则。
- 医疗器械网络安全注册审查指导原则
——————更新了——————
2023.3.3
今天在福州开始了第十三届中国医疗器械监督管理国际会议。好多分会场,有医美,生物学,等
都是专家大咖分享经验。收货多多
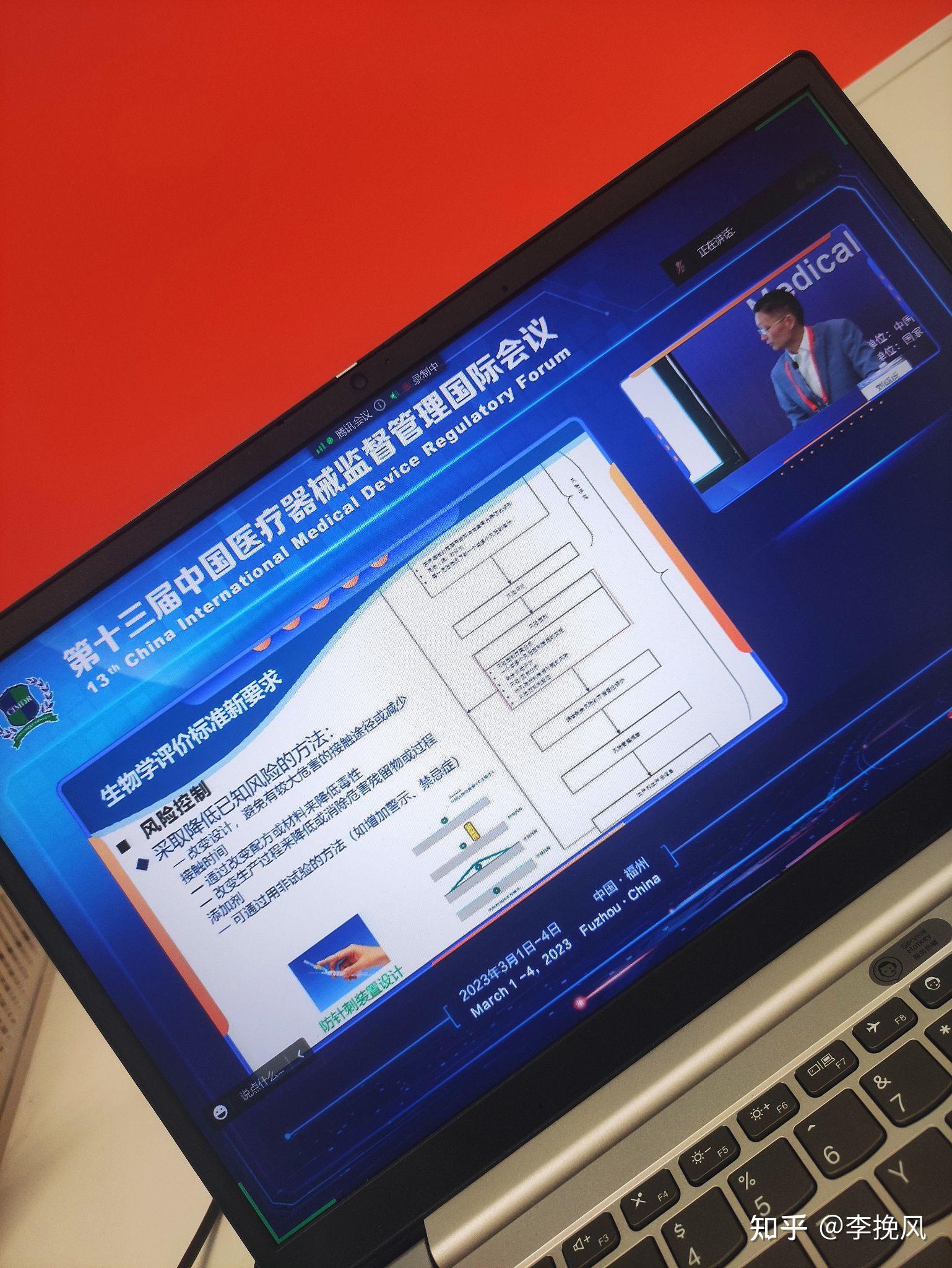
2023.3.7更新
今天遇到一个难题,就是进口医疗器械的UDI码是否要在GS1备案,是必须的吗,GS1客服说备案就要给钱,成为系统成员,2800元,开通国内UDI每年9000。美国已经开通了GS1的UDI,国内任然要交钱。说国内外UDI机制不一样。要转换。
单纯只是注册提交,不考虑后期流通等上市追溯问题,说是美国出一个符合国家药监局的UDI码就可以,但是我又不清楚具体操作,对UDI是陌生的,企业也没有做过培训,这一块非常头疼。
听了UDI老师说的也是云里雾里,一天过去了,欧洲临床评价也没写,注册资料也没更新。
下班了,打了几个气球,明天3月8日,做了一个简单的装饰,明天早点早点来,给大家送礼物 。
再也不想思考UDI了

3月8日,送花,女神节
2023.3.15
今天悲伤的一天,惹领导不高兴了,领导发邮件,很紧急的事情,我看了邮件,没有准备,没有行动,直到第二天,领导打电话问,
然后赶快更新了,磁共振的技术要求和EMC检测合同,申请表,第二天给领导了,发检测所了,心惊胆战的一天。
明天任务,和大家一起审核超声软组织切割设备。
2023.4.13 更新
FDA注册递交文件清单,我简单翻译了下,分享下,递交原文指导文件可在FDA官网下载。最近要开始做FDA注册的后勤工作,体系技术文件,设计开发文件,等,暂时可能做不了注册的工作了。先根据领导安排,熟悉,了解产品。

最近收集了些标准:
- IEC 61058-1-2016 电器开关第1部分,一般要求。
- ISO 15233-1 2021 医疗器械制造商提供最新信息的符号
- ISO 15233-1 2016对应国内翻译版本
- GB T 191-2008包装储运图示标志
- YY T 0316-2016 医疗器械 风险管理对医疗器械的应用
- YY T 1474 2016 可用性工程对医疗器械的应用
- FDA II类特殊控制指导 美容用低强度激光系统
- FDA II 类特殊控制指导文件 美容接触式冷却系统
|
|
 /3
/3 