虽然医疗器械注册相关流程在各省局办事指南都能查阅,但有时候为了更方便,总想有一份全面的流程图在手上,所以,笔者就简单整理了这份流程图,以广东省食药监局办事指南的流程为例,罗列了首次注册、延续注册、变更事项流程,以及创新审批等流程。
本文还加入了全国最新收费标准、大概的法规法单及监管结构等内容,便于初入行者能更加快速了解医疗器械的监管要求。
因为涉及流程比较多,如有不对之处,切望各位留言指正!
01
法规监管结构
02
相关法规要求
不同的产品依据相关的标准、指导原则、法规要求进行。
03
二类医疗器械注册流程
时间预算(含审批):
产品立项至检测预计4-7个月左右,不含开发过程时间(并行)
如需临床预计6个月以上1年左右,视产品而定
申报注册全过程8个月(158工日,20工日/月,不计节假),体考时间(并行),不含整改、资料发布耗时。
大概乐观约计:不含临床约1年半左右,含临床1年半至3年左右,甚至更长。
04
三类医疗器械注册流程
时间预算(含审批):
产品立项至检测预计4-7个月左右,不含开发过程时间(并行)
如需临床预计6个月以上1年左右,视产品而定
申报注册全过程10个月(188工日,20工日/月,不计节假),体考时间(并行),不含整改、资料发布耗时
大概乐观约计:不含临床约1年半左右,含临床1年半至3年左右,甚至更长。
05
延续注册流程
06
注册变理流程
07
生产许可事项流程
08
登记事项流程
09
全国收费标准
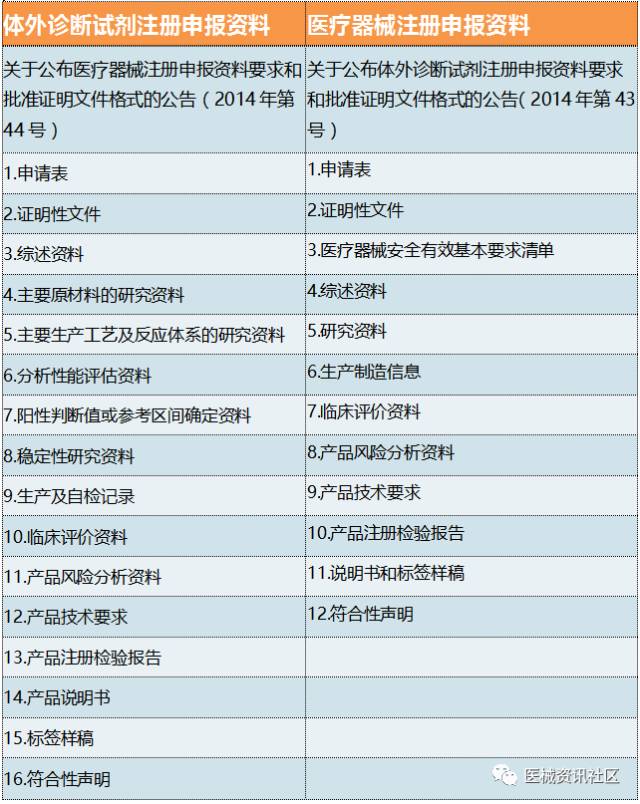
10
注册资料说明
11
分类界定流程
网址:http://www.nicpbp.org.cn/biaogzx
收费情况:免费
时限:省局、标管中心、国家局器械司分别消耗20工作日。短的20工作日能有结果,长的至少60工作日或以上
12
创新审批流程
收费情况:免费
时限:省局消耗35个工作日左右。国家局约50个工作日
相关法规:
13
创新审批与优先审批区别
14
CMDE技术审评中心组织架构
 /3
/3 