登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
MIT Technology Review杂志发布的2015年度十大突破技术(Breakthrough Technologies 2015)榜单上,与肿瘤个性化医疗密切相关的“液体活检(Liquid Biopsy)”名列其中。液体活检在转化医学研究是一个快速扩张的领域,对于癌症病人的个性化医疗过程的多个环节具有重要意义,可用于早期诊断、转移复发或进展的风险评估、疗效实时监测、用药靶点和耐药机制的鉴定,也有助于探明肿瘤在病人中的转移过程。几乎所有的体液都可用于液体活检,包括全血、血清、血浆、唾液、胸腔积水、腹水、脑脊液、尿液、眼泪、痰液等等,因此液体活检具有极大的临床应用范围和深远的意义。
众所周知,癌症与基因突变密切相关,通过分析与肿瘤相关遗传变异可为肿瘤的诊断、预后和治疗提供重要依据。随着“精准医疗(Precision Medicine)”概念的提出,肿瘤个体化诊疗已经成为业内的共识,基因检测也已在临床实践中得到普及。当前绝大对数实体肿瘤的遗传分析主要建立在通过外科手术或组织活检技术获得肿瘤组织样本基础上。然而由于其创伤性给病人带来的巨大痛苦,使得组织活检并不总是可执行的检测项目;某些肿瘤亦无法通过组织活检取样。此外,从单一组织活检中获得的信息仅反映某一空间和时间上肿瘤的状态,不能反映出肿瘤的异质性,大部分肿瘤患者初诊时获取的组织标本并不能实时反应现时的肿瘤生物学状态。因为在药物、环境等外部因素以及肿瘤高度异质性的内部因素影响下,肿瘤的基因组很可能处在不断变化之中,这样的以某个时间点肿瘤组织的基因状态来指导患者在其他时间点的治疗方案显然是很不合适的。但是肿瘤组织不同部位和治疗期连续取样组织活检更加不切实际。然而在肿瘤的个性化治疗期间,客观上又必须进行持续的动态检测,监测疾病进程,避免盲目用药,及时调整方案以使个体化治疗最优化,才能实现肿瘤从恶性并向慢性病治疗模式的转变。如何解决需求和技术之间的矛盾?
数十年来,科研人员一直都在努力寻找能够很好地反映肿瘤情况的生物标志物。1948年科学家们首次发现人体血液中存在着循环DNA(cfDNA)和RNA,且cfDNA含量水平在病人中相比健康人更高,预示着有可能通过对血样的分析来筛查疾病是否发生[1]。这是通向“液体活检”的里程碑事件。癌症患者的循环DNA则发现于1977年。在那之后又过了17年,人们才发现这些DNA含有癌症的标志性突变,说明它们来自于肿瘤组织。在肿瘤形成的超早期即启动期就会出现肿瘤细胞的坏死和凋亡,这些凋亡或坏死的肿瘤细胞会释放其DNA进入外周血形成游离的循环肿瘤DNA(ctDNA),因此通过分析循环血液中是否含有肿瘤特异的游离DNA可以达到肿瘤早期筛查的目的。事实上,特异性检测肿瘤来源的cfDNA含量水平,已被证明是与肿瘤负载之间相符的,能随治疗反应或在手术前后反生变化,还能反映耐药肿瘤细胞子群体在治疗过程中的增殖情况。ctDNA半衰期短,只有不到两小时,能更清晰的反映肿瘤的当前信息。血液中的循环肿瘤细胞(CTCs)也是癌症研究的一大热点。不过,检测ctDNA比检测循环肿瘤细胞更灵敏,cfDNA数量也更多,更适合作为癌症的分子生物标记。
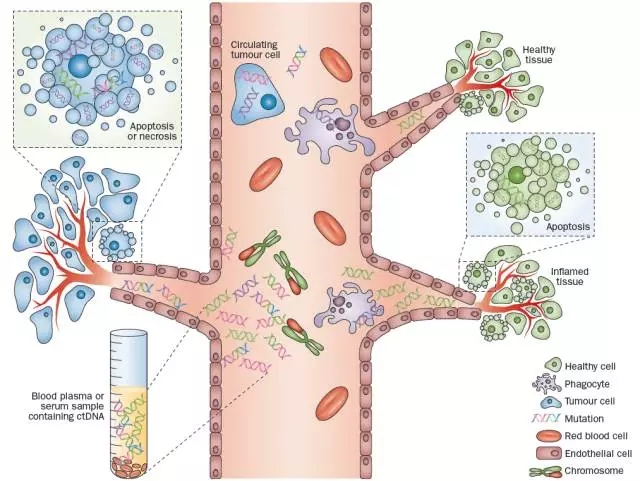
血液中cfDNA的释放和提取cfDNA可从健康组织、炎症组织或疾病(癌症)组织中的细胞通过凋亡或坏死而释放到血液循环中去。cfDNA可从血样中提取,并定量检测肿瘤组织释放的游离肿瘤DNA中携带的遗传变异。可被检测的来源于肿瘤组织的遗传变异包括点突变(连续的紫色、红色和蓝色DNA链)、拷贝数变异(染色体红色部分)和染色体结构重排(绿色和红色DNA链) Crowley, E. et al. Nat. Rev. Clin. Oncol. advance online publication 9 July 2013.
尽管ctDNA是极具前景的研究领域,但要成功将液体活检应用于临床实践,还必须克服诸多挑战。首先ctDNA呈高度片段化,按核小体单位随机断裂,其长度最长一般不超过180bp;突变的DNA占总的cfDNA比例极低,且湮没在有高丰度野生型DNA背景中,特别是单碱基突变DNA与野生型DNA仅相差一个碱基,现有检测手段(如NGS,qPCR,直接测序和焦磷酸测序)的灵敏度往往不够。各种前期研究结果表明,与组织活检相比,使用传统技术手段的液态活检的灵敏度在43%~66%之间。
微滴式数字PCR技术似乎是液体活检“天然的”配套技术。QX200微滴式数字PCR通过对样本的微滴化处理,能在每个微滴中有效的降低正常体细胞DNA背景的干扰,不仅能实现对肿瘤标记物的有效检测(灵敏度可达0.001-0.0001%),还能定量监测突变频率变化,量化检测标准。目前已有大量文献和实例报道了ddPCR技术成功应用于EGFR、KARS、BRAF、PIK3CA、DNMT3A等各种涉癌基因突变检测以及癌症相关的基因拷贝数变化(如HER2基因扩增)的液体活检。利用超高灵敏度的ddPCR技术对外周血中肿瘤游离DNA进行检测,对肿瘤的发现要远早于影像学及其他蛋白或多糖类肿瘤标记物的检测手段。被检测者可在肿瘤形成的启动阶段或者出现获得性耐药前就采取相应的治疗措施或修改靶向用药方案,阻止和减缓肿瘤的恶化过程。
如何将ctDNA的“液体活检”应用于临床实践,还有需要进一步认真评估ctDNA标记物的检测结果与大样本临床数据、资料间的吻合程度,但是液态活检技术已经逐渐被临床医生所认可,同时研究人员也在不断的开展新的研究来推动基于ddPCRd 液体活检技术的发展和应用。展望未来,我们有理由相信基于ddPCR技术的ctDNA“液体活检”将进一步推动癌症个性化治疗的发展,参与实现“精准医疗”的理念。


晚期恶性肿瘤的ctDNA (A). 可检出ctDNA的肿瘤病人比例;(B). DNA突变片段的定量检测 Chetan Bettegowda et al. Sci Transl Med 6, 224ra24 (2014)
Reference 1. Mandel, P. & Metais, P. Les acides nucleiques du plasma sanguin chez l’homme. C. R. Seances Soc. Biol. Fil. 142, 241–243 (1948).
2. Crowley, E. et al. Nat. Rev. Clin. Oncol. advance online publication 9 July 2013; doi:10.1038/nrclinonc.2013.110
3. Chetan Bettegowda et al.(2014) Detection of Circulating Tumor DNA in Early- and Late-Stage Human Malignancies. Sci Transl Med 6, 224ra24 (2014);
来源:昆明友宁
|  /3
/3 