登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
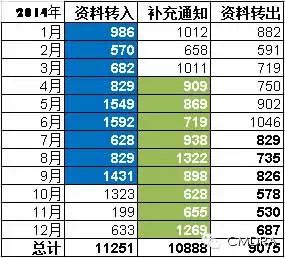
先来看看2014年全年医疗器械技术审评中心(CMDE)产品注册资料转入、发出补充资料及资料转出数据汇总。再听小编说说其中的门道~ 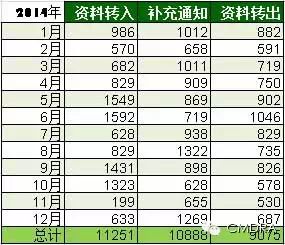
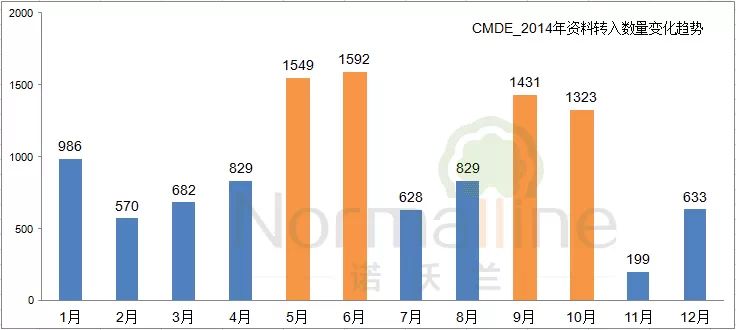
申请人坐了两轮过山车 资料转入数据体现的是境内第III类及进口产品的申报情况。从下图可以看出,去年5、6月及9、10月出现了两轮申请人集中递交资料的高峰。大家知道,这是由于6月1日《医疗器械监督管理条例》实施,10月1日《医疗器械注册管理办法》等多部规章集中实施导至的。而11月的数据则急转直下,掉到了199个,小编不得不感慨:2014真可谓“申请人的疯狂过山车”之年!
“一次性告知”的执行情况 相比申请人的大起大落,CMDE的审评工作则相对平稳。发出补充资料总量与资料转出总量之比为 1.2:1,这个指标可以反映技术审评补充资料阶段“一次告知需要补正的全部内容”的执行情况。 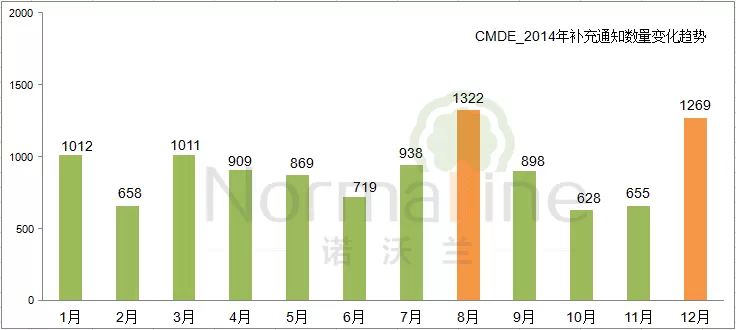
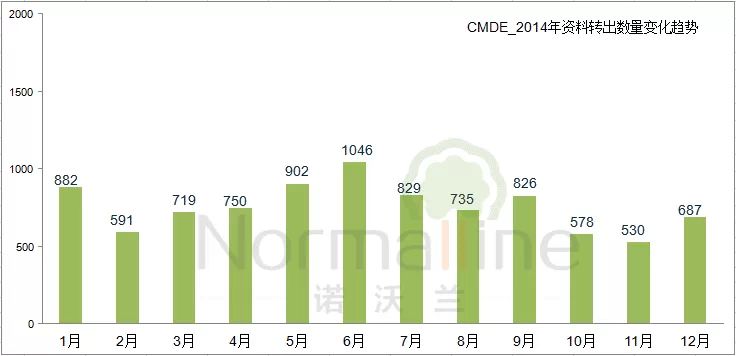
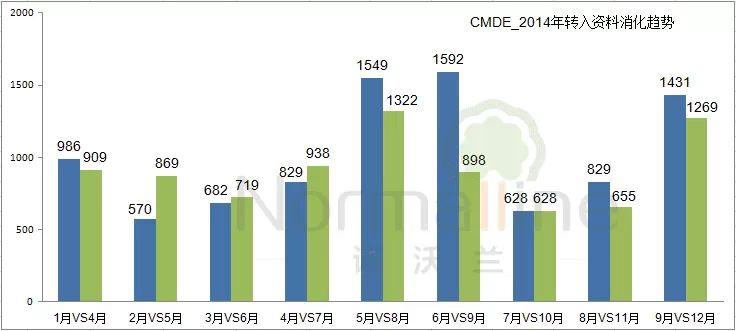
审评中心的“资料消化”情况 由于首次技术审评时限为3个月(10月1日之后第III类产品的首轮技术审评时限为4.5个月)。我们在查看审评中心对于资料的“消化”进度时,可以将当月的转入数据对应3个月后的补充资料数据,便可发现两者浮动趋势相近。详情如下:
来源:CMDRA
|  /3
/3 