2024年由安徽省、天津市、河北省、山西省、内蒙古自治区、辽宁省、吉林省、黑龙江省、上海市、福建省、江西省、河南省、湖北省、湖南省、广西壮族自治区、海南省、重庆市、四川省、贵州省、云南省、西藏自治区、陕西省、甘肃省、青海省、宁夏回族自治区、新疆维吾尔自治区、新疆生产建设兵团 27 省(区、兵团)医疗保障局组成采购联盟。 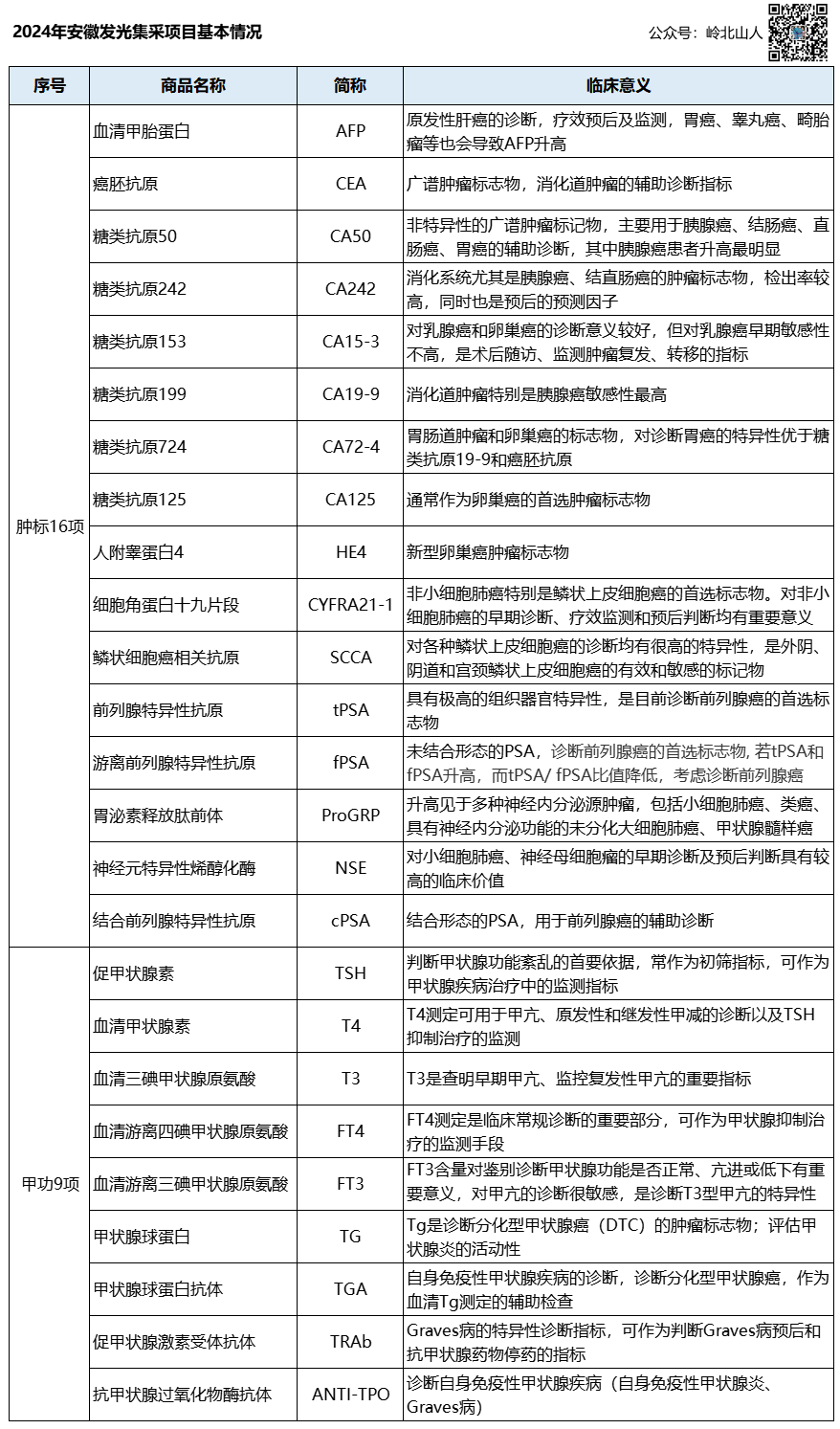 2024 体外诊断试剂省际联盟带量采购数据填报工作的通知 各联盟成员单位: 根据工作安排,现请各联盟成员单位协助组织辖区内相关医疗机构开展2024年体外诊断试剂历史采购数据和采购需求数据 填报工作,具体事项通知如下: 一、填报品种 (一)肿瘤标志物十六项检测。癌胚抗原( CEA )检测试剂盒、甲胎蛋白( AFP )检测试剂盒、鳞状细胞癌抗原( SCC 或 SCCA )检测试剂盒、总前列腺特异性抗原( TPSA )检测试剂盒、游离前列腺特异性抗原( FPSA )检测试剂盒、复合前列腺特异性抗原( CPSA )检测试剂盒、糖类抗原50(CA50)检测试剂盒、糖类抗原125(CA125)检测试剂盒、糖类抗原153(CA153)检测试剂盒、糖类抗原199(CA199)检测试剂盒、糖类抗原242(CA242)检测试剂盒、糖类抗原724(CA724)检测试剂盒、人附睾蛋白4 (HE4)检测试剂盒、胃泌素释放肽前体( proGRP )检测试剂盒、细胞角蛋白19片段(CYFRA21-1)检测试剂盒、神经元特异性烯醇化酶( NSE )检测试剂盒。肿瘤标志物检测集采产品的方法学包括化学发光法、流式荧光发光法、时间分辨免疫荧光法。 (二)甲状腺功能九项检测。三碘甲状原氨酸(T3)检测试剂盒、甲状腺素(T4)检测试剂盒、促甲状腺激素( TSH )检测 试剂盒、游离三碘甲状原氨酸(FT3)检测试剂盒、游离甲状腺素(FT4)检测试剂盒、甲状腺球蛋白( Tg )检测试剂盒、甲状腺球蛋白抗体( Anti - Tg )检测试剂盒、抗甲状腺过氧化物酶抗体( Anti - TPO )检测试剂盒、促甲状腺激素受体抗体( Trab )检测试剂盒。甲状腺功能检测集采产品的方法学为化学发光法。 (三)具体品种。明细见报量系统内数据。 二、填报单位 联盟地区所有公立医疗机构(含基层医疗机构卫生单位和军队医疗机构)均应参加本次体外诊断试剂省际联盟集中带量采购数据填报。医保定点社会办医疗机构按照联盟地区有关规定自愿参加。 三、填报内容 (一)历史采购数据。各填报单位统计汇总本单位2023年全年各个品种的采购价格(按人份填报)、采购数量(按人份填报)等信息。如同一个规格型号产品存在不同的采购价格,请填写最低采购价格。 (二)采购需求数据。各填报单位结合临床实际,预估本单位采购周期内未来一年的采购品种和采购需求数量(按人份填报) 四、报量系统和填报方式 本次报量工作通过安徽省医疗保障局省际联盟体外诊断试剂信息系统(登录地址:http://sjsb.ahyycg.cn/reporting-quantity)开展,具体操作方法见操作手册。医疗机构密码遗忘时,可联系所在地设区市医保部门重置密码。如需新增医疗机构账号,由省级医保部门增加账号。 五、填报时间 (一)医疗机构填报时间。2024年12月3日﹣12月11日。 (二)医保部门审核时间。市级医保部门需在12月12日前完成审核并提交省级医保部门,省级医保部门需在12月13日前 完成审核并提交至体外诊断试剂省际联盟采购办公室。 六、工作要求 请联盟各地区组织辖区内相关医疗机构认真做好数据填报工作,指定熟悉工作的专人按要求填报相关数据,确保填报数据准确无误、要素齐全。加强各级医保部门对辖区内医疗机构填报数据的审核力度,把好数据填报质量关。联盟各地区应要求相关医疗机构加强密码和账号管理,杜绝由他人利用医疗机构账号虚报、错报、改报采购量等问题,确保数据真实性。超过填报规定时间,原则上不接受填报数据改动。如确需勘误,须由省级医保部门审核盖章后报送体外诊断试剂省际联盟采购办公室。 系电话:0551-69029729 服务时间:工作日9:00-11:30,14:30-17:30。  |
 /3
/3 