| 2024年上半年获证IVD产品(三类首次获证产品)共计210款。其中境内产品197款,境外产品13款。试剂按预期用途统计,与致病性病原体抗原、抗体以及核酸等检测相关的试剂最多,占总数的54.76%,与肿瘤筛查/诊断/辅助诊断/分期相关的试剂位居第二。其中检测试剂共涉及16种技术方法,数量最多的为化学发光法,PCR类试剂紧随其后;按公司省份统计,获批数前三的为广东、江苏和北京;按获证月份统计,4月获批产品最多,2月和3月次之。 一、概况 体外诊断试剂在临床诊疗中具有重要价值,体外诊断试剂通过体外检测人体样本提供检测结果,用于单独或与其他信息共同辅助判断受试者的目标状态(健康状态、疾病状态、疾病进程或其他可用于指导临床处置的疾病/健康状态等),包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品,可以单独使用,也可以与仪器、器具、设备或者系统组合使用。 根据国家药品监督管理局发布的信息,截至2024年6月30日,2024年上半年获证IVD产品(该处获证为三类首次获证产品,下同)共计210款:197款为境内产品,13款为境外产品。见图1: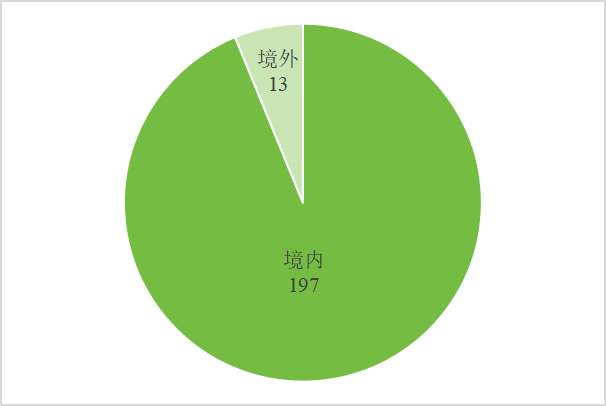 图1 2024年上半年获证IVD境内外分布 按产品预期用途排名,我们可以分为7类试剂和质控品/校准品。7类试剂分别为:与致病性病原体抗原、抗体以及核酸等检测相关的试剂;与血型、组织配型相关的试剂;与人类基因检测相关的试剂;与遗传性疾病相关的试剂;与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂;与治疗药物靶点检测相关的试剂和伴随诊断用试剂;与肿瘤筛查、诊断、辅助诊断、分期相关的试剂。 其中与致病性病原体抗原、抗体以及核酸等检测相关的试剂数量最多,有115款产品,占总数的54.76%;与肿瘤筛查/诊断/辅助诊断/分期相关的试剂数量次之,有28款;质控品/校准品类产品也占有一定的比例,位居第三。与2023年情况类似(参考:【336款】2023年IVD获批产品分析报告),具体数据见图2: 上述的210款IVD产品中包含188款试剂盒,共涉及了16种方法学,数量最多的为化学发光法,有60款产品,其次为PCR类。具体数据见图3: 近年来,化学发光免疫诊断作为体外诊断领域的重要细分,其市场规模庞大且持续增长,促使一系列的体外检测企业的快速成长。化学发光法具有极高的灵敏度和特异性。它能够检测到极低浓度的生物标志物,这对于早期疾病的发现和诊断至关重要,尤其在传染病、肿瘤标志物、激素等微量物质的检测中表现出色。 PCR技术在体外诊断领域也是非常重要的一种技术。PCR 技术具有高度的敏感性和特异性。它能够检测到极其微量的病原体核酸,并且能够准确地区分不同的病原体类型或亚型,为疾病的精准诊断提供了有力的支持。其适用范围也比较广,可用于检测细菌、病毒、真菌等多种病原体,无论是感染性疾病的诊断,还是遗传性疾病的筛查,PCR 技术都能发挥重要作用。 图3 2024年上半年获证体外诊断试剂产品技术/方法统计备注:1、有些试剂盒的方法原理可能一样,只是试剂盒中名称表述不一,上述分类可能会存在把其分在不同类别的情况(根据产品名称进行判断,会存在不足的地方);2、PCR类;为产品名称中含“PCR”的试剂盒,包含荧光PCR法、PCR荧光探针法、PCR-荧光染料法、荧光PCR熔解曲线法、PCR-反向点杂交法、数字PCR法和荧光PCR-酶切法等方法。从图4可以看出,4月获批产品最多,共44款,3月次之;5月获证产品最少。体外诊断试剂的审批涉及多个环节,包括技术审评、体系考核、行政审批等。不同月份的审批进度可能因各种因素(如项目难易程度、节假日、政策调整等)而有所变动,导至获批产品数量的波动。 产品省份/直辖市批准情况见图5,2024年上半年获批数前三的为广东、江苏和北京。与2022年分布情况大致相似【参考:【2022年度】377款IVD获批产品分析!】可能是因为这些地区经济与科技实力强大,政策支持良好,这几个地方产业聚集也比较也比较完善。随着时间的推移,其他地区可能也会加大对体外诊断试剂产业的投入和发展,未来的分布情况可能会发生变化。 图5 2024年上半年获证IVD产品省份/直辖市批准情况我们可以看到虽然2024上半年已有210个IVD产品获证,今年有望突破400个,成为历年最多,但是有很多产品都没走到获证这一步。据我们的过往 经验,一个IVD的产品,从立项到获证,大概只有34.1%的产品成功,仅仅超过1/3的比例,根据我们优咨康不完全统计的数据,2021年,共有651个IVD进行临床试验,2022年,共有721个IVD进行临床试验,总数很多,但最终很多项目都不会获得预期效果。【参考:65.9%的IVD,倒在了获证路上】 有一部分项目拿证了,也有一些项目因为各种原因被终止注册或不予注册,这可能是因为在研发或临床试验过程中发现了严重的问题,或者是因为技术性能未能达到预期标准。这些失败的案例虽然令人遗憾,但它们同样具有重要的价值。它们在提醒我们,在追求拿证的同时,必须始终坚守安全、有效、真实的原则,来确保试剂盒的准确性、可靠性和适用性。这些原则在研发、临床试验、以及生产等各个环节都至关重要,它们共同构成了保证试剂盒质量的基石。 临床试验作为产品注册过程的关键环节,存在一定的风险,为了确保大家可以更加科学的开展临床试验,优咨康将于2024年7月16日召开IVD临床试验合规研讨会【【会议通知】IVD临床试验合规研讨会】,我们计划给IVD领域相关企业分享临床试验阶段的注意事项,同时也邀请到了IVD临床试验的资深研究者,从他们的视角给大家分享一下相关经验,用真实的应用场景/案例去解读政策法规,以期帮助企业缩短产品临床试验时间,降低临床试验风险,加快产品上市。 1、与致病性病原体抗原、抗体以及核酸等检测相关的试剂 病原微生物是指可以侵犯人体,引起感染甚至传染病的微生物,或称病原体。病原体中,以细菌和病毒的危害性最大。病原体检测是医学领域中一项重要的诊断技术,目前,病原体检测技术已经得到了广泛的应用,并且随着技术的不断进步,其检测的准确性和可靠性也在不断提高。 2024年上半年获批的病原微生物检测相关试剂共有115款产品:114款境内产品,1款境外产品,产品详细信息见下表。我们将选取几个业内关注度高的审评报告与大家分享一下。 达安基因自主研发的“甲型流感病毒、乙型流感病毒和SARS-CoV-2核酸检测试剂盒(PCR-荧光探针法)”获得国家药监局批准上市,注册证编号:国械注准20243400754。同时药监局发布了该产品的审评报告。 该产品可辅助临床医生精准鉴别感染病原体,及时识别混合感染患者,有助于降低重症率和死亡率。【参考:【呼吸道三联检】审评报告公开】 国家药品监督管理局批准了厦门致善生物科技股份有限公司“结核分枝杆菌利福平及异烟肼耐药突变检测试剂盒(荧光PCR熔解曲线法)”产品注册申请,注册证编号:国械注准20243400763。同时药监局发布了该产品的审评报告。该产品采用自主专利技术——多色熔解曲线分析技术,痰液样本经提取获得核酸后即可上机检测,结果自动输出,能够为临床提供及时、准确的检测报告。因其便捷性及有效性,可广泛应用于各级医疗机构,为耐多药结核病(MDR-TB)、单耐异烟肼结核病(Hr-TB)的诊疗提供有力的支持,进一步强化耐药结核病的防治工作。【参考:【优先审批IVD】审评报告公开】 
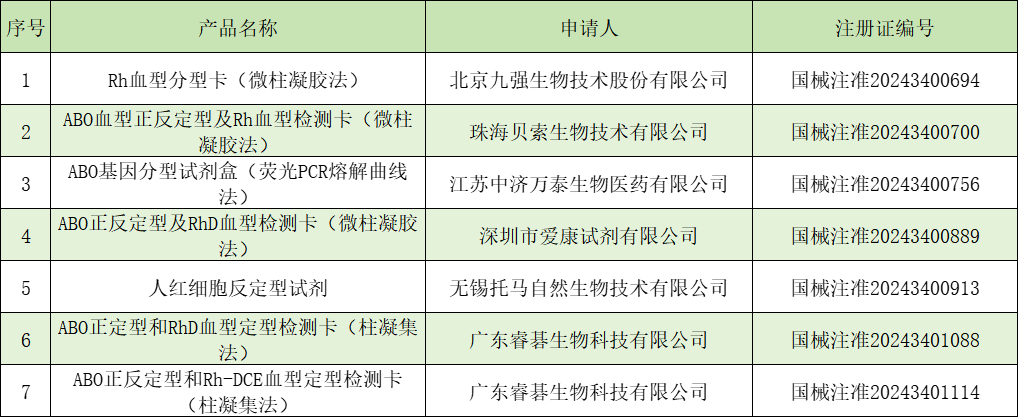
人类基因检测相关试剂主要用于检测人类基因组的变异、表达和调控等,是开展基因组学研究和临床诊断的重要工具。通过检测基因的突变、多态性等,可以在症状出现之前就发现潜在的疾病风险,实现早发现、早干预,显著提高治疗效果和患者生存率。还可以用于一些药物的指导。上半年人类基因检测相关试剂共有16款产品,详细信息见下表2。2024年4月30日,嘉检(广州)生物工程技术有限公司的“线粒体基因3243A>G突变检测试剂盒(荧光PCR法)”获得国家药监局批准上市,注册证编号:国械注准20243400884。器审中心公布了审评报告,该剂盒用于体外定性检测人口腔拭子样本中线粒体MT-TL1基因3243位点突变(m.3243A>G)。试剂盒用于线粒体脑肌病伴高乳酸血症和卒中样发作(mitochondrial encephalomyopathywith lactic acidosis and stroke-like episodes, MELAS)综合征的辅助诊断,其检测结果仅供临床参考,不能单独作为确诊或排除病例的依据,临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。【参考:【线粒体IVD】审评报告公开】遗传疾病检测相关试剂是指用于检测人类遗传疾病的体外诊断试剂。这些试剂通过检测个体的基因突变、染色体异常等情况,帮助医生对遗传疾病进行诊断、预测和预防。遗传疾病检测试剂的应用范围广泛,适用于新生儿筛查、儿童和成人遗传疾病的诊断和预测。通过早期发现和治疗遗传疾病,可以提高患者的生活质量和生存率,减少家庭和社会负担。此外,随着基因组学和分子诊断技术的发展,越来越多的新型遗传疾病检测试剂正在不断涌现。这些新型试剂能够检测更加复杂和罕见的遗传疾病,提供更加精准的诊断和预测。2024上半年获证的有12款与遗传性疾病相关的试剂,10款境内产品,2款境外产品,具体见下表3。我们将选取几个业内关注度高的审评报告与大家分享一下。2024年3月,北京华瑞康源生物科技发展有限公司取得了“FMR1 基因突变(CGG 重复数)检测试剂盒 (荧光 PCR 毛细电泳片段分析法)”药监局注册证书,同时药监局发布了该产品的审评报告。脆性X综合征(fragile X syndrome,FXS),是一种X-连锁遗传病,发病率仅次于唐氏综合征,是导至遗传性智力低下和孤独症谱系障碍最常见的单基因病,超过99%是由X染色体上的FMR1基因的CGG重复扩增和异常甲基化引起。【参考:【CMDE】脆性X综合征IVD审评报告发布】贝瑞基因“染色体拷贝数变异检测试剂盒(可逆末端终止测序法)”(国械注准20243400528)获国家药品监督管理局(NMPA)批准上市。药监局发布了该产品的审评报告。本试剂盒用于体外定性检测孕妇的羊水样本中第13号、18号、21号、性染色体的非整倍体,以及第15号染色体q11.2-q13区域、7号染色体q11.23区域的缺失情况,同时涵盖染色体非整倍体及多个CNV疾病,用于产前诊断。【参考:又一产前诊断IVD审评报告公开!】1月9日,国家药品监督管理局(NMPA)批准了安诺优达基因科技(北京)有限公司的“染色体非整倍体及基因微缺失检测试剂盒(可逆末端终止测序法)”(国械注准:20243400077)(下称“CNV-seq检测试剂盒”)上市。值得注意的是,这是NMPA批准的中国首个CNV-seq产品,可以同时检测羊水样本中染色体非整倍体及CNV变异,不仅为未来监管机构批准类似产品建立了标准,也提振了行业内对高通量测序技术(NGS技术)应用于产前诊断的信心,更标志着NGS技术在我国出生缺陷防控体系建设中又迈出了关键一步。【参考:又一IVD审评报告发布!】5、与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂麻精毒检测试剂是一种用于检测麻醉药品、精神药品和毒品的体外诊断试剂,如海洛因、可卡因、大麻、吗啡、可待因等。该类检测检测试剂主要采用免疫胶体金技术,通过抗体-抗原特异结合反应及免疫膜层析技术进行检测。上半年麻精毒检测相关试剂共有1款产品,本产品用于体外定性检测人体尿液样本中用于吗啡、甲基安非他明、氯胺酮、四氢大麻酚酸、亚甲二氧基甲基安非他明、美沙酮、可卡因的代谢物苯甲酰爱康宁、苯二氮䓬类药物、安非他明的初筛检测。详细信息见下表4:表4 与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂治疗药物靶点检测相关试剂是用于检测与药物作用相关的基因、蛋白质等的试剂,是开展药物研发和临床诊断的重要工具。该类试剂在体外诊断试剂领域占据着重要地位,它们对于提高治疗效率、确保用药安全以及推动精准医疗的发展具有不可替代的作用。治疗药物靶点检测相关试剂可以筛选出适合使用相应靶向药物治疗的患者,避免不必要的药物使用和医疗资源浪费;伴随诊断试剂可以帮助研究者快速筛选出对药物有反应的患者人群,提高临床试验的效率和成功率,加速药物的研发进程。上半年获证的有9款与治疗药物靶点检测相关的试剂和伴随诊断用试剂,具体见下表5:表5 与治疗药物靶点检测相关的试剂和伴随诊断用试剂近年来,肿瘤发病率持续上升,已经成为威胁人类健康的重要疾病。肿瘤的早期发现对于提高患者的生存率和生活质量至关重要。要做到早筛查、早发现、早治疗,会大大提高治疗成功的机会和患者的长期生存率;肿瘤诊断为医生提供准确的肿瘤相关分子标志物信息,帮助确定肿瘤的类型和亚型,为制定精准的治疗方案提供依据;通过检测肿瘤细胞的特定基因突变或蛋白质表达情况,判断肿瘤的恶性程度、侵袭性和转移潜能,帮助医生选择最合适的治疗方法;准确的肿瘤分期有助于制定个性化的治疗方案,评估治疗效果和预测患者的预后。2024年上半年获批的肿瘤筛查/诊断/辅助诊断/分期相关的试剂相关试剂共有28款产品:27款境内产品,1款境外产品,产品详细信息见下表6。我们将选取几个业内关注度高的审评报告与大家分享一下。上海鹍远健康科技有限公司的“人 Septin9、BCAT1、IKZF1、BCAN、VAV3 基因甲基化联合检测试剂盒(PCR-荧光探针法)”获得国家药监局批准上市,注册证编号:国械注准20243400902。该产品为基因数最多的结直肠癌甲基化IVD产品,从产品审评报告来分析,还是有很多值得参考的地方。例如,NGS首次作为临床检测性能方法(公开的数据),根据甲基化类产品的临床试验设计而言,临床检测性能是必须要进行的,从目前官方公布的14份甲基化产品审评报告分析(参考:【新增3项】甲基化检测试剂盒最新概览(3月7日版)),用NGS方法做为性能检测分析,还是首次,在所有的公开的IVD审评报告中,也是首次。以前是Sanger作为“金标准”,后续数字PCR打破了其“金标准”的垄断地位,本次审评报告又让大家在以后的临床试验中,多了一种选择:NGS。【参考:【5甲基化IVD】审评报告公开)】2024年4月3日,国家药品监督管理局批准了江苏先思达生物科技有限公司“寡糖链检测试剂盒(荧光毛细管电泳法)”创新产品注册申请,同时药监局发布了该产品的审评报告。该产品系我国自主研发,采用毛细管电泳法对人体血清样本中的9个寡糖链进行定性检测,用于临床上乙肝肝硬化患者原发性肝细胞癌的辅助诊断。该产品通过非侵入性检测方法辅助诊断,有助于原发性肝细胞癌防治。【参考:【创新IVD】审评报告公开】2024年4月,北京艾克伦医疗科技有限公司旗下新产品“艾为定”(Reprimo/TCF4/SDC2基因甲基化检测试剂盒(PCR-荧光探针法)),经国家药品监督管理局审批,获得国家药品监督管理局(NMPA)三类医疗器械注册证,医疗器械注册证号:国械注准20243400692。同时药监局发布了该产品的审评报告。该产品主要用于胃癌的辅助诊断,其临床特异性为92.07%,灵敏度为80.77%,总符合率为88.52%。上述临床试验结果使艾为定在胃癌基因甲基化检测领域中脱颖而出,突出了胃癌三基因联合检测在临床应用中的优势。【参考:【甲基化IVD】审评报告公开】校准品可以对检测结果进行定量并使结果具有溯源性,质控品可以保证检测结果的准确性。因此在体外诊断试剂产品中,校准品和质控品是必不可少的。2024年上半年获批的质控品/校准品共有22款产品:13款境内产品,9款境外产品,产品详细信息见下表7。以上数据为优咨康根据NMPA官方发布数据统计,可能有遗漏,欢迎大家补充,以上数据仅供参考。
|  /3
/3 