一、前言
验证和确认经常相提并论,因为两者常如影随形,形同相似,让人难分难解。验证的对象多于确认,验证的对象可以五花八门,包含物料、工艺、设备、方法等方面的验证,而确认主要用于设计确认、特殊过程确认、软件确认。从医疗器械国内外监管法规分析,国际标准的ISO13485、FDA的QSR820和中国的《医疗器械生产质量管理规范》(简称医疗器械GMP),三者在验证上的要求虽然描述不完全一致,但是实质要求是相同的,特别是在设计控制和生产控制方面。而采购、安装、服务、产品接收、纠正预防措施需要的验证在上述三者中描述差异较大些。以FDA的QSR820分析,验证和确认要求主要集中在设计控制阶段、生产控制阶段、原料/中间品/成品检验和验证、质量管理体系运行阶段。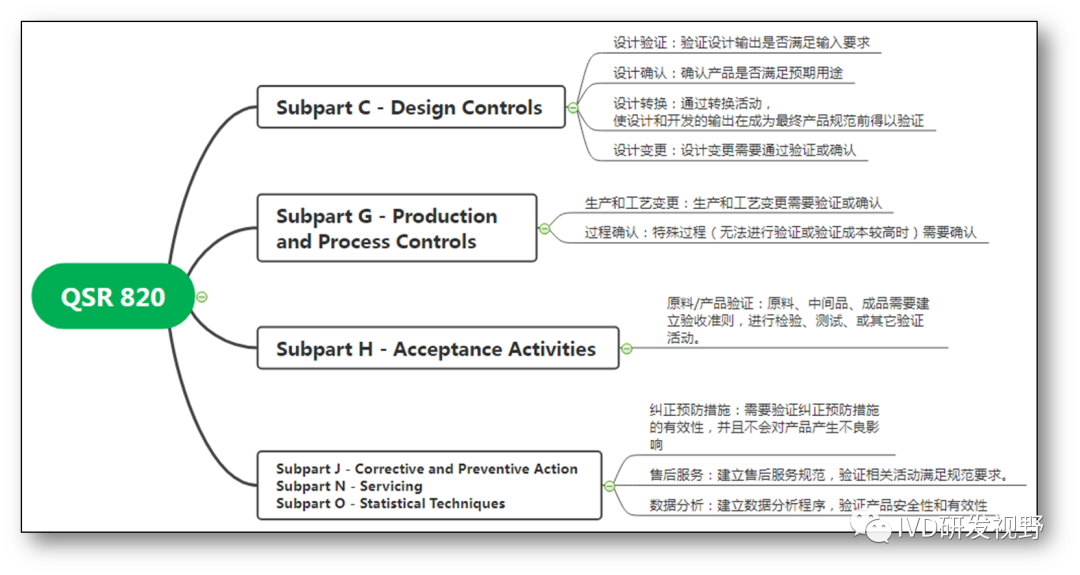
验证和确认的中文在实际生活上应用起来意思没有本质差别,验证和确认的英文拼写和意思也很相近。所以这两者的区分是个国际难题。在医疗器械行业关于验证和确认的规范中英文定义如下:(1)FDA的QSR820中关于验证和确认相关定义:(z)
Validation means confirmation by examination
and provision of objective evidence that the particular requirements for a
specific intended use can be consistently fulfilled. ①Process validation means establishing by objective
evidence that a process consistently produces a result or product meeting its
predetermined specifications. ②Design validation means establishing by objective
evidence that device specifications conform with user needs and intended use(s).
(aa)
Verification means confirmation by examination
and provision of objective evidence that specified requirements have been
fulfilled. (f) Design verification. Each manufacturer shall establish
and maintain procedures for verifying the device design. Design verification
shall confirm that the design output meets the design input requirements. The
results of the design verification, including identification of the design,
method(s), the date, and the individual(s) performing the verification, shall
be documented in the DHF.
验证:通过提供客观证据对规定要求已得到满足的认定。 确认:通过提供客观证据对特定的预期用途或者应用要求已得到满足的认定。 关键工序:指对产品质量起决定性作用的工序。 特殊过程:指通过检验和试验难以准确评定其质量的过程。
二、医疗器械相关法规对验证的要求

(2)《医疗器械生产质量管理规范》有8个章节和12个条款对验证作了规定。 
(3)《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》对GMP的要求进行了细化,在9个章节,总共24个条款中对验证作了要求。以下显示未直接在GMP中体现,新增细化条款要求。 
三、常见飞检不符合项
仅统计2016-2023历年飞行检查IVD企业中关于验证的不符合项,如果是无菌和植入器械,关于验证的缺陷项会更多,所有产品类别验证相关不符合项达到367条。按医疗器械GMP的章节进行统计分析,可以看出不符合项主要集中在设备、生产管理、设计开发章节。
按验证不符合的情况进行统计分析,可以看出不符合项主要集中在未做物料有效期验证、清洁消毒验证、设备验证方面。
以下是上述不符合项的具体内容。①原料、中间品等有效期未做验证。

③未做设备验证或验证参数不完整。 

④未做周期验证、缺少设计验证、验证规定参数与实际执行不一致。 
|  /3
/3 