1.样本涂片镜检:临床考虑侵袭性深部真菌感染采集的样本,均应进行直接涂片镜检(强,高)。直接涂片可评估样本质量,快速明确样本中是否存在真菌,尤其是对尚不能常规培养或常规生长极其缓慢的真菌,以及危重感染患者尤为重要。对于在组织样本中具有特征性形态(注意分隔、分支等)的真菌,直接涂片即可明确诊断。受制于样本中含菌量的多少和直接镜检敏感性等因素,检出真菌孢子或菌丝可明确表示样本中有真菌存在,但阴性并不能排除真菌感染。
直接涂片前应根据样本类型进行前处理以提高真菌检出阳性率(强,中)。脑脊液、胸腹腔积液、关节炎、BALF等液体性样本需浓缩离心后涂片;黏稠性痰液、脓液、胸腹腔积液等可采取酶液化后涂片;大体积的组织样本应多处取样,印片或剪碎组织压片;少量样本应床旁迅速压片以免干燥。
所有样本均推荐进行真菌免疫荧光染色,为提高真菌检出的阳性率和准确性,建议采用多种染色方法联合检查(强,高)。真菌免疫荧光染色几乎对所有的真菌均具有敏感度高、特异性强的特点;耶氏肺孢子菌感染的诊断宜用荧光染色与六胺银染色联合检测;隐球菌感染的诊断宜用荧光染色联合墨汁染色和革兰染色;毛霉目感染的诊断宜用荧光染色联合糖原染色。
直接镜检应仔细查找真菌孢子、菌丝和特殊结构[78, 79](强,中)。孢子可以从其形态、出芽与否及出芽方式,有无假菌丝、厚壁孢子、内生孢子、荚膜等特点来鉴别,菌丝可以从菌丝的大小、有无分隔、菌丝颜色等分辨。真菌特殊结构如颗粒、菌核、硬壳小体对于真菌诊断具有重要价值。推荐涂片镜检结果报告,应报告是否检出真菌,并详细描述镜检发现的真菌孢子形状、排列方式,以及菌丝的形态,仅报告真菌检出阳性或阴性是不够的(强,高)。酵母样、腊肠样孢子,内含孢子、厚荚膜圆形孢子等具有特征性的孢子;假菌丝,透明有隔菌丝,无隔飘带样毛霉目样菌丝,暗色菌丝等特征性菌丝——这些初步快速检测结果对于临床诊断方向具有重要参考价值。
2.培养:根据样本来源、可能的病原菌选择合适的培养基,建议实验室配备多种培养基,如不含细菌抑制剂(如氯霉素、放线菌酮等)和含细菌抑制剂的改良沙氏培养基、马铃薯葡萄糖琼脂、增菌培养基、念珠菌显色平板、真菌血培养瓶、常规细菌血培养瓶(弱,低)。进行正常无菌部位样本培养时,推荐同时使用不含细菌抑制剂的培养基和增菌培养基(强,低)。进行非无菌、非皮肤来源样本培养时,推荐同时使用含细菌抑制剂和不含细菌抑制剂的培养基、增菌培养基(强,低)。组织样本应剪碎后半埋在培养基中,不推荐用接种环进一步划线,怀疑组织胞浆菌感染时,推荐研磨组织;角膜分泌物推荐直接接种于培养基;无菌体液、BALF推荐离心取沉淀物接种(强,低)。
初始真菌培养推荐25~30 ℃孵育,保持足够的湿度,深部样本如活检组织、BALF、脑脊液等推荐35~37 ℃同时孵育;血培养瓶遵循说明书要求(强,低)。丝状真菌建议平板培养基孵育3周,怀疑双相真菌(如组织胞浆菌)感染建议延长至4~6周。血培养瓶培养2~4周(弱,低)。
3.传统鉴定方法和微生物质谱鉴定方法:传统鉴定方式对人员能力、检测体系和质量控制都有一定要求。实验室必须完成人员考核、能力验证,并常规进行质量控制(强,低)。对酵母型菌落和类酵母型菌落,推荐基于菌落形态、镜下形态、化学反应/同化反应、显色培养基(如CHROMagar念珠菌显色培养基)等方式,进行传统鉴定(强,中)。考虑念珠菌属以及其他酵母菌时,建议通过玉米-吐温琼脂上的菌落形态、厚壁孢子的产生与否、尿素酶试验、在含细菌抑制剂培养基上的生长能力、沙氏肉汤中的生长模式、对糖类的发酵同化作用等生长特性进行鉴定(弱,中)。
对丝状型菌落和双相真菌,建议以马铃薯葡萄糖培养基上的菌落形态、生长速度、产生的色素,镜检特征性孢子和菌丝为主要依据,初步判断丝状真菌的种属(弱,中)。镜检建议通过乳酸酚棉蓝染色或小培养法显微镜镜下观察菌丝分隔情况、颜色、形态、附着结构、产孢结构等(弱,低)。对于菌丝不分隔或很少分隔者,可根据菌落形态、产孢结构、假根等特征将其分为毛霉目(根霉属、毛霉属、根毛霉属、横梗霉属、共头霉属、小克银汉霉属)、虫霉目(耳霉属)、蛙粪霉目(蛙粪霉属)。对于菌丝分隔者,若菌丝为暗色,则需在离蠕孢属、枝孢霉属、德氏霉、链格孢霉属、外瓶霉属、瓶霉属、弯孢霉属间鉴别;若为透明菌丝,怀疑为丝状真菌,可根据顶囊、假头、孢子(产生方式、形态和排列状态)等特征进行曲霉属、镰刀霉属、枝顶孢霉属、拟青霉属、赛多孢属、木霉属、帚霉属间鉴别;怀疑为癣菌,则进行小孢子菌属、毛癣菌属、表皮癣菌属内鉴别;怀疑为双相真菌,则进行组织胞浆菌、粗球孢子菌属、皮炎芽生菌、副球孢子菌属、申克孢子丝菌、马尔尼菲篮状菌的鉴别。
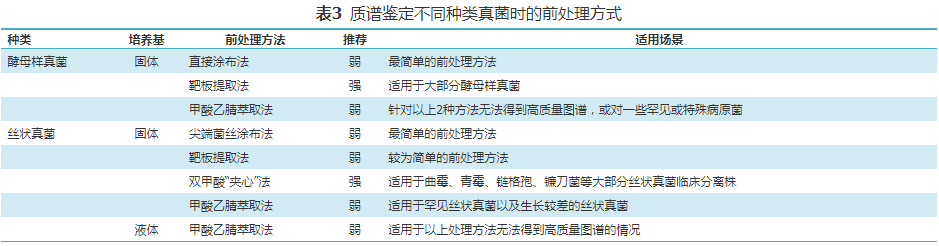
对基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)技术,必须明确鉴定范围(参见说明书),并定期完成质控。能力具备时考虑自建库,须进行能力验证(强,中)。不同真菌的前处理方式见表3。推荐对酵母样真菌进行MALDI-TOF MS技术鉴定。推荐靶板提取法(强,中)。靶板提取法未产生可接受的鉴定结果或出于生物安全考虑时,建议使用甲酸乙腈萃取法处理酵母样真菌(弱,低)。一般培养18~24 h的酵母样真菌适宜用于质谱鉴定,而生长较慢的酵母样真菌可延长至48 h。美国临床和实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)指南CLSI-M58推荐1×105~1×107 CFU/孔位的菌量以提高鉴定性能。明确质谱数据库中酵母样真菌鉴定范围,并进行定期更新。对丝状真菌,建议采用:(1)制造商推荐的甲酸乙腈萃取法(弱,低);(2)双甲酸“夹心”法作为前处理方法[80](强,中)。不建议对原始样本直接进行MALDI-TOF MS检测。对血培养、体液增菌培养样本中酵母菌,可以尝试该技术,但须进行性能验证(弱,低)。
4.免疫学检测:脑脊液和血液样本中,隐球菌荚膜多糖抗原检测阳性为隐球菌脑膜炎的确诊指标;血液样本隐球菌抗原检测阳性作为肺隐球菌病的确诊证据之一;对于检测阳性者,推荐进行半定量检测[59,62](强,高)。动态监测荚膜多糖抗原滴度,结合临床因素可作为启动治疗和调整治疗方案的证据[81, 82, 83]。
血清G实验阳性主要用于疑似IFD(包括念珠菌病、曲霉病、肺孢子菌病等)的辅助诊断,但不适用于隐球菌病和毛霉病;G实验NPV较高[84]。动态连续监测可用于指导念珠菌感染的抗真菌治疗[85](弱,中)。对G实验,输注白蛋白或球蛋白、血液透析患者、输注抗肿瘤的多糖类药物、使用磺胺类药物、外科手术后及样本接触某些纱布等可能造成假阳性;采血管污染可能出现假阳性;严重溶血样本可能造成假阳性[86]。近平滑念珠菌病时有一定假阴性率;抗真菌药物的使用可能造成假阴性。
推荐血液、BALF和脑脊液的曲霉GM试验阳性用于疑似IA(尤其是血液恶性疾病、化疗以及接受造血干细胞移植患者)的极似诊断[87]。在非粒细胞缺乏患者肺侵袭性曲霉感染时,BALF的GM试验敏感性高于血清[4,59](强,高)。建议动态监测,注意不同样本的判断阈值不同[4](弱,中)。阈值:单次血清或血浆GM值≥1.0、或BALF的GM值≥1.0、或单次血清或血浆GM值≥0.7并且BALF的GM值≥0.8、脑脊液GM值≥1.0可作为IA的阳性诊断标准。假阳性可见于其他真菌(马尔尼菲篮状菌、隐球菌等)感染、应用β内酰胺类抗菌药物(尤其是哌拉西林/他唑巴坦)、静脉注射含有半乳甘露聚糖成分的药物、食用曲霉污染的谷类及牛奶等[59,88]。假阴性可见于应用抗真菌药物、病情较轻、抗原浓度低等情况[59]。
曲霉特异IgG抗体是检测慢性空洞性肺曲霉病最敏感的方法,推荐曲霉特异IgE水平和血清总IgE升高用来确定诊断变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)[89, 90, 91](强,中)。曲霉特异IgG抗体检测可用于慢性肺曲霉病的诊断和治疗监测,推荐在治疗周期内至少检测3次[92]。念珠菌甘露聚糖抗原与甘露聚糖抗体联合检测适用于念珠菌菌血症和慢性播散性念珠菌病(弱,低)。
5.核酸PCR检测:PCR检测技术可在较短的时间内检测真菌DNA,有利于IFD的早期诊断。但到目前为止,具有注册证的PCR法诊断真菌感染的试剂盒有限。自建的PCR检测技术不能替代常规微生物学检测技术和病理学检查。推荐对真菌PCR检测的试剂、耗材进行性能验证,对结果进行全过程质量控制[93](强,高)。对于临床样本含有低丰度的真菌DNA或涂片可见真菌成分,但培养阴性时,建议采用已验证过的PCR方法对临床样本进行检测[59](弱,低)。
对于念珠菌血流感染,建议对全血液样本进行念珠菌通用PCR检测。该检测项目可用于念珠菌菌血症的排除诊断[4](弱,低)。对于耶氏肺孢子菌肺炎,建议对呼吸道样本进行PCR检测[4](弱,低)。国内有研究采用PCR对怀疑IFD的537例患者的痰样本进行检测,该方法对耶氏肺孢子菌检出的敏感度为99.28%,特异度为98.50%,阳性预测值为95.80%和NPV为99.75%,临床应用前景良好[94]。对于肺曲霉感染,建议对血液样本(全血、血清、血浆)、BALF进行曲霉通用PCR检测(弱,低)。2019年修订的EORTC/MSGERC指南中,全血、血清、血浆曲霉通用PCR法已纳入到IA极似诊断的真菌学标准[4]。欧洲临床微生物学和感染病学会(European Society for Clinical Microbiology and Infectious Diseases,ECSMID)、欧洲医学真菌学联合会(European Confederation of Medical Mycology,ECMM)和欧洲呼吸学会(European Respiratory Society,ERS)联合指南推荐适度使用BALF样本诊断IA[68]。其他下呼吸道样本可供参考。对于肺毛霉感染,建议对BALF、血清进行PCR检测(弱,低)。对于组织毛霉感染,建议对新鲜组织或福尔马林固定和石蜡包埋组织样本进行PCR检测。目前国内已经有针对组织样本中毛霉目真菌的分子检测方法,但由于缺乏标准化和全面临床评估,可作为组织病理和培养的辅助诊断方法[95]。
6. mNGS:mNGS在IFD病原学诊断中的临床应用范围包括免疫功能低下或重症IFD、疑难IFD、经验治疗和早期靶向治疗无效的IFD、对侵入性手术不耐受的IFD[96](强,中)。mNGS应用于IFD的报告解读,除了关注检测出病原真菌的特异性序列数和基因组覆盖度图之外,一定要结合临床表现、影像学、患者因素、微生物学其他检测结果、病理学检测结果、其他间接性感染性指标等综合判断[97](强,低)。
鉴于毛霉目真菌培养阳性率低、血清学G和GM试验不能覆盖等,对于免疫受损患者(如造血干细胞移植)高度怀疑毛霉目真菌感染时,推荐送检真菌涂片和培养的同时,进行血液或感染部位组织样本的mNGS检测(强,低)。耶氏肺孢子菌可在呼吸道定植,判读其mNGS结果时,推荐结合临床表现、影像学、患者因素、G实验、LDH等综合判断(强,低)。鉴于荚膜组织胞浆菌、马尔尼菲篮状菌和利什曼原虫在组织病理中难以区分,在非流行区组织病理怀疑以上病原体时,mNGS检测可作为辅助病原学诊断手段之一(弱,低)。在BALF中,mNGS测出少量新型隐球菌序列,应参考外周血或BALF隐球菌荚膜多糖抗原检测结果(强,低)。在BALF中,mNGS测出少量曲霉序列,应参考BALF GM实验结果(弱,低)。mNGS在 IFD 病原学诊断中的技术问题包括:高成本、人类患者宿主细胞的影响、外源微生物污染、厚壁真菌核酸提取效率低(尤其是隐球菌)等。mNGS应用于IFD病原学诊断的流程亟须标准化。
7.抗真菌药物敏感性试验:推荐使用肉汤稀释法进行抗丝状真菌药敏试验。微量肉汤稀释法和宏量肉汤稀释法检测抗丝状真菌MIC具有良好一致性。纸片扩散法可补充肉汤稀释法用于抗丝状真菌药敏试验[98](强,中)。推荐纸片扩散法培养基为不补充钙、镁的MH琼脂平板,接种浓度为0.4×106~5×106 CFU/ml。两性霉素B的判读标准为生长完全抑制的抑菌环,泊沙康唑、伏立康唑、伊曲康唑和卡泊芬净判读标准为80%抑制。进行肉汤稀释法抗丝状真菌药敏试验,方法、流程、质量控制及结果判读推荐参考CLSI M38[99],结果解释推荐参考CLSI M38M51S[100]及M57S[101](强,中)。推荐用RPMI-1640肉汤制备终浓度为0.4×104CFU/ml~5×104 CFU/ml的菌悬液。两性霉素B、伊曲康唑、泊沙康唑、伏立康唑、艾沙康唑的生长终点判断标准为100%抑制,氟康唑、氟胞嘧啶和酮康唑的生长终点判断标准为约50%抑制,棘白菌素类应用最低有效浓度(minimum effective concentration,MEC)生长终点的概念。目前只建立了伏立康唑对烟曲霉的临床折点。对于烟曲霉外的曲霉,两性霉素B、卡泊芬净、艾沙康唑、伊曲康唑、泊沙康唑和伏立康唑已建立了流行病学界值。
推荐使用肉汤稀释法进行抗酵母及酵母样真菌药敏试验。微量肉汤稀释法和宏量肉汤稀释法检测抗酵母及酵母样真菌MIC具有良好一致性。纸片扩散法可替代肉汤稀释法用于抗酵母及酵母样真菌药敏试验[102](强,中)。推荐纸片扩散法培养基为0.5%亚甲蓝+2%葡萄糖MH琼脂平板,接种浓度为0.5麦氏单位。两性霉素B的判读标准为生长完全抑制的抑菌环。唑类、氟胞嘧啶和卡泊芬净判读标准为量取至有正常大小菌落生长的抑菌环直径大小。进行肉汤稀释法抗酵母及酵母样真菌药敏试验,方法、流程、质量控制及结果判读推荐参考CLSI M27[103],结果解释推荐参考CLSI M27M44S[104]及M57S[101](强,中)。推荐用RPMI-1640肉汤制备终浓度为5×102~2.5×103 CFU/ml的菌悬液。两性霉素B的生长终点判断标准为100%抑制,唑类、氟胞嘧啶、棘白菌素类的生长终点判断标准为约50%抑制。目前只建立了白念珠菌、光滑念珠菌、克柔念珠菌、近平滑念珠菌、热带念珠菌、季也蒙念珠菌的药敏试验判定折点。
结果报告应关注特定菌种的天然耐药性和感染部位抗真菌药物的有效药物浓度(强,低)。药敏试验报告中,不报告对特定药物具有天然耐药性的实验结果,如隐球菌属不报告棘白菌素类;克柔念珠菌不报告氟康唑;红酵母菌属不报告棘白菌素类及氟康唑;曲霉属不报告氟康唑;淡紫紫孢菌不报告两性霉素B;毛霉目不报告氟康唑、伏立康唑、伊曲康唑和棘白菌素类;毛孢子菌属不报告棘白菌素类;镰刀菌属不报告氟康唑和棘白菌素类;多育节荚孢霉不报告两性霉素B及氟康唑。泌尿系统感染不报告棘白菌素类、伏立康唑、伊曲康唑,眼部感染不报告棘白菌素类。
结果解释需注意临床折点和流行病学界值的不同意义(强,低)。临床折点的建立是基于MIC分布、药物代谢动力学/药效学参数、临床疗效与MIC结果的关系,可预测临床疗效,可将菌株分为敏感、剂量依赖性敏感、中介、耐药或非敏感。流行病学界值仅根据体外数据建立,基于MIC分布,不能预测临床疗效,但可识别耐药突变菌株,可将菌株分为野生型与非野生型(有/无获得性耐药或敏感性降低)。
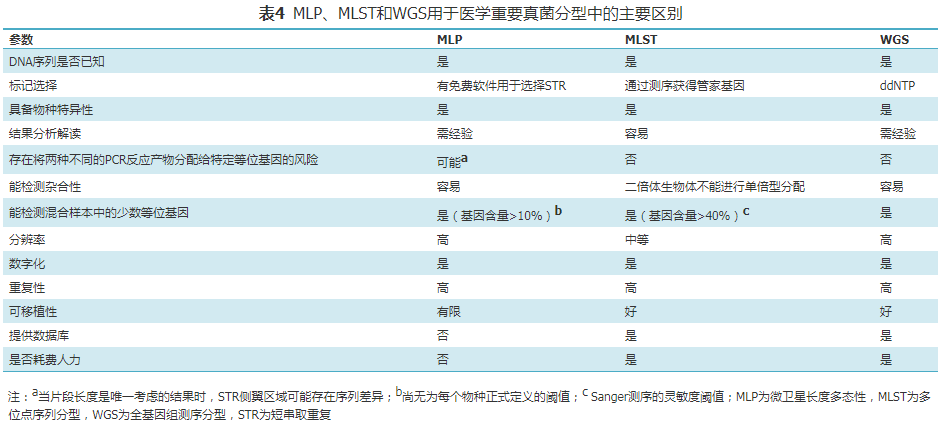
8.真菌同源性分析:医学上重要真菌基因分型在研究真菌感染的暴发、医院传播、感染途径和基因型表型相关性等方面都有应用,特别是在继发性耐药方面有较深入的研究。目前比较常用的方法有3种:多位点序列分型(multilocus sequence typing,MLST)、使用短串联重复(short tandem repeat,STR)标记的微卫星长度多态性(microsatellite length polymorphism,MLP)和全基因组测序分型(whole-genome sequencing,WGS)[105, 106, 107, 108]。
建议采用MLST、MLP 和 WGS 技术,对目标菌株进行同源性判断。依据技术特点(表4)和实验室实际能力,选择相应技术。MLST和MLP不能确定分型的菌株可使用WGS进行分型(弱,低)。IC通常使用MLP或MLST基因分型方法。在耳念珠菌病,MLP分型具有快速、高分辨率的特点,有助于在亚种水平上对临床分离株进行初步分类 [109, 110](弱,低)。曲霉流行病学研究推荐使用MLP方法[105](弱,低)。
 /3
/3 